火针干预脊髓损伤大鼠后血清对神经干细胞增殖分化的影响
李 岩 ,周 震 ,程素利 ,焦召华 ,陈 爽
(1.天津市公安医院,天津 300042;2.天津中医药大学第二附属医院,天津 300150;3.天津中医药大学,天津 300193)
脊髓损伤(SCI)是交通事故、工矿事故及自然灾害中常见的、严重危害人类健康的疾病,患者多出现损伤平面以下的感觉、运动障碍及尿便功能异常[1]。目前,国内外对于SCI的治疗研究多集中在具有自我更新和定向分化潜能的神经干细胞(NSCs)上[2]。笔者在临床应用火针多年,发现其对慢性SCI疗效显著[3]。前期研究也发现,火针对于脊髓神经细胞具有保护和抗凋亡作用[4-5]。但火针是否可能通过影响NSCs的增殖及分化产生作用尚不清楚。本课题应用细胞离体培养和血清药理学的方法,就火针干预SCI大鼠后血清对脊髓NSCs增殖分化的影响进行相关研究。
1 材料与方法
1.1 实验动物 1)孕14 d昆明小鼠2只,清洁级。2)健康SD大鼠15只,体质量250~300 g,由北京维通利华实验动物技术有限公司提供,许可证号:SCXK(京)2007-0001,随机分为假手术组、模型组与火针组,每组5只。
1.2 SCI模型动物建立 采用改良的Allen’s法[6]建立急性SCI动物模型。即采用20 g/L戊巴比妥钠(40 mg/kg体质量)腹腔注射将大鼠麻醉,取后正中切口,切除T9棘突、部分T10棘突和部分椎板,暴露硬膜,10 g的铁锤从25 mm高处自由落下,撞击硬膜囊,撞击能量为25mm×10g,损伤直径为2.5mm。与脊髓接触的撞杆底端呈弧状凹陷,直径2.5 mm,与脊髓表面相吻合。撞击成功的标志为大鼠尾巴痉挛性摆动,双下肢及身体回缩样扑动,双下肢呈弛缓性瘫痪。假手术组只做T9-T10椎板切除术。术后小心护理饲养,每天挤压排尿3次,直到反射性膀胱排空建立。
1.3 干预方法 火针组选取大鼠脊髓损伤部位上下端的棘突间隙,相当于T7、T8及T11、T12部位,各旁开0.5 cm,共4个穴,8个针刺点,采用快针法火针针刺,每穴仅刺1针,深度为3~5 mm。造模后即行针刺1次,之后每隔24 h针刺1次,共治疗3次。
1.4 目标血清制备 SD大鼠采血前禁食12 h,于第三次针刺后麻醉,无菌条件下腹主动脉取血,分离血清。56℃灭活30min,220nm滤膜滤过除菌,-20℃保存备用。
1.5 神经干细胞的分离、培养及鉴定 取孕14 d昆明小鼠,无菌取出胎鼠,经D-Hanks液反复冲洗,解剖镜下剥离皮肤、肌肉等组织,眼科剪剪碎脊髓,0.25%胰蛋白酶消化,吸管吹打,200目铜网过滤,离心,弃上清,加入含有 DMEM/F12、2%的 B27、20ng/mL碱性成纤维生长因子(bFGF)、20 ng/mL、表皮细胞生长因子(EGF)、100 U/mL 青霉素、100 μg/mL 链霉素的生长培养基,以5×105个/mL密度接种入25cm2培养瓶中,置入37℃、5%CO2饱和湿度培养箱中培养。此后每3 d半量换液1次,每7 d左右传代1次。传代培养纯化的细胞经Nestin鉴定,显示Nestin免疫反应阳性,表明所培养的细胞为神经干细胞。
1.6 NSCs增殖及生长状态观察 离心收集传代培养8代的NSCs,吸管机械吹打,分离制备单细胞悬液,显微镜下计数。将细胞接种于12孔培养板,接种密度为 2×105个/mL。
各组NSCs按培养基中所含血清成分的不同共分3组,即假手术组、模型组及火针组。各组培养基均为含10%浓度SD大鼠不同血清成分的DMEM/F12基础培养基(不含B27、rhEGF和rhbFGF),每4孔为同一血清成分培养液。
培养7 d后,拟分孔收集呈球形悬浮生长的细胞,再次机械分离制备单细胞悬液,显微镜下细胞计数。实验重复3次。
1.7 NSCs诱导分化观察 离心收集传代培养8代呈球形悬浮生长的NSCs,吸管机械吹打分离成约含十几个细胞的干细胞小球,分别接种于预先铺有多聚赖氨酸盖玻片的12孔培养板,培养基分别为上述3组含10%不同血清成分的培养基,每4孔为同一血清成分培养液,诱导NSCs分化。实验重复3次。
1.8 免疫荧光染色 细胞贴壁培养7 d后,取各组盖玻片上的细胞,经磷酸盐缓冲溶液(PBS)洗后,4%多聚甲醛固定30 min,后接常规免疫荧光染色步骤。以β-tubllin标记分化的神经元,4,6-联脒-2-苯基吲哚(DAPI)标记细胞核,每张玻片采用双盲法选择5个视野计数神经元的比例。
1.9 统计方法 数据统计采用SPSS18.0软件,进行单因素方差分析,两两间均值比较采用Student-Newman-Keuls检验。
2 结果与分析
2.1 各组NSCs增殖及生长情况 在相差显微镜下,细胞接种于12孔培养板后,第1天,模型组细胞死亡较多,假手术组和火针组无明显变化,细胞死亡尚少。各组形成了悬浮的、数量不等、大小不一的细胞团。3 d后,各组细胞多数呈球形且开始贴壁,并发出细小的突起。3组中,火针组细胞最多,开始贴壁时间最早,模型组细胞数最少,贴壁出现最晚。
2.2 各组NSCs分化情况 各组神经干细胞向神经元分化情况见表1和图1。从表1可看出,3组NSCs均出现神经元分化,与模型组及假手术组相比,火针组神经元比例显著增高,差异具有统计学意义(P<0.05)。
表1 神经干细胞培养7 d后各组NSC分化为神经元的比例(±s)Tab.1 The proportion of NSC differentiated neuron after neural stem cells cultured 7 days(±s)%
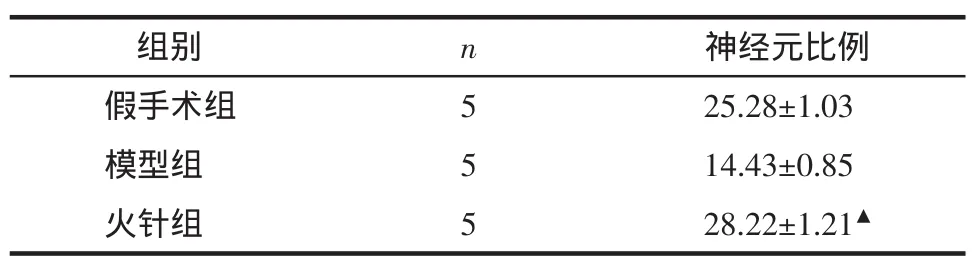
表1 神经干细胞培养7 d后各组NSC分化为神经元的比例(±s)Tab.1 The proportion of NSC differentiated neuron after neural stem cells cultured 7 days(±s)%
注:经多因素方差分析,与模型组相比,▲P<0.05。
组别 n 神经元比例假手术组 5 25.28±1.03模型组 5 14.43±0.85火针组 5 28.22±1.21▲

图1 不同血清作用7 d后,神经干细胞分化情况Fig.1 The differentiation of neural stem cells affected by the different blood serum after 7 days
3 讨论
NSCs为中枢神经系统中的原始细胞,具有自我更新和多潜能分化的特性,可以分化为神经元、星形胶质细胞和少突胶质细胞[7-8]。自1992年Renyolds等[9]从成年小鼠纹状体分离得到能在体外不断增殖且可多向分化的NSCs,为中枢系统神经损伤的治疗提供了新思路。
SCI的病理过程分为原发性损伤和继发性损伤,其中神经细胞的病理性凋亡是继发性损伤的关键病理基础[10],故适当诱导NSCs增殖并向神经元分化以弥补其损失,将成为SCI的潜在治疗方法。
课题组在前期研究中证实,火针能减少SCI大鼠白介素-1β(IL-1β)、Caspase-3、p38MAPK 等凋亡相关蛋白的表达[10],抑制凋亡细胞发生[11],表明火针能抑制SCI大鼠炎症反应及细胞凋亡,从而发挥神经保护作用。那么火针在抑制SCI大鼠细胞凋亡的同时,能否通过诱导NSCs增殖并向神经元分化以弥补凋亡的神经细胞,从而治疗SCI?为探讨此问题,课题组设计实施了本次研究。
本研究结果发现,火针干预后的SCI大鼠血清可促进离体状态下的NSCs增殖,与假手术组及模型组相比细胞数目明显增多;从神经元分化角度,火针组神经元分化比例增高,与另两组比较差异具有统计学意义,表明火针干预后的SCI大鼠血清可促进NSCs增殖并可诱导其向神经元分化,这为火针治疗SCI提供了部分实验依据。但本实验仅为离体细胞培养,火针能否对SCI大鼠内源性NSCs的增殖及向神经元分化产生作用及其作用机制,尚需进一步研究证实。
[1]王俊娟,许华燕,黄 波,等.脊髓损伤的研究进展[J].四川解剖学杂志.2011,19(4):37-41.
[2]Zhang N,Wimmer J,Qian SJ,et al.Stem cells:Current approach and future prospects in spinal cord injury repair[J].Anat Rec(Hoboken).2010,293(3):519-530.
[3]焦召华,李 岩,程素利,等.火针治疗脊髓损伤后排尿困难13例[A].“针灸临证经验、医案学术研讨会”论文汇编,天津:2012.
[4]孙立明,李 岩,周 震,等.火针对脊髓损伤模型大鼠凋亡细胞的影响[J].针灸临床杂志.2011,27(1):58-61.
[5]李 岩,程素利,周 震,等.火针对大鼠脊髓损伤后运动功能及BDNF 表达的影响[J].2012,29(6):545-547.
[6]Khan T,Havey RM,Sayers ST,et al.Animal models of spinal cord contusion injuries[J].Lab Anim Sic.1999,49(2):161-172.
[7]Taga T,Fukuda S.Role of IL-6 in the neural stem cell differentiation[J].Clin Rev Allergy Immunol.2005,28(3):249-256.
[8]范英昌,华声瑜,李广斌,等.中药干预骨髓基质细胞移植心肌再生的实验研究[J].天津中医药,2008,25(3):180.
[9]Reynold BA,Weiss S.Generation of neurons and astrocytes from isolated cells of the adult mammalian central nervous system[J].Science.1992,255:1707-1709.
[10]Zhang N,Yin Y,Xu SJ,et al.Inflammation&apoptosis in spinal cord injury[J].Indian J Med Res.2012,135(3):287-296.
[11]孙立明,李 岩,周 震,等.火针对脊髓损伤模型大鼠凋亡相关蛋白表达的影响[J].针灸临床杂志.2010,26(12):49-53.