鸡传染性法氏囊病与巴氏杆菌病二价活载体疫苗的免疫原性及免疫效力研究
黄巧珍,荣 俊,匡红艳,蔡联燊 (长江大学生命科学学院,湖北 荆州 434025)
鸡传染性法氏囊病与巴氏杆菌病二价活载体疫苗的免疫原性及免疫效力研究
黄巧珍,荣 俊,匡红艳,蔡联燊 (长江大学生命科学学院,湖北 荆州 434025)
将实验工程菌经体外表达并检测其免疫原性后,分别添加壳聚糖和明胶佐剂制备成不同的剂型疫苗,采用局部肌肉注射、灌胃、滴鼻免疫实验用SPF鸡,检测了自制的一种多杀性巴氏杆菌病和传染性法氏囊病的二价活菌载体疫苗的免疫效力。结果显示:(1)工程菌体外表达可用琼脂双向免疫扩散实验(AGP)检测到IBDV抗原。(2)不同途径免疫后用AGP检测抗IBDV抗体,注射组检出率最高,最高时达90%;明胶佐剂口服免疫组其次,最高时达80%。抗体检出率最高的时间是免疫后的第4至5周。(3)IBDV抗体的ELISA检测结果,无样本达到试剂盒规定的阳性标准,但其D650nm的变化规律与AGP相似。(4)PM抗体的ELISA检测结果,只有注射组在免疫后6周达到阳性标准,D650nm的变化规律显示壳聚糖佐剂和明胶佐剂口服组较好。该结果表明,该二价活载体疫苗体液免疫的效果是确实的,但抗体水平不高。
多杀性巴氏杆菌(PM);传染性法氏囊病(IBDV);VP2表达;活载体疫苗;免疫试验
多杀性巴氏杆菌(Pasteurella Multocida,PM)是巴氏杆菌病(Pasteurella Multocida Disease,PMD)的病原体,能感染包括猪、牛、鸡在内的多种动物,引起严重疾病,如禽霍乱、牛出血性败血症、猪萎蔫性鼻炎,给养殖业造成巨大的损失[1]。传统的防治巴氏杆菌病(PMD)的方法是给易感动物服用注射高免血清或减毒菌苗,由于其效能单一,难于满足市场要求。传染性法氏囊病(Infectious Bursal Disease,IBD)是由双链RNA病毒科的传染性法氏囊病病毒(Infectious Bursal Disease Virus,IBDV)所引起的一种鸡的急性暴发性传染病[2-3],表现为中枢免疫器官法氏囊的淋巴细胞坏死,发病率及死亡率均较高。目前使用较多的IBD活疫苗,这是一种未完全减毒的中等毒力活疫苗,其主要目的是提供足够强的免疫刺激以产生对机体保护作用,但中等毒力活疫苗对鸡的毒性较大,会造成免疫鸡的轻度感染和免疫抑制,影响鸡的生长和对其它病原的易感性提高。PMD和IBD的防治对我国养禽业的健康发展有重要意义。近年来由于基因克隆和重组技术的日益完善和实用化,许多实验性重组IBD疫苗研发问世,这些疫苗多以病(毒为活载体,例如1995年报道的Darteil等在实验室条件下
成功构建的能表达IBDV VP2抗原的重组火鸡疤疹病毒HTV活疫苗[4],由于PM能被动物机体的免疫细胞吞噬,具有良好的抗原呈递性能,使其有望成为活菌载体疫苗,重组IBD疫苗与PM组合成二价活苗有潜在的可能性。为此,本研究探讨了自制的一种鸡传染性法氏囊病与巴氏杆菌病二价活载体疫苗的免疫原性,并采用局部肌肉注射、灌胃、滴鼻免疫实验用SPF鸡,通过双向琼脂免疫扩散实验(AGP)和ELISA抗体检测这种二价活菌载体疫苗的免疫效力,以期为制备鸡传染性法氏囊病与巴氏杆菌病二价活载体疫苗提供参考。
1 材料与方法
1.1 材料
1.1.1 试验菌株
试验所用菌株PM R473/ EPSPBAKR-pucR-PRPL-VP2由长江大学生命科学学院分子生物实验室以PM R473 菌株(购自中国兽医药品监察所)加载一个巴氏杆菌-大肠杆菌穿梭表达质粒构建而成。
1.1.2 试验动物
试验所用2周龄SPF鸡由青岛易邦生物技术有限公司实验动物中心提供。
1.1.3 培养基和主要试剂
脑心浸出汁肉汤(Brain Heart Infusion,BHI)培养基为美国BD (Becton Dickinson)公司产品,称取BHI培养基37g,溶于1L ddH2O中,灭菌备用;IBDV阳性抗血清、IBD琼扩抗原购于哈尔滨兽医研究所; IBDV抗体ELISA检测试剂盒、PM抗体ELISA检测试剂盒为美国IDEXX公司产品;壳聚糖购于浙江澳兴生物有限公司;明胶为沈阳市光兰化工贸易有限公司产品,分析纯级;pH7.3的0.01mol/L PBS溶液自制。
1.2 方法
1.2.1 体外表达实验
将本实验室构建的质粒EPSPBAKR-pucR-PRPL-VP2电转化至PMR473感受态细胞中,构建成表达工程菌。电转化方法参考文献[5]。先29℃扩大培养至稳定期(D600nm=0.8~1.2),然后升温至42℃ 6h诱导表达。转化菌通过VP2基因的PCR实验进行鉴定,琼脂双向免疫扩散实验检测表达产物的免疫原性。
1.2.2 巴氏杆菌-鸡传染性法氏囊病毒二价活载体疫苗的制备
将PM R473/ EPSPBAKR-pucR-PRPL-VP2接种于含卡那霉素50μg/ml的1L BHI培养液摇瓶中200r/min的摇床上29℃过夜培养,于次日按10ml/管收菌,约0.05g(湿菌)/管。
(1)无佐剂活载体疫苗制备 每支取活菌约0.05g,用2ml无菌生理盐水混匀稀释。
(2)壳聚糖佐剂活载体疫苗的制备 90%脱乙酰度壳聚糖与生理盐水配成10%的溶液,再经超声波(12W)处理2次,每次5min,间隔1min。以600r/min离心10min后取上清,并以400目网筛过滤,再以12000r/min离心10min后收集其沉淀物制成壳聚糖小颗粒。将其按3%的比例溶解于0.8%稀乙酸盐水中即成壳聚糖酸溶液[6],灌胃途径疫苗为0.05g活菌用2ml无菌的壳聚糖酸溶液稀释混匀,滴鼻途径则取1ml无菌的壳聚糖酸溶液将0.05g活菌稀释混匀,此即壳聚糖佐剂活载体疫苗。
(3)明胶佐剂活载体疫苗制备 取55℃左右40%的明胶水溶液2ml、预热的植物油10ml与10ml收菌约0.05g的巴氏杆菌混合后用超声波(12W)乳化3min,然后在冰水浴中电磁搅拌10min,形成微球后加入10ml异丙醇,继续搅拌5min,取出后置室温30min,吸干析出的油滴,再用异丙醇洗涤至无油滴为止,加入适量10%甲醛异丙醇固化过夜,去上清后用冻干机干燥。将制好的微球经悬于磷酸缓冲液2mlPBS中,即得1支明胶佐剂活载体疫苗[7]。
1.2.3 SPF鸡免疫试验
2周龄SPF鸡6组,每组10只。免疫前采血液样本检测抗体水平作为对照比较免疫结果。按不同佐剂和免疫途径分6组进行活载体疫苗免疫试验(表1)。

表1 SPF鸡免疫试验
1.2.4 血清性抗体检测

2 结果与分析
2.1 重组质粒的PCR鉴定和体外表达VP2抗原琼脂扩散免疫检测
对插入了VP2基因的表达载体的工程菌进行PCR鉴定,可扩增出VP2基因约1400bp,而无VP2基因的表达载体插入的PMR473菌液扩增无该特异条带(图1A)。PMR473/EPSPBAKR-pucR-PRPL-VP2菌株的诱导表达产物上清采用IBDV VP2抗原琼脂扩散免疫检测,结果表明插入了重组质粒的PMR473表达产物有IBDV VP2蛋白抗原的免疫原性,而无VP2基因的表达载体插入的PMR473表达产物不具VP2蛋白抗原的免疫原性(图1B)。以上结果表明穿梭质粒上的VP2 基因表达了目的蛋白,并且具备IBDV VP2蛋白抗原的免疫原性。

1:阳性质粒;2:阴性对照;3:转化菌;M:DL marker 8000 0:IBDV阳性抗血清;1:IBDV琼扩抗原;2:表达上清产物;3:表达上清1/2稀释液;4:破碎全菌液;5:60%硫酸铵沉上清产物;6:阴性对照 A.VP2基因PCR结果 B:表达产物VP2抗原琼扩图
2.2 不同免疫途径的IBDV抗体琼脂免疫扩散检测
表2为不同途径免疫后不同时间段的IBDV琼脂扩散检测统计结果。由表2可见,该工程菌制备的活载体疫苗均可诱导SPF鸡产生抗IBDV的抗体。其中1组注射免疫明显效力最好,检出率最高,最高时达90%。2、3组佐剂灌胃比4组无佐剂灌胃的SPF鸡抗体阳性检出率高,相比之下第3组明胶佐剂抗体阳性检出率较高,最高时达80%,2种途径抗体检出率最高的时间是免疫后的第4~5周。说明佐剂对于疫苗免疫过程中的抗原呈递有一定作用,并且明胶比壳聚糖佐剂更耐胃酸,表现的免疫效力稍好;另外对照2组壳聚糖佐剂灌胃组,滴鼻免疫途径短期也有显著效果,在免疫后5周达到最高阳性率,表明了虽然滴鼻途径疫苗在对鼻腔粘膜刺激时间较短,但大剂量、多次滴鼻免疫较灌胃能更好的刺激SPF鸡抗法氏囊病病毒的免疫反应。
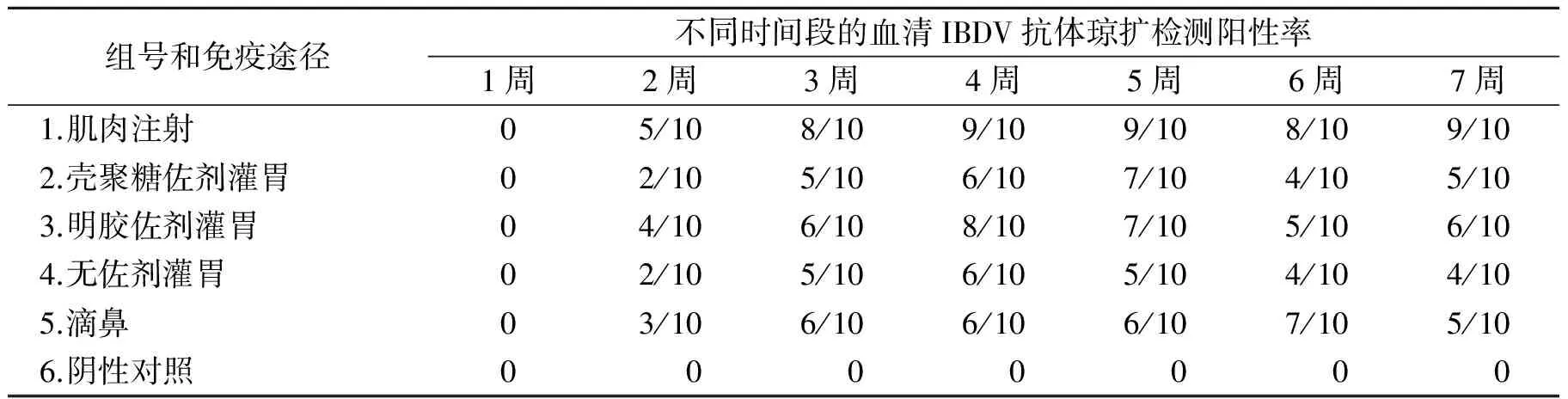
表2 不同时间段的血清IBDV抗体琼扩检测阳性率统计
2.3 不同免疫途径的IBDV抗体ELISA检测
经IDEXX IBDV抗体检测试剂盒检测,所有SPF鸡血清样本S/P<0.2,全判定为阴性(表3)。从表3可看出,较接近抗体IgG阳性水平的有1组注射途径的第7周和3组明胶佐剂灌胃途径的第4周,虽然IBDV抗体的ELISA检测水平很低,但D650nm值的变化规律与AGP检测相似,注射途径是其中效果最显著的(P<0.01);灌胃途径中明胶佐剂组最优(3组P<0.01);壳聚糖佐剂组滴鼻途径第3周抗体IgG水平最高,但在第7周2种佐剂灌胃途径抗体IgG水平高于滴鼻途径,说明滴鼻途径免疫短时间效果良好,但不稳定。ELISA对抗IBDV VP2抗体的检出率低于AGP,这种现象与本实验室以前报道的结果相似[8]。原因在于IBDV抗体ELISA检测试剂盒系IBDV全病毒抗原包被的,而用VP2表达产物制备的疫苗是单一的抗IBDV VP2抗体。在抗原决定簇的识别上有明显的差异,由此导致阳性检出率低。虽然IBDV抗体的ELISA检测结果无样本达到试剂盒规定的阳性标准,但其D650nm的变化规律与AGP相似,可以作为AGP的参考。

表3 SPF鸡不同免疫途径随时间变化的IBDV和PM抗体D650nm检测统计(平均值±标准差)
2.4 不同免疫途径的PM抗体ELISA检测
PM抗体的ELISA检测结果表明只有注射组在免疫后6周达到阳性标准(表3)。D650nm的变化规律显示壳聚糖佐剂和明胶佐剂灌胃组较好。从表3可看出,除注射组外的另几组中略占优势的是2组壳聚糖佐剂灌胃途径,其中3组明胶佐剂灌胃途径第4周抗体IgG水平与之接近(P<0.01);壳聚糖佐剂灌胃组与滴鼻组免疫效果差异不显著(P>0.05)。
3 讨论
PM重组表达载体菌在体外的表达产物用IBDV VP2抗血清琼脂扩散免疫扩散能检测出来,说明该PM重组菌株在体外表达了有VP2免疫原性的蛋白。此次免疫试验后的SPF鸡活动、饮食、代谢都没太大影响,表明了这种PM重组活疫苗较安全,有良好的应用前景。本研究免疫后的SPF鸡抗体水平虽然较弱,但与对照组相比有显著性差异。表明自制的重组活载体PM二价疫苗还是有一定的免疫作用。一方面弱毒活载体疫苗虽然可以产生一定的粘膜免疫和体液免疫,但受免疫方法和途径影响,且疫苗激发机体产生的免疫水平通常较低。注射免疫效果虽好,但使用不方便,且不利于大规模养殖;灌胃免疫虽利于重复接种却很容易造成疫苗被消化道降解,导致疫苗吸收效率低;滴鼻点眼也只能使疫苗在鼻腔内存在15min,不能激发较高的粘膜免疫[9]。另一方面本研究中免疫间隔时间过短及频繁免疫,使抗原的频繁刺激机体应答反应疲劳,造成免疫受抑制[10]。此外本研究选用的PM R473是从牛体内分离得到的菌株,与禽类PM存在一定差异,对禽类动物的毒力较弱,感染SPF鸡能力不是很强,诱导机体产生的免疫应答较弱且免疫维持时间短,使活载体疫苗的体液免疫效价不高,具细胞免疫和粘膜免疫的效果和对实验鸡的保护作用还未进行全面的检测。
本研究中IBDV抗体ELISA检测试剂盒系IBD全病毒抗原包被,检测抗体滴度较高,而重组活载体疫苗是由VP2蛋白激发SPF鸡产生的抗体,对该试剂盒包被抗原不太敏感,因此需建立一种科学有效的与IBDV VP2抗原特异结合的抗体检测方法。采用的2种佐剂在一定程度上提高了疫苗的免疫效果,说明壳聚糖和明胶可作为良好的黏膜免疫佐剂。采用多大剂量以及如何优化这2种佐剂制备工艺,进一步激发机体免疫反应,提高机体免疫力水平,还有待深入研究。
[1]陆承平.兽医微生物学[M].北京:中国农业出版社,2001:123-124.
[2]殷 震,刘景华.动物病毒学(第2版)[M].北京:科学出版社,1997:578-587.
[3]Thierry P,van den Berg.Acute infectious bursal disease in poultry:a review [J].Avian Pathology,2000,29:175-194.
[4]Darteil R,Bublot M,Laplace E.Herpesvirus of turkey recombinant viruses expressing infectious bursal disease virus (IBDV) VP2 immunogen induce protection against an IBDV virulent challenge in chickens [J].Virology,1995,211:481 -90.
[5]Margie D Lee,Adam D Henk.RSF1010-based shuttle vectors for cloning and expression in Pasteurella multocida [J].Veterinary Microbiolgy,1997,54:369-374.
[6]Westerink M A,Smithson S L,Srivastava N,et al.Projuvant (Pluronic F127/chitosan) enhances the immune response to intranasally administered tetanus toxoid [J].Vaccine,2001,20:711-723.
[7]Nakaoka R,Tabata Y,Kada Y,et al.Potentiality of gelatin microspheres as immunological adjuvant [J].Vaccine,1995,13:653.
[8]Rong J,Jiang T,Cheng T,et al.Large-scale manufacture and use of recombinant VP2 vaccine against Infectious bursal disease in chickens [J].Vaccine,2007,25:7900-7908.
[9](美) Saif Y M(苏敬良,高福,索勋主译).禽病学(第11版) [M].北京:中国农业出版社,2005:66-92.
[10]司振书.家禽免疫抑制性病毒的作用机理 [J].畜禽业,2004 ,(6):26-27.
2013-01-20
黄巧珍(1986-),女,硕士生,主要从事动物基因工程疫苗研究。
荣 俊,E-mail:rongjun59626@gmail.com。
S852.4
A
1673-1409(2013)05-0044-05

