磁共振对比剂灌注成像在鉴别胶质瘤复发与放射性脑损伤中的应用
王玉林,刘梦雨,王 岩,肖华锋,孙 璐,张 军,马 林
中国人民解放军总医院 1放射诊断科 2病理科 3神经外科,北京 100853
磁共振对比剂灌注成像在鉴别胶质瘤复发与放射性脑损伤中的应用
王玉林1,刘梦雨1,王 岩1,肖华锋1,孙 璐2,张 军3,马 林1
中国人民解放军总医院1放射诊断科2病理科3神经外科,北京 100853
目的分析磁共振(MR)灌注成像在鉴别胶质瘤复发与放射性脑损伤中的作用。方法选取23例脑胶质瘤术后放疗后并出现新强化灶的患者,所有患者均经二次手术病理或随访(随访时间>6个月)证实为胶质瘤复发或放射性脑损伤。23例患者均行常规MR平扫、增强扫描和MR脑灌注成像。灌注成像采用梯度回波-回波平面成像(GRE-EPI)序列,感兴趣区(ROI)放置在横断面T1WI异常强化区域和对侧相对正常的脑白质内,大小为20~40 mm2,每个患者平均测量10次,计算异常强化区与对侧正常区的参数比值,即相对脑血容量(rCBV)、相对脑血流量(rCBF)、相对平均通过时间(rMTT)、达峰时间(rTTP)及团注到达时间(rBAT),采用分组t检验比较胶质瘤复发和放射性脑损伤组间各灌注参数。结果23例患者最终经手术和随访证实有13例胶质瘤复发,10例放射性脑损伤。胶质瘤复发rCBV和rCBF比值分别为3.60±3.86和2.88±2.27,明显高于放射性脑损伤的0.82±0.74(P=0.000)和0.84±0.80(P=0.000);rMTT(P=0.204)、rTTP(P=0.260)和rBAT(P=0.071)的比值在两组间差异没有统计学意义。rCBV和rCBF鉴别诊断为胶质瘤复发或放射性脑损伤的曲线下面积均为0.876。结论MR灌注成像是鉴别胶质瘤复发和放射性脑损伤的有效方法,rCBV和rCBF比值鉴别诊断界值分别为1.3088和1.1235,可作为可靠的临床指标。
神经胶质瘤;复发;脑损伤;放射性;磁共振成像;灌注
ActaAcadMedSin,2013,35(4):416-421
手术切除和放射治疗是胶质瘤患者的两种主要治疗方式,对于恶性胶质瘤患者,常规治疗手段为手术切除后辅以放射治疗及靶向化疗。术后常规辅以放射治疗可以延长患者的生存期并加强治疗效果,但同时也带来了负面效应。胶质瘤患者在接受脑部放射性治疗后的一段时间内(3个月~10年),部分患者会出现不同程度的放射性脑损伤,主要表现包括由于血脑屏障破坏所导致的放射性脑坏死和射线所致的广泛白质脱髓鞘[1-3],而放射性脑损伤的最终结果为放射性脑坏死。对于术后放疗后胶质瘤患者,一旦脑内出现新的异常强化病灶,需要鉴别该新发强化灶是肿瘤复发抑或放射性脑坏死,目前用于鉴别两者的诊断方法包括灌注成像(perfusion weighted imaging,PWI)、核磁波谱(magnetic resonance spectrum,MRS)、正电子发射断层扫描(positron emission tomography,PET)和201T1单光子发射计算机断层显像(201T1 single-photon emission computed tomography,201T1-SPECT)等。其中,PWI是反映组织微血管分布及血流灌注情况的MR检查技术,可以通过测量多种血流动力学参数,如相对脑血容量(relative cerebral blood volume,rCBV)、相对脑血流量(relative cerebral blood flow,rCBF)、平均通过时间(mean transit time,MTT)、达峰时间(time to peak,rTTP)及团注到达时间(bolus arrive time,rBAT)等无创地评价脑组织灌注情况。胶质瘤复发病灶在微血管形成的数量及程度方面与放射性脑坏死是有根本区别的。因此,本研究旨在通过灌注参数的比较来评价灌注成像在鉴别胶质瘤复发和放射性脑坏死中的价值。
对象和方法
对象2011年10月至2012年12月在中国人民解放军总医院就诊的患者23例,其中,男15例,女8例,平均年龄(47±6)岁(32~72岁)。纳入标准:(1)脑内胶质瘤术后(手术病理证实);(2)术后进行术区局部或全脑的放射治疗(总剂量>54 Gy);(3)MR随访中,在原病灶区或放射治疗范围内新出现异常强化病灶。23例患者初次手术病理均证实为星形胶质细胞瘤,世界卫生组织(World Health Organization,WHO)2~4级;异常强化病灶经第2次手术病理证实12例,随访证实11例。随访时间>6个月。随访时间内病灶明显缩小或强化程度减弱则考虑为放射性脑损伤;随访时间内病灶明显增大或强化程度增加,则可考虑肿瘤复发,建议活检或手术;如未见明显变化,则延长随访时间,再行分类。所有患者均签署了检查知情同意书。
MR检查采用GE 3.0 T 750 MR成像系统(Signa Excite,GE Healthcare,Milwaukee,WI USA)及32通道头线圈。研究所纳入的患者均先进行头部常规MR扫描,然后再行MR灌注成像及增强扫描。检查前通过对患者头部两侧进行软物填充,尽可能减少其头部运动。
常规MR平扫:包括横断面液体衰减反转恢复(fluid attenuated inversion recovery,FLAIR)序列T1WI,TR 1850 ms,TE 24 ms,TI 780 ms;FSE序列T2WI:TR 5000ms,TE 115 ms,TI 2100 ms;冠状面FLAIR序列T2WI,TR 8500 ms,TE 162 ms。层厚 5 mm,层间距1 mm,FOV 24 cm×24 cm,矩阵288×224。
DWI:采用EPI序列(TR/TE=6000/68 ms),X、Y、Z 3个空间轴上同时施加弥散加权梯度场,b值1000 s/mm2,矩阵128×128,单次激发,层厚6 mm,层间距1mm,FOV 24 cm×24 cm,扫描时间24 s。
MR脑灌注成像:采用多层采集方式,梯度回波-回波平面成像(GRE-EPI)序列,层面数为20层,TR 1500 ms,TE 12 ms,FOV 22 cm×22 cm,矩阵128×128,层厚5 mm,层间距1 mm。每层面采集4幅图像后,由肘前静脉通过静脉留置针使用高压注射器团注Gd-DTPA(0.2 ml/kg),注射流率为4 ml/s,对比剂团注后再注入15 ml生理盐水冲洗导管。每层面共采集40幅图像,成像时间90 s。
常规MR增强扫描:灌注成像扫描结束后,进行常规横断面、矢状面及冠状面增强T1WI,横断面、冠状面层厚及层间距同平扫,矢状面层厚5 mm,层间距1 mm。
血流动力学参数采集:灌注成像的后处理在GE Advantage Windows工作站上进行。采用去卷积灌注软件进行分析,得到CBV、CBF、MTT、TTP、BAT参数图,感兴趣区(region of interest,ROI)放置在横断面T1WI异常强化区域和对侧相对正常的脑白质内,为尽可能减少人为因素影响,每个病灶测量10次。ROI选取病灶内强化最明显的区域,测量rCBV、rCBF、rMTT、rTOP、rBAT的比值(灌注图像所测各参数均为相对值,即病灶侧与对侧相对正常脑组织的比值),ROI大小一般为20~40 mm2,并且避开出血、坏死及囊变区,每个评价指标得到230个数据值。ROI的放置要避开出血、液化坏死等区域。正常脑白质的ROI尽可能放在和异常强化灶对称的位置,如确有困难,放在同层对侧最能代表正常脑白质的区域内。
统计学处理采用SPSS 16.0统计软件,采用分组t检验方法,对胶质瘤复发与放射性脑损伤不同区域的rCBV、rCBF、rMTT、rTTP、rBAT比值分别进行统计分析,P<0.05为差异有统计学意义。采用ROC曲线评价差异有统计学意义的参数鉴别诊断的灵敏度及特异度。
结 果
23例患者均进行了常规扫描及灌注扫描,采用rCBV、rCBF、rMTT、rTOP和rBAT 5种评价指标对胶质瘤复发组及放射性脑损伤组进行分类评估研究,共采集ROI 230个。
在灌注图像采集的5个评价指标中,胶质瘤复发rCBV和rCBF比值分别为3.60±3.86和2.88±2.27,明显高于放射性脑损伤的0.82±0.74(P=0.000)和0.84±0.80(P=0.000);rMTT(P=0.204)、rTTP(P=0.260)和rBAT(P=0.071)的比值在两组间差异没有统计学意义(表1)。
通过分析rCBV比值和rCBF比值的ROC曲线(图1),显示两者曲线下面积均为0.876。计算rCBV和rCBF在鉴别胶质瘤复发组和放射性脑损伤组的约登指数,结果分别为1.1235和1.3088。binary logistic 分析结果显示,rCBV比值越大,rCBF比值越大,病灶越可能为胶质瘤复发;rCBV比值大于1.1235的病灶为胶质瘤复发的OR值是18.81;rCBF比值大于1.3088的病灶为胶质瘤复发的OR值也是18.81。rCBV比值和rCBF比值线性相关统计结果显示两者具有强正相关(图2)。
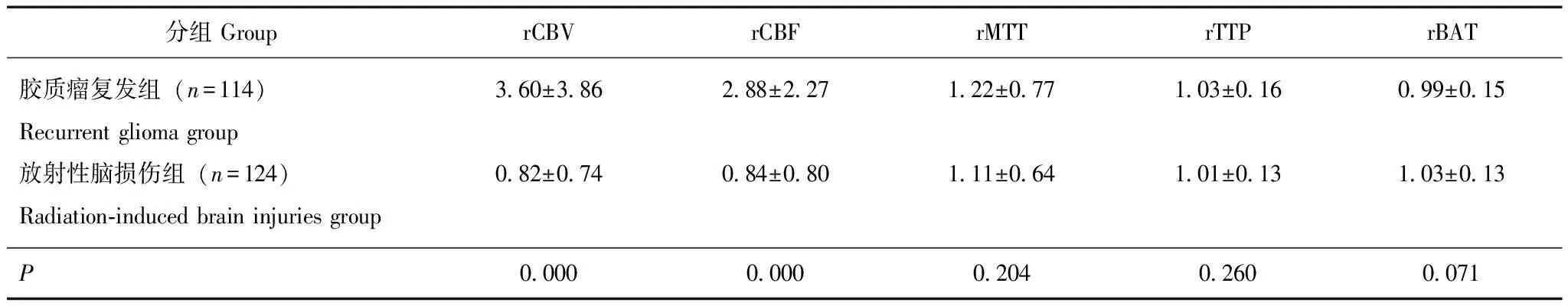
表 1 两组血流动力学参数的比较Table 1 Comparison of hemodynamic parameters between two groups
rCBV:相对脑血容量;rCBF:相对脑血流量;rMTT:相对平均通过时间;rTTP:相对达峰时间;rBAT:相对团注到达时间
rCBV:relative cerebral blood volume;rCBF:relative cerebral blood flow;rMTT:relative mean transit time;rTTP:relative time to peak;rBAT:relative bolus arrive time
图1 ROC曲线
Fig1 ROC curve
讨 论
鉴别胶质瘤术后复发和放射性脑坏死,在目前的临床工作中仍然是非常重要并且是非常困难的。对于胶质瘤术后的患者,当原术区或放疗野内出现新的异常强化病灶,并且具有明显占位效应,伴有或不伴有水肿,常提示有肿瘤复发的可能;但放射性脑坏死所致的血脑屏障破坏也能导致MR增强扫描时局部的异常强化灶,所以仅通过常规MR检查手段不能鉴别胶质瘤复发与放射性脑坏死。胶质瘤患者术后并行脑部放射性治疗后,大约有20%的患者会出现不同程度的放射性脑损伤,可在放疗结束后短期内出现,也可以在放疗后数月甚至数年后出现[4]。有研究显示,即使患者所进行的是全脑放疗,出现放射性脑损伤的部位通常也只在原发肿瘤的部位,这种现象的机制目前尚不清楚,推测可能是由于原发肿瘤部位经过手术后出现区域性的血管源性水肿,而使局部脑白质更容易被射线损伤[5]。
动态磁敏感对比增强灌注磁共振成像(dynamic susceptibility contrast,DSC-MRI)是通过静脉快速团注顺磁性对比剂来观察脑血流动力学改变;对比剂通过局部血管时,使组织T2或T2*缩短,导致相应的T2WI或T2*WI上的信号一过性降低。DSC-MRI技术可以反映组织的毛细血管微循环信息,由于肿瘤细胞的生长和细胞更新的加快导致其新陈代谢需求增加;使肿瘤局部处于低血糖和缺氧状态,这种状态会刺激机体产生血管生成的细胞活性物质,导致肿瘤内部新的血管生成。病理显示这些肿瘤新生血管由不成熟的血管组成,包括大的细胞间隙、不完整的基底膜和缺少平滑肌层,使得肿瘤新生血管具有更高的渗透性。灌注成像很容易量化这种胶质瘤复发后的高血管化状态,体现在参数rCBV/rCBF/rMTT/rTOP/rBAT上。根据对比剂首过局部脑组织所引起的信号强度变化与时间的关系,可以绘制时间-信号强度曲线,根据时间-信号强度曲线可获得部分血流动力学参数的相对值,通过比较患侧与健侧相对应部位比值进行半定量研究。在脑肿瘤灌注的定量描述中,公认的最常用参数为CBV,而rCBF/rMTT/rTOP/rBAT应用较少。Fuss等[6]采用MR PWI检查25例组织学证实的纤维性星形细胞瘤放疗前后的rCBV变化规律,显示MR PWI可用来无创地评估肿瘤血管生成。
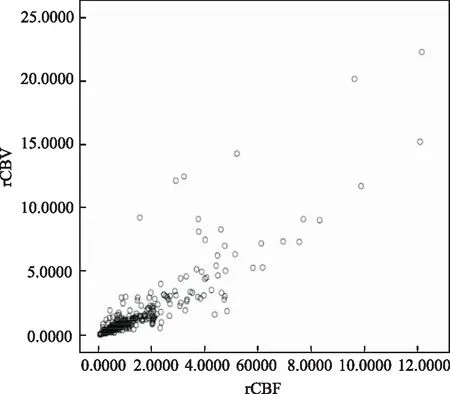
rCBV:相对脑血容量;rCBF:相对脑血流量
rCBV:relative cerebral blood volume;rCBF:relative cerebral blood flow
图2 rCBV与rCBF呈线性相关
Fig2 rCBV is linearly correlated with rCBF
本研究采用平面回波成像(echo planner imaging,EPI)技术提高检查的时间分辨率,同时应用自由感应衰减序列来增加对组织T2*变化的敏感性。结果显示,胶质瘤复发的rCBV比值为3.60±3.86,rCBF比值为2.88±2.27,均明显大于放射性脑损伤组,与胶质瘤复发的病理生理学相符合。单纯的放射性脑损伤表现为MR灌注扫描的低灌注状态,一般低于对侧对称区域的脑白质。但放射性脑损伤与胶质瘤复发在患者的大脑内不是简单的有或无的关系,实际上可能经常出现肿瘤复发与放射性脑损伤并存的情况。Fink等[7]研究结果显示,rCBV胶质瘤复发组CBV比值为3.62±0.65,明显高于放射性脑损伤组的1.31±0.50,ROC曲线下面积为0.917。Mitsuya等[8]研究结果显示,放射性脑损伤组rCBV比值为0.39±2.57,胶质瘤复发组rCBV比值为2.1±10,rCBV比值中位数在两组间有明显差异。Sugahara等[9]研究结果显示,rCBV的比值如果>2.6则可以诊断为胶质瘤复发,rCBV的比值如果<0.6则可以诊断为放射性脑损伤,对于rCBV比值在两者之间的情况,则需要进行PET检查做出最后的诊断。
Barajas等[10]认为,根据rCBV比值ROC曲线得出的分界值为1.75,但依据此比值鉴别放射性脑损伤及胶质瘤复发并不完全可靠(灵敏度78.92%,特异度71.58%)。本研究通过分析rCBV比值和rCBF比值的ROC曲线,计算出两种评价指标在鉴别胶质瘤复发组和放射性脑损伤组的约登指数,结果显示rCBV比值为1.1235,rCBF比值为1.3088,两者OR值均为18.81。从而分析得出rCBV比值大于1.1235的病灶为胶质瘤复发的机率比rCBV比值小于1.1235 病灶增加18.81倍。rCBF比值大于1.3088的病灶为胶质瘤复发的机率比rCBF比值小于1.3088 病灶同样增加18.81倍。采用此约登指数分析本研究数据后发现,有2例胶质瘤复发组患者所采集数据中半数均小于约登指数;此2例患者病理结果均显示为在脑组织内大片出血、坏死,并见显著血管增生伴管壁纤维素样坏死,周边及坏死组织内见散在分布的间变型星形-少突胶质细胞瘤成分。分析病理结果显示这两个病灶均系在大片状放射性脑损伤的背景下有少量散在小灶状胶质瘤复发,此2例患者的ADC值及灌注分析均提示为明显的放射性脑损伤。对于这样的情况,定性诊断就显得非常困难;但需要重新认识患者这种状态下的临床症状,究竟是由大片状的放射性脑损伤引起还是由灶状的胶质瘤复发所引起。此2例患者临床症状均由大片状的放射性脑损伤所致,如果计算rCBV比值平均值,结果均小于1.1235,即应属于放射性脑损伤组;故笔者认为如果病灶内部rCBV比值差异较大,单纯计算rCBV比值平均值,并不能代表病灶内的整体情况,因此本研究纳入的数据,均为强化区域内参数的独立ROI数据(能够独立代表ROI局部信息)。Barbara等[11]研究显示,胶质瘤复发组 rCBVmax为2.44±0.73,明显高于放射性脑损伤组的0.78±0.46;胶质瘤复发组rCBVmean为1.46±0.49,也明显高于放射性脑损伤组的0.49±0.38;如果rCBVmax大于1.7,同时rCBVmean大于1.25,则高度提示为胶质瘤复发;如果rCBVmax小于1.0,同时rCBVmean小于0.5,则高度提示为放射性脑损伤。
灌注成像鉴别胶质瘤复发与放射性脑损伤时采用的是病变侧与正常侧参数的比值,这有一定局限性。当病灶跨越中线生长时,所测灌注参数比值的可信度就会降低;此外,如果病灶过于接近颅底层面,由于目前灌注成像还只能停留在轴面显示的水平,所以近颅底的病灶灌注图像显示效果受骨质影响,伪影较重,近而影响数据的采集和数值的测量。
近年来应用核医学对于胶质瘤复发和放射性脑损伤鉴别的研究报道较多,Xiangsong等[12]提出13N-NH3在星形细胞瘤复发时出现高摄取,而放射性脑损伤则表现为没有或少量13N-NH3摄取,认为13N-NH3PET对于鉴别有一定帮助。Tie等[13]采用201T1-SPECT鉴别胶质瘤复发和放射性脑损伤,灵敏度和特异度分别为83%和83%,但缺点是空间分辨力低,解剖定位不准确,容易混淆生理性摄取和病理性摄取。Langleben等[14]应用PET通过局部代谢情况反映胶质瘤复发和放射性脑损伤的差别,结果显示其敏感性及特异性很高,但是空间分辨力低。
综上,本研究结果显示,灌注扫描图像可用于鉴别胶质瘤复发和放射性脑损伤,其中rCBV和rCBF比值在两组中有明显统计学差异,鉴别诊断界值分别为1.3088和1.1235,可作为可靠的临床指标。
[1] Rabinov JD,Leep L,Barker FG,et al.Invivo3-T MR spectroscopy in the distinction of recurrent glioma versus radiation effects:initial experience[J].Radiology,2002,225(3):871- 879.
[2] Grossman SA,Batara JF.Current management of glioblastoma multiforme[J].Semin Oncol,2004,31(5):635- 644.
[3] Ruben JD,Dally M,Bailey M,et al.Cerebral radiation necrosis:incidence,outcomes,and risk factors with emphasis on radiation parameters and chemotherapy[J].Int J Radiat Oncol Biol Phys,2006,65(2):499- 508.
[4] Rock JP,Hearshen D,Scarpace L,et al.Correlations between magnetic resonance spectroscopy and image-guided histopathology,with special attention to radiation necrosis[J].Neurosurgery,2002,51(4):912- 919.
[5] Preul MC,Leblanc R,Caramanos Z,et al.Magnetic resonance spectroscopy guided brain tumor resection:differentiation between recurrent glioma and radiation change in two diagnostically difficult cases[J].Can J Neurol Sci,1998,25(1):13- 22.
[6] Fuss M,Wenz F,Essig M,et al.Tumor angiogenesis of low-grade astrocytomas measured by dynamic susceptibility contrast-enhanced MRI(DSC-MRI)is predictive of local tumor control after radiation therapy[J].Int J Radiat Oncol Biol Phys,2001,51(2):478- 482.
[7] Fink JR,Carr RB,Matsusue E,et al.Comparison of 3 Tesla proton MR spectroscopy,MR perfusion and MR diffusion for distinguishing glioma recurrence from posttreatment effects[J].J Magn Reson Imaging,2012,35(1):56- 63.
[8] Mitsuya K,Nakasu Y,Horiguchi S,et al.Perfusion weighted magnetic resonance imaging to distinguish the recurrence of metastatic brain tumors from radiation necrosis after stereotactic radiosurgery[J].J Neurooncol,2010,99(1):81- 88.
[9] Sugahara T,Korogi Y,Tomiguchi S,et al.Posttherapeutic intraaxial brain tumor:the value of perfusion-sensitive contrast-enhanced MR imaging for differentiating tumor recurrence from nonneoplastic contrast-enhancing tissue[J].AJNR Am J Neuroradiol,2000,21(5):901- 909.
[10] Barajas RF,Chang JS,Segal MR,et al.Differentiation of re-current glioblastoma multiforme from radiation necrosis after external beam radiation therapy with dynamic susceptibility-weighted contrast-enhanced perfusion MR imaging[J].Radiology,2009,253(2):486- 496.
[11] Barbara BB,Gabriela SP,Henryk M,et al.Differentiation be-tween brain tumor recurrence and radiation injury using perfusion,diffusion-weighted imaging and MR spectroscopy[J].Folia Neuropathologica,2010,48(2):81- 92.
[12] Xiangsong Z,Weian C.Differentiation of recurrent astrocytoma from radiation necrosis:a pilot study with 13N-NH3 PET[J].J Neurooncol,2007,82(3):305- 311.
[13] Tie J,Gunawardana DH,Rosenthal MA.Differentiation of tumor recurrence from radiation necrosis in high-grade gliomas using 201Tl-SPECT[J].J Clin Neurosci,2008,15(12):1327- 1334.
[14] Langleben DD,Segall GM.PET in differentiation of recurrent brain tumor from radiation injury[J].J Nucl Med,2000,41(11):1861- 1867.
DifferentiationbetweenGliomaRecurrenceandRadiation-inducedBrainInjuriesUsingPerfusion-weightedMagneticResonanceImaging
WANG Yu-lin1,LIU Meng-yu1,WANG Yan1,XIAO Hua-feng1,SUN Lu2,ZHANG Jun3,MA Lin1
1Department of Radiology,2Department of Pathology,3Department of Neurosurgery,Chinese PLA General Hospital,Beijing 100853,China
MA Lin Tel:010- 66939592,E-mail:cjr.malin@vip.163.com
ObjectiveTo evaluate the role of perfusion weighted imaging(PWI)in the differentiation between recurrent glioma and radiation-induced brain injuries.MethodsTwenty-three patients with previously resected and irradiated glioma,presenting newly developed abnormal enhancement,were included in the study.The final diagnosis was determined either histologically or clinicoradiologically.PWI was obtained with a gradient echo echo-planar-imaging(GRE-EPI)technique.The normalized relative cerebral blood volume(rCBV)ratio[rCBV(abnormal enhancement)/rCBV(contralateral tissue)],relative cerebral blood flow(rCBF)ratio[rCBF(abnormal enhancement)/rCBF(contralateral tissue)],mean transit time(MTT)ratio[MTT(abnormal enhancement)/MTT(contralateral tissue)],time to peak(TTP)ratio[TTP(abnormal enhancement)/TTP(contralateral tissue)],and bolus arrive time(BAT)ratio[BAT(abnormal enhancement)/BAT(contralateral tissue)]were calculated.The regions of interest(ROIs)consisting of 20- 40mm2were placed in the abnormal enhanced areas on postcontrast T1-weighted images.Ten ROIs measurements were performed in each lesion.T test was used to determine whether there was a difference in the rCBV/rCBF/rMTT/rTTP/rBAT ratios between recurrentglioma and iradiated injuries.Significance was set to aPvalue<0.05.ResultsThirteen of the 23 patients were proved recurrent glioma and 10 were proved radiation-induced brain injuries.The rCBV ratio(3.60±3.86vs.0.82±0.74,P=0.000)and rCBF ratio(2.88±2.27vs.0.84±0.80,P=0.000)in glioma recurrence were markedly higher than those in radiation injuries.The areas under rCBV and rCBF ROC curve were both 0.8763.rMTT(P=0.204),rTTP(P=0.260),and rBAT(P=0.071)ratios showed no statistical difference between the two groups.ConclusionPWI is an effective technique in distinguishing glioma recurrence from radiation injuries,and the ratios of rCBV and rCBF ratio differential diagnosis of critical value to 1.3088 and 1.1235,respectively,can be used as a reliable clinical indicator.
glioma;recurrence;brain injuries;radioactivity;magnetic resonance imaging;perfusion
马 林 电话:010- 66939592,电子邮件:cjr.malin@vip.163.com
R445.2
A
1000- 503X(2013)04- 0416- 06
2013- 02- 19)
国家自然科学基金(30970816)Supported by the National Natural Sciences Foundation of China(30970816)
10.3881/j.issn.1000- 503X.2013.04.011

