环孢菌素A-纳米乳联合干细胞移植治疗急性心肌梗死的疗效
尹巧香,王 恒,裴志勇,赵玉生
中国人民解放军空军总医院 1干部病房心内科 2神经内科,北京 100142 3北京军区总医院干部病房一科,北京 100700 4中国人民解放军总医院老年心血管病研究所,北京 100853
·论著·
环孢菌素A-纳米乳联合干细胞移植治疗急性心肌梗死的疗效
尹巧香1,王 恒2,裴志勇3,赵玉生4
中国人民解放军空军总医院1干部病房心内科2神经内科,北京 1001423北京军区总医院干部病房一科,北京 1007004中国人民解放军总医院老年心血管病研究所,北京 100853
目的制备并评估负载环孢菌素A-纳米乳药物(CsA-NP)联合脂肪组织来源干细胞(ASCs)移植治疗小型猪急性心肌梗死(AMI)的疗效并研究其可能的机制。方法CsA-NP采用高压均质法制备而成。经皮球囊封堵冠状动脉左前降支制备小型猪AMI模型(n=17),随机分为对照组(n=5)、CsA-NP组(n=4)、ASCs组(n=4)和CsA-NP+ASCs组(n=4)4组。AMI后1周经冠状动脉内注入ASCs或生理盐水,分别在干细胞移植前和干细胞移植后8周,以延迟增强核磁共振(DE-MRI)评估心脏结构和功能。病理和免疫组织化学评估移植后心肌和移植细胞情况。结果干细胞移植后8周,DE-MRI显示与ASCs组比较,CsA-NP+ASCs组的左心室射血分数显著提高[(53.6±2.4)%比(48.3±1.8)%,P<0.05],梗死面积显著缩小[(6.2±1.7)cm3比(7.5±0.6)cm3,P<0.05],室壁厚度显著增加(P<0.05)。病理和免疫组织化学结果显示,CsA-NP+ASCs组比ASCs组移植存活细胞增加了近3倍,并表达心肌细胞阳性标记物(cTnT、α-actin阳性);与ASCs组比较,CsA-NP+ASCs组进一步减轻梗死心肌纤维化程度,下调了Caspase- 3活性,抑制了心肌细胞凋亡。结论CsA-NP增强了ASCs移植治疗小型猪AMI疗效,提高了心功能,减轻了左心室重构,可能与CsA-NP抑制细胞凋亡、促进细胞增殖分化有关。
环孢菌素A;纳米;干细胞;脂肪;凋亡;急性心肌梗死
ActaAcadMedSin,2013,35(4):404-410
尽管药物治疗和再灌注治疗使心肌梗死患者的存活率大为提高,但由于不可避免的心肌细胞坏死和凋亡导致心脏重构,最终进展为心力衰竭。近年来,移植干细胞治疗心肌梗死(myocardial infarction,MI)取得了较大进展,不管是在动物模型还是人类临床试验,都看到了干细胞移植治疗MI对心脏结构和功能的改善。特别是脂肪组织来源干细胞(adipose tissue-derived stem cells,ASCs),由于具有多向分化潜能、组织来源广、取材创伤小和产量高等优点,成为最具吸引力的间充质干细胞,有望取代骨髓来源的干细胞治疗心脏病。已有大量研究证实了ASCs在治疗MI方面的卓越成就[1-2]。然而,MI后的恶劣微环境可导致细胞大量凋亡甚至死亡,特别是远期[3],因此,如何提高干细胞移植成活率就成为干细胞治疗领域最大的挑战。
环孢菌素A(cyclosporine A,CsA)是临床广泛应用的高效免疫抑制剂。近年研究发现,CsA能抑制细胞凋亡,是迄今为止发现的最经典的线粒体膜通透性转换孔(mitochondrial permeability transition pore,mPTP)抑制剂,可对心肌缺血-再灌注损伤起保护作用[4-6]。有临床研究报道,CsA能对心脏再血管化治疗发挥保护作用[6],然而因长期应用CsA可能带来肝、肾功能损害故而不大可能现阶段在临床大规模应用。
纳米给药系统的临床应用近年已得到人们的广泛认同,其重要意义已在肿瘤化疗药物的靶向药物递送系统中得到肯定和推广。借鉴肿瘤化疗药物的靶向递药成功经验,本课题组制备并评估了负载CsA的纳米乳(cyclosporine A-nanoparticles emulsion,CsA-NP),其携带纳米微粒能修饰药物在体内的重新分布,因而有望达到靶向、高效、低毒的疗效。本研究评估了CsA-NP是否可增强ASCs移植治疗小型猪急性心肌梗死(acute myocardial infarction,AMI)的疗效。为了准确评估MI面积及左心室功能,本研究采用延迟增强核磁共振(delayed-enhanced magnetic resonance imaging,DE-MRI)技术以及后期病理免疫组织化学技术作为评估手段。
材料和方法
CsA-NP输液剂的制备和鉴定委托中国人民解放军军事医学科学院药物与毒物研究所,以蛋黄磷脂(lipoid E 80)、泊洛沙姆188为水相,中链油(lipoid MCT)为油相,采用高压均质法制备而成。高效液相色谱法(high performance liquid chromatography,HPLC)评估产品的载药率,乳径的粒径经激光粒度分析仪测定,并通过异常毒性检查法及溶血性实验对制备的药物安全性进行初步评价。
实验动物广西巴马小型猪,雌雄不限,月龄4~6个月,体重20~30 kg,购自东北农业大学-中国农业科学院哈尔滨分院,由中国人民解放军总医院动物中心饲养。所有动物研究全部符合国家《实验动物管理条例》和《北京市实验动物管理条例细则》。
小型猪ASCs的提取、培养、鉴定及标记具体过程参见文献[7]。
小型猪AMI模型的制备和移植ASCs具体过程参见文献[8]。先后有31头小型猪用来制备MI模型,成功造模、存活并完成整个实验过程的有17头(54.8%),死亡动物大部分都是在造模过程中或造模后24 h内因心室颤动死亡。存活小型猪随机分为4组:(1)对照组(n=5):移植同等体积生理盐水;(2)ASCs组(n=4):移植ASCs;(3)CsA-NP组(n=4):应用药物,移植同等体积生理盐水;(4)CsA-NP+ASCs组(n=4):CsA-NP联合移植ASCs。CsA-NP组和CsA-NP+ASCs组选择在AMI造模缺血-再灌注时,在干细胞(或生理盐水)移植前一次性静脉注入CsA-NP 2 mg/kg。注射剂量的选择根据前期体外实验(CsA-NP对ASCs增殖和凋亡的影响[7]),同时参考文献[9]。剂量低于目前动物实验、临床患者最低CsA用量标准。干细胞移植:小型猪AMI模型建立成功后1周移植干细胞。放置1.5 mm×1.5 mm球囊(球囊远端人为造成破损)到前降支中下1/3处,注射器吸取干细胞悬液加压缓慢注射[移植细胞量(3~4)×107个细胞],对照组和CsA-NP组按上述方法注入等体积的生理盐水。
DE-MRI检查及图像分析分别于小型猪干细胞移植前、干细胞移植后8周行DE-MRI检查。心脏延迟增强:注入10 ml钆贝葡胺注射液,10 min后开始扫描心脏短轴位,具体过程参见文献[8]。
病理及免疫组织化学评估移植细胞存活、分化情况干细胞移植后8周行DE-MRI检查后,采用穿刺股动脉放血处死动物。取出心脏后记录全心、心室及左心室的质量。垂直左心室长轴将左心室切成薄片,厚度5~6 mm。分别留取梗死区、边缘区及正常部位1 cm2大小心肌组织块标本-70℃保存和4%多聚甲醛溶液固定后保存。
移植细胞存活、分化情况取ASCs组和CsA-NP+ASCs组梗死边缘区冰冻的心肌组织制成5 μm厚切片,荧光显微镜下观察,发现蓝色荧光后连续切片。肌钙蛋白T抗体cTn-T、α-肌节肌动蛋白抗体α-action(抗体均来自美国Abcam公司)进行免疫荧光染色,阴性对照用PBS代替一抗,激光共聚焦扫描显微镜下观察移植细胞存活及分化情况。
MI区域胶原沉积纤维化检测每头小型猪各取4张梗死中心区、梗死边缘区切片行Masson染色,利用Image Pro Plus 6.0软件测量梗死中心区、梗死边缘区纤维化面积,取平均值。
免疫组织化学法检测胞浆Caspase-3表达参照兔抗Caspase- 3多克隆抗体试剂盒说明书(Santa Cruz公司,美国)进行,应用Image pro plus 4.5图像分析软件进行图像分析,每张切片选取5个具有代表性的高倍视野,计算阳性染色的积分光密度平均值(integrated optical density,IOD)。免疫组织化学染色检测梗死区及梗死边缘区微血管计数:将制备好的免疫组化染色切片置于显微镜下观察。微血管测量的要求:vWF染色阳性,管腔可视并且对直径在10~100μm以内的微血管进行计数。利用Image Pro Plus 4.5图像分析软件测量管腔。每头小型猪取6张切片,每张切片在MI区域及MI边缘区至少取6个高倍视野(×400)。
统计学处理采用SPSS 17.0 统计软件,MI面积、心输出量、左心室射血分数(left ventricular ejection fraction,LVEF)、左心室舒张末容积(left ventricular end-diastolic volume,LVEDV)等计量资料以均数±标准差表示,率的比较采用χ2检验,P<0.05为差异有统计学意义。
结 果
CsA-NP输液剂的鉴定HPLC及乳径的粒径经激光粒度分析仪测定表明,本研究制备的CsA-NP工艺稳定性好,粒径均匀,50%的乳滴微粒直径在162 nm以内。通过异常毒性检查法及溶血性实验对药物的安全性进行初步评价,结果表明制备的CsA-NP无明显异常毒性,体外无明显溶血作用。
DE-MRI评估干细胞移植后心脏结构和功能分别于ASCs移植前(基点)和ASCs移植后8周(终点)行心脏DE-MRI检查,结果显示,ASCs移植后8周所有组的LVEF均有提高,CsA-NP+ASCs组LVEF提高显著[(53.6±2.4)%],与对照组[(46.2±3.9)%]相比差异有统计学意义(P<0.01),与CsA-NP组[(48.6±1.5)%]和ASCs组[(48.3±1.8)%]相比差异也均有统计学意义(P均<0.05);CsA-NP+ASCs组的LVEDV和左心室收缩末容积(left ventricular end-systolic volume,LVESV)与其他组相比显著下降(P均<0.05)。CsA-NP+ASCs组MI面积[(6.2±1.7)cm3]与对照组[(9.8±2.4)cm3,P<0.01]、CsA-NP组[(9.1±3.4)cm3,P<0.05]、和ASCs组[(7.5±0.6)cm3,P<0.05]相比也显著下降(表1)。
DE-MRI图像及病理评估干细胞移植后心脏结构和功能干细胞移植后8周,心脏梗死面积缩小,心功能提高。MI瘢痕主要累及左心室心尖部、前壁及右心室前壁,左心室切片可见不同层次的MI范围,与DE-MRI短轴MI部位相一致,梗死区域与正常心肌组织界限分明。梗死区、梗死边缘、远离梗死区,梗死区与非梗死区交界分明(图1)。
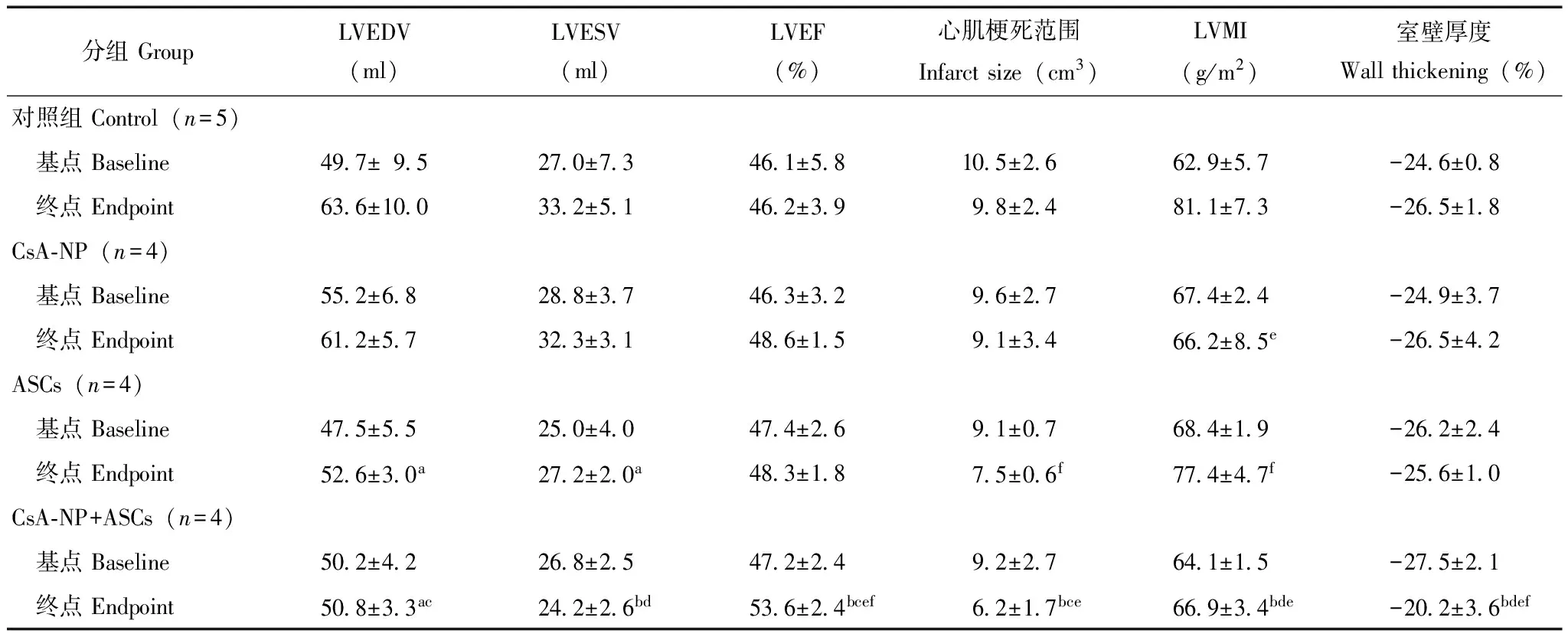
表 1 延迟增强核磁共振评估左心室结构和功能Table 1 Left ventricular function and geometry by delayed enhanced magnetic resonance imagine
LVEDV:左心室舒张末容积;LVESV:左心室收缩末容积;LVEF:左心室射血分数;LVMI:左心室质量指数;与对照组比较,aP<0.05,bP<0.01;与CsA-NP组比较,cP<0.05,dP<0.01;与ASCs组比较,eP<0.05;基点与终点比较,fP<0.01
LVEDV:left ventricular end-diastolic volume;LVESV:left ventricular end-systolic volume;LVEF:left ventricular ejection fraction;LVMI:left ventricular mass index;aP<0.05,bP<0.01 compared with control group;cP<0.05,dP<0.01 compared with CsA-NP group;eP<0.05 compared with ASCs group;baselinevs.endpoint,fP<0.01
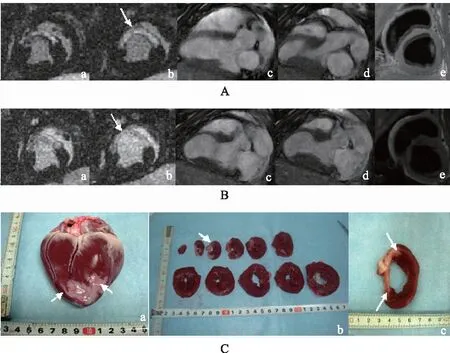
A.干细胞移植前,短轴位收缩期(a),舒张期(b),箭头所指短轴位增强信号为心肌梗死部位,长轴位舒张期(c),长轴位收缩期(d),T2黑血像(e);B.干细胞移植后8周,短轴位收缩期(a),舒张期(b),箭头所指短轴位增强信号为心肌梗死部位,长轴位舒张期(c),长轴位收缩期(d),T2黑血像(e);C.与该小型猪相对应心脏大体标本(a)、左心室切片(b)及单片左心室切片(c),箭头所指灰白色区域为心肌梗死部位
A.before cell transplantation,delayed-enhanced MRI with high signal intensity in the sectional short-axis in the systolic(a)and diastolic(b)view demonstrate infarct myocardial viability(arrows),long-axis in the diastolic(c)and systolic(d)and the black-blood T2-weighted(e);B.8 weeks after cell transplantation,delayed-enhanced MRI with high signal intensity in the sectional short-axis in the systolic(a)and diastolic(b)view demonstrate infarct myocardial viability(arrows),long-axis in the diastolic(c)and systolic(d)and the black-blood T2-weighted(e);C.corresponding photographs of histomorphometry demonstrate the porcine heart(a),cross-sectional slices(b)and one representative slice(c),the arrows indicate pale areas are the infarction myocardial areas
图1 CsA-NP+ASCs组体内延迟增强核磁共振和体外免疫组织化学结果
Fig1 Representativeinvivodelayed-enhanced magnetic resonance imagine andexvivohistological samples from CsA-NP+ASCs-treated hearts
免疫组织化学评估干细胞移植后心脏结构和功能
移植细胞体内存活及分化情况:干细胞移植后8周处死动物取材制成心肌组织冰冻切片,ASCs组、ASCs+CsA-NP组梗死边缘区均可见发蓝色荧光的细胞核(DAPI阳性细胞)(图2)。统计分析显示,ASCs+CsA-NP组DAPI阳性细胞是ASCs组的近3倍[(38±7.8)cells/cm2比(15±8.6)cells/cm2,P<0.01]。免疫荧光染色后激光共聚焦显微镜下观察,部分DAPI阳性细胞呈现阳性表达(cTn-T、α-actin)(图2)。
Masson三色染色法评估MI区域纤维化程度:对照组纤维化程度(绿染)最重,CsA-NP组、ASCs组和CsA-NP+ASCs组纤维化程度明显减轻。ASCs纤维化程度较对照组明显减轻(50.2±16.8比58.2±18.8,P<0.05);CsA-NP+ASCs的MI纤维化程度也较其他各组明显减轻(P均<0.01)(图3)。
免疫组织化学法检测胞浆Caspase- 3活性:光学显微镜下观察表达阳性核呈现深蓝色,细胞浆或细胞膜呈棕黄色染色。计算阳性染色的积分光密度平均值(integrated optical density,IOD),结果显示,对照组、CsA-NP组、ASCs组和CsA-NP+ASCs组Caspase- 3的IOD值分别为7963.2±412.8、5746.3±406.5、6582.3±998.3和2947.8±518.6,CsA-NP组(P<0.05)和CsA-NP+ASCs组(P<0.01)均明显低于对照组(图4)。

图2 免疫组织化学分析ASCs和CsA-NP+ASCs组cTn-T和α-actin阳性表达(×600)
Fig2 Immunofluorescence analysis of the positive expressions of cTn-T and α-actin in the ASCs group and CsA-NP+ASCs group(×600)
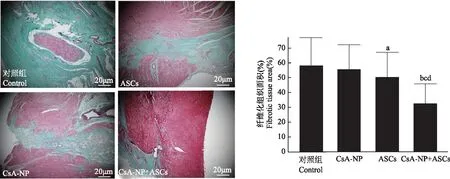
与对照组比较,aP<0.05,bP<0.01;与CsA-NP组比较,cP<0.01;与ASCs组比较,dP<0.01
aP<0.05,bP<0.01 compared with control group;cP<0.01 compared with CsA-NP group;dP<0.01 compared with ASCs group
图3 Masson三色染色法评估移植后8周各组心肌梗死区纤维化程度
Fig3 Masson’s Trichrome compared the percentage of fibrotic infarcted zone among the all groups
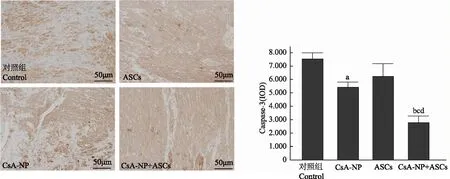
IOD:积分光密度平均值;与对照组比较,aP<0.05,bP<0.01;与CsA-NP组比较,cP<0.01;与ASCs组比较,dP<0.01
IOD:integrated optical density;aP<0.05,bP<0.01 compared with control group;cP<0.01 compared with CsA-NP group;dP<0.01 compared with ASCs group
图4 免疫组织化学法检测各组胞浆Caspase- 3活性
Fig4 Expression of activity of Caspase- 3 in tissue sections at 8 weeks
讨 论
本项研究首次制备并评估了CsA-NP用于ASCs移植治疗小型猪AMI的疗效和可能的机制,结果表明,ASCs移植联合CsA-NP可进一步修复损伤心肌,提高心功能,减轻左心室重构。系列免疫组织化学检测结果显示,移植的ASCs能在梗死心肌存活并分化为心肌细胞表面标记物(cTnT和α-actin阳性表达),表明移植的ASCs具有心脏再生潜能,而CsA-NP进一步提高了ASCs移植效率,存活细胞增加了近3倍;ASCs移植联合CsA-NP进一步减轻梗死心肌纤维化程度;下调了Caspase- 3活性,抑制了心肌细胞凋亡。这些增生分化的细胞和血管可能参与了心肌修复,提高了心功能。DE-MRI为证实这种假设提供了依据:ASCs移植联合CsA-NP进一步提高了左室射血分数,减少了MI面积,减轻了心肌左心室质量,增加了室壁厚度,从而提升了心脏功能,减轻了左心室重构。
CsA是临床上应用普遍的免疫抑制剂,低剂量时又是mPTP开放抑制剂,因而也能抑制细胞凋亡。心脏组织缺血一段时间后再灌注,将不可避免地引起mPTP开放,导致线粒体跨膜电位下降,膜电位去极化,基质肿胀,释放前凋亡蛋白从线粒体进入胞液,然后通过启动凋亡蛋白酶(Caspases)依赖性或非依赖性的级联反应机制,诱导细胞凋亡或者坏死。CsA通过与线粒体基质的环孢菌素受体(cyclophilin D,CyP-D)特异性结合,阻止mPTP开放,从而抑制细胞凋亡,是迄今为止发现的最经典的mPTP开放抑制剂。Piot等[6]研究证实,CsA组MI面积较对照组下降40%,与本研究结果一致,Mewton等[9]发现使用CsA的动物MI范围显著缩小。Yan等[10]给大鼠的胚胎干细胞添加低剂量CsA获得了10~20倍心脏祖细胞的倍增效果,恢复了左心室功能,随后,该研究团队又用人类多潜能干细胞诱导、扩增为心肌细胞,添加低剂量CsA后细胞数量增加了4.3倍[11]。
上述研究结果固然令人鼓舞,然而长期应用CsA可能带来的肾、肝功能损害却限制了该药现阶段在临床的大规模应用。近年来,纳米给药系统在临床得到了广泛应用,其能改善难溶性药物的吸收,实现靶向和定位给药等,其重要意义已在肿瘤化疗药物的靶向药物递送系统中得到肯定。借鉴肿瘤化疗药物纳米制剂的靶向递药成功经验,本研究制备了CsA-NP。与本研究CsA-NP制备工艺相类似且已广泛上市并在临床成功运用多年的药物是前列地尔脂微球(Lipo PGE1,商品名:凯时)[12]。笔者有理由相信,CsA-NP也能与Lipo PGE1一样达到靶向和缓释效应,减少药物用量,提高药物疗效,减轻药物不良反应。当然,CsA-NP药物的有效性、安全性还需要一系列研究证实。
目前,干细胞移植成活率低下,特别是远期,其主要原因是细胞大量凋亡甚至死亡[4]。本研究充分利用CsA是最经典的mPTP开放抑制剂从而抑制凋亡的特性,将CsA改造成CsA-NP,以达到靶向、高效、低毒的疗效,更好地发挥其抗凋亡作用,减轻不良反应。希望CsA-NP的应用能为心脏再生提供一种简单可行并有效的尝试。
[1] Shi CZ,Zhang XP,Lv ZW,et al.Adipose tissue-derived stem cells embedded with eNOS restore cardiac function in acute myocardial infarction model[J].Int J Cardiol,2012,154(1):2- 8.
[2] Yang Y,Dreessen de Gervai P,Sun J,et al.MRI studies of cryoinjury infarction in pig hearts:ii.Effects of intrapericardial delivery of adipose-derived stem cells(ADSC)embedded in agarose gel[J].NMR Biomed,2012,25(2):227- 235.
[3] George JC.Stem cell therapy in acute myocardial infarction:a review of clinical trials[J].Trans Res,2010,155(1):10- 19.
[4] Huang CH,Tsai MS,Hsu CY,et al.Post-cardiac arrest myocardial dysfunction is improved with cyclosporine treatment at onset of resuscitation but not in the reperfusion phase[J].Resuscitation,2011,82(Suppl 2):S41- S47.
[5] Cour M,Loufouat J,Paillard M,et al.Inhibition of mitochondrial permeability transition to prevent the post-cardiac arrest syndrome:a pre-clinical study[J].Eur Heart J,2011,32(2):226- 235.
[6] Piot C,Criosille P,Staat P,et al.Effect of cyclosporine on reperfusion injury in acute myocardial infarction[J].N Engl J Med,2008,359(5):473- 481.
[7] 尹巧香,王恒,裴志勇,等.环孢菌素A-纳米乳促进猪脂肪组织来源干细胞的增殖[J].医学研究杂志,2012,41(12):26- 29.
[8] 尹巧香,赵玉生,王恒,等.延迟增强核磁共振评估经皮球囊封堵冠状动脉法制备小型猪心肌梗死模型[J].南方医科大学学报,2013,33(1):34- 39.
[9] Mewton N,Croisille P,Gahide G,et al.Effect of cyclosporine on left ventricular remodeling after reperfused myocardial infarction[J].J Am Coll Cardiol,2010,55(12):1200- 1205.
[10] Yan P,Nagasawa A,Uosaki H,et al.Cyclosporin-A potently induces highly cardiogenic progenitors from embryonic stem cells[J].Biochem Biophys Res Commun,2009,379(1):115- 120.
[11] Fujiwara M,Yan P,Otsuji TG,et al.Induction and enhancement of cardiac cell differentiation from mouse and human induced pluripotent stem cells with cyclosporin-A[J].PLoS One,2011,6(2):e16734.
[12] Gupta V,Davis M,Hope-Weeks LJ,et al.PLGA microparticles encapsulating prostaglandin E1-hydroxypropyl-β-cyclodextrin complex for the treatment of pulmonary arterial hypertension[J].Pharm Res,2011,28(7):1733- 1749.
EffecacyofCyclosporineA-nanoparticlesEmulsionCombinedwithStemCellTransplantationTherapyforAcuteMyocardialInfarction
YIN Qiao-xiang1,WANG Heng2,PEI Zhi-yong3,ZHAO Yu-sheng4
1Department of Geriatric Cardiology,2Department of Neurology,Chinese General Hospital of Air Force,Beijing 100142,China3Department of Geriatric Cardiology,Chinese General Hospital of Beijing Military Region,Beijing 100700,China4Institute of Geriatric Cardiology,Chinese PLA General Hospital,Beijing 100853,China
YIN Qiao-xiang Tel:010- 68410099- 68161,E-mail:zmyyqx- 20041129@163.com
ObjectiveTo evaluate the efficacy of cyclosporine A-nanoparticles emulsion(CsA-NP)combined with adipose tissue-derived stem cells(ASCs)transplantation therapy for acute myocardial infarction(AMI)in a miniswine model.MethodsCsA-NP emulsion was prepared by the high-pressure homogenization method.Models were performed by coronary angioplasty for percutaneous balloon occlusion of left anterior descending artery(LAD).A total of 17 miniswines survived after AMI were divided into four groups:control group(n=5),CsA-NP group(n=4),ASCs group(n=4),and CsA-NP+ASCs group(n=4).ASCs or saline were delivered by intracoronary injection one week after AMI.Before cell transplantation and 8 weeks after cell transplantation,delayed-enhanced magnetic resonance imaging(DE-MRI)was performed to evaluate cardiac function and viability.The infarcted myocardium and implanted cells were histologically studied.ResultsEight weeks after treatment,the left ventricular ejection fraction(LVEF)significantly increased in the CsA-NP+ASCs group when compared with the ASCs group[(53.6±2.4)%vs.(48.3±1.8)%,P<0.05];meanwhile,the infarct size significantly decreased[(6.2±1.7)cm3vs.(7.5±0.6)cm3,P<0.05]and the thickness of the ventricular wall significantly increased(P<0.05).Histology showed that the number of surviving cells increased nearly by three times in the CsA-NP+ASCs group,and the expressions of the cardiomyocyte specific markers(cTnT and α-actin)were detected.Histological samples also showed that CsA-NP+ASCs group reduced fibrotic tissue,and down-regulated the activation of Caspase- 3.ConclusionThe CsA-NP+ASCs combination therapy can enhance the viability of ASCs by improving LVEF and preventing LV expansion,which may be explained that CsA-NP has the anti-apoptotic effect and can promote the survivals and proliferation of ASCs.
cyclosporine A;nanoparticles;stem cell;adipose;apoptosis;acute myocardial infarction
尹巧香 电话:010- 68410099- 68161,电子邮件:zmyyqx- 20041129@163.com
R54
A
1000- 503X(2013)04- 0404- 07
2012- 11- 27)
国家高技术研究发展计划项目(863项目)(2006AA02A105)Supported by the National High Technology Research and Development Program of China(863 Program)(2006AA02A105)
10.3881/j.issn.1000- 503X.2013.04.009

