GAP-43高表达转基因小鼠的建立
黄 蕊 赵君朋 文玉军 徐群渊
(首都医科大学北京神经科学研究所 北京神经再生修复研究重点实验室 教育部神经变性病重点实验室,北京100069)
GAP-43(growth associated protein-43)是一种特异性存在于神经系统的生长相关蛋白,在神经发育和神经再生过程中表达。20世纪80年代,人们发现在低等两栖类动物蝾螈视神经再生时有一种小分子的酸性蛋白随神经再生同步表达上调[1-2]。后来了解到,这种蛋白在处于发育中的神经系统内广泛分布,表达沿神经元轴突并在生长锥尤显丰富;除某些具有较强可塑性的脑区(如海马)外,大部分脑区在成年后表达水平较低。但神经一经受损则又可诱其表达上调,功能联系重建后随即下降,故被称为生长相关蛋白[1-3],尽管在早期它曾被命名为 B-50、F1、Neuromodulin等。
众所周知,中枢神经再生一直是困扰临床医学的难题[4-5]。已有研究[5-7]表明,除了在发育期有表达外,GAP-43在成年哺乳动物中枢神经系统损伤后可出现重新表达,即出现于损伤轴突近侧端再生性出芽的时候。因此,GAP-43一直被认为是轴突生长的内在决定因子,也是衡量神经再生能力的重要标志[1]。然而,对于GAP-43在神经损伤后修复作用中的机制以及神经系统发育过程中行使什么功能的问题,人们至今似乎还并不清楚。
选择GAP-43基因敲除小鼠来研究GAP-43的生理和病理功能,理论上是一种比较理想的实验模型。但是以前大量的研究[8]证实,GAP-43基因敲除小鼠发育正常,基本生理和认知功能未受到明显影响。并且,经过GAP-43基因敲除的小鼠也就无法观察其在神经系统损伤后重新表达的程度,也就无法研究其参与轴突再生修复过程的机制。因此,建立GAP-43高表达的小鼠动物模型,应该可以从另一角度来观察GAP-43对神经系统损伤修复的作用,意义不言而喻。
为此,我们拟通过包装GAP-43高表达的质粒,注射到小鼠的受精卵中,培育、建立GAP-43高表达的转基因小鼠,希望能够以此为模型,进一步深入研究GAP-43在神经发育和再生修复中的作用。
1 材料与方法
1.1 实验材料
1.1.1 实验动物
实验动物4周龄SPF级C57BL/6J小鼠,中国医学科学院实验动物中心提供,实验动物许可证号:SCXK(京)2009-0007。所有实验用小鼠均在 SPF级动物房饲养和繁殖。温度控制在22℃,湿度70%,自动光控(12 h明/12 h暗),自由采食和饮水。
1.1.2 主要试剂
GAP-43蛋白全长cDNA真核细胞表达载体pCEP4-PDGF质粒由中国医学科学院动物所惠赠。GAP-43蛋白全长cDNA由上海吉凯公司提供。宿主菌E.coli DH5α为本实验室保存。核酸内切酶KpnI/XhoI购自TaKaRa公司,Wizard®Plus Midipreps DNA Purification System大提质粒试剂盒购自Promega公司,Omega Bio小提质粒试剂盒及PCR mix购自Invitrogen公司;PCR引物由Invitrogen公司合成。十二烷基硫酸钠(SDS)、聚氧乙烯单月桂酸酯、丙烯酰胺、N,N'-亚甲双丙烯酰胺以及兔抗小鼠actin抗体、兔抗小鼠GAP-43抗体均购自Sigma 公司;过硫酸氨 (APS)N,N,N',N'-四甲基乙二胺(TEMED)为Gibco公司产品,HRP标记山羊抗兔或山羊抗小鼠IgG为北京中山生物技术有限公司产品,BCA蛋白定量试剂盒购自Pierce公司,Kodak BioMax MR X-光片来自Kodak公司,封闭用正常山羊血清购自武汉博士德生物技术有限公司,Alexa flour 488/594标记的山羊抗小鼠/抗兔 IgG荧光二抗和TritonX-100则分别购自Moleculor Probe公司和Sigma公司。其他常用试剂均属于国产或进口的分析纯试剂。
1.2 实验方法
1.2.1 pCEP4-PDGF-GAP-43重组质粒的构建与鉴定
从成年的C57小鼠中提取RNA,反转录得到cDNA的第一条链,PCR大量扩增后得到目的基因GAP-43,采用KpnI/XhoI进行双酶切,1%琼脂糖凝胶电泳回收纯化目的片段697 bp连入线性化载体pCEP4-PDGF,转化感受态大肠杆菌E.Coli DH5α后,接种LB平板,挑取单菌落扩增后提取pCEP4-PDGF-GAP-43重组质粒。KpnI/XhoI双酶切鉴定后,送测序分析。
1.2.2 GAP-43转基因小鼠的制备
选取7~8周龄雌性C57BL/6J小鼠作为供体,与同种雄鼠合笼;另取数只2月龄以上的母鼠作为受体,与经过输精管结扎的雄鼠合笼,形成假孕母鼠。有精栓者手术取出输卵管,进而取出受精卵,培养后用注射针把转基因载体分别移入受精卵,然后将卵巢连同输卵管放回供体鼠腹腔。
1.2.3 GAP-43转基因小鼠的检测
1)PCR鉴定GAP-43高表达转基因小鼠的基因型:新生鼠2周龄时取尾部组织(约5 mm)常规方法提取组织DNA,用PCR对GAP-43片段进行检测;选取检测阳性的小鼠与C57BL/6J小鼠交配传代,子代经同法检测并再传代。正向引物序列为5'-GATGCTCCCGTTGCTGAT-3',反向引物序列为 5'-CCTTAGGTTTGGCTTCGTC-3';反应体系与扩增程序按照94℃变性30 s、58℃退火30 s和72℃延伸30 s的过程进行35个循环实施。
2)蛋白免疫印迹检测GAP-43的表达:在4℃条件下,在4周龄鼠脑中加入裂解液提取GAP-43蛋白,用BCA Protein Assay Kit测定样品蛋白含量。每个样本取10 μg蛋白进行SDS聚丙烯酰胺凝胶电泳并转至PVDF膜上,5% 脱脂奶粉封闭液,室温下置摇床上封闭1 h,再用TBST稀释的羊抗小鼠源重组的GAP-43单克隆抗体(1∶3 000稀释),4℃ 摇床杂交过夜;待恢复室温后,TBST洗3次,每次10 min置入 TBST稀释的辣根过氧化物酶标记的羊抗小鼠抗体(1∶5 000)室温杂交1 h,洗 3 次,每次 10 min,将膜置于化学发光液中,X-Ray胶片曝光,显影及定影。
3)组织免疫荧光检测GAP-43的表达:冰冻切片机海马连续切片,切片厚度为40 μm,全部贴片。切片入0.01 mol/L PBST中浸洗3次(5 min/次)后,入5%正常血清+0.1%BSA混合封闭液中室温封闭抗原;倾去血清后直接置入用0.01 mol/L PBST按1∶1 000稀释的GAP-43的抗体和用0.01 mol/L PBST按1:500稀释的Neun的抗体中,4℃过夜;切片再入PBST中浸洗3次(5 min/次),后放入用0.01 mol/L PBST稀释好的荧光二抗(1∶500)中,室温1 h;0.01 mol/L PBS浸洗3次(5 min/次)后,用1∶3 000 的 hochest33258 染核,15 min,室温避光;将切片最后用PBS浸洗2次(5 min/次),70%甘油封片。共聚焦显微镜下观察照相。
1.3 统计学方法
应用SPSS13.0软件进行统计分析。GAP-43蛋白含量以均数±标准误(x ±SE)表示。实验组和对照组比较行单因素方差分析(ANOVA)。以P<0.05为差异有统计学意义。
2 结果
2.1 重组质粒pCEP4-PDGF-AD-GAP-43的构建及酶切鉴定与序列分析
重组质粒分别经KpnⅠ/XhoⅠ双酶切后,将目的基因GAP-43插入双酶切位点之间(图1)。1%琼脂糖凝胶电泳分离均可见2个片段,酶切产物为684bp,与预期结果一致(图2)。GenBank BLAST分析显示,重组质粒测序结果显示目的基因与GenBank已报道的序列完全一致。
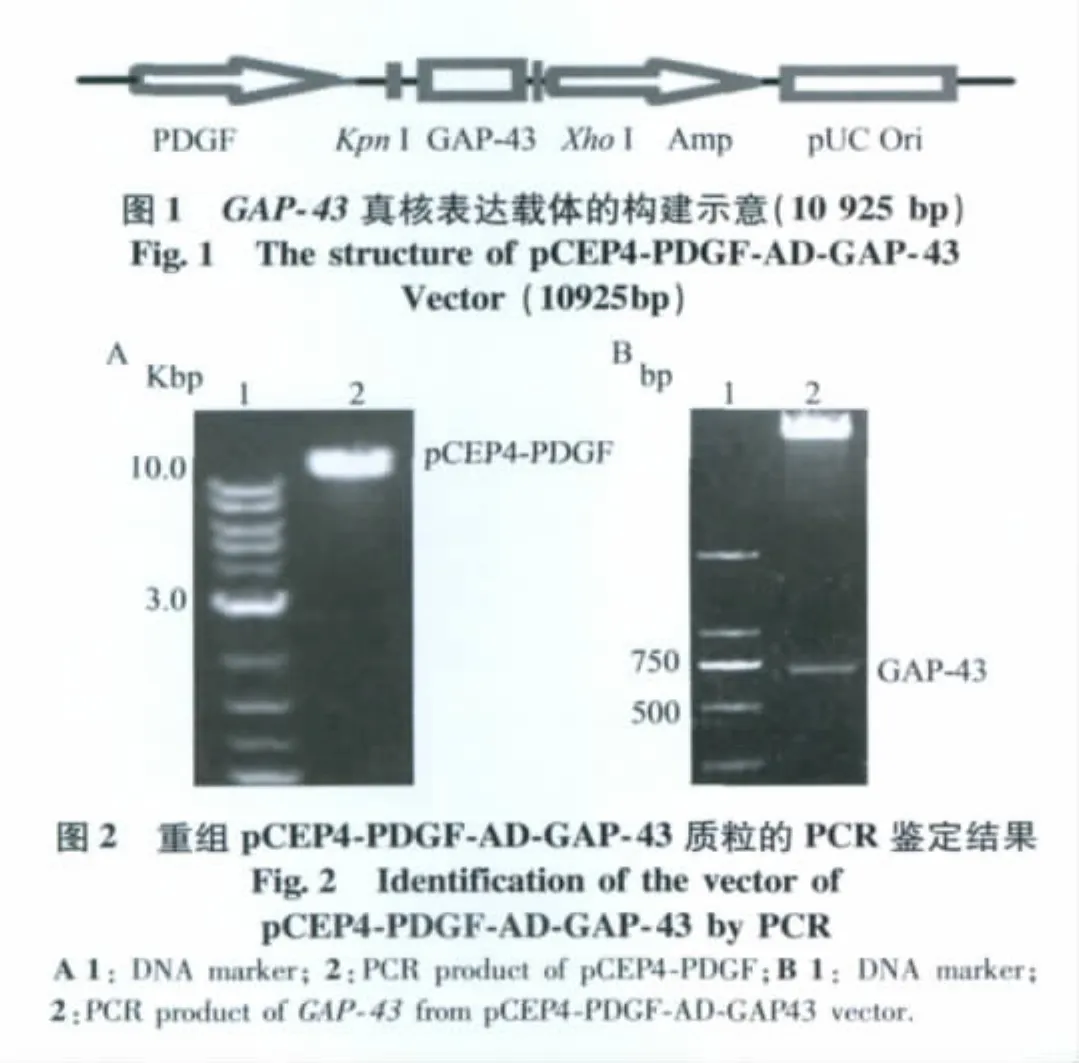
2.2 首建鼠的PCR鉴定
将带有包装好质粒的受精卵植入代孕母鼠后,分娩得到19只F1代小鼠,PCR鉴定如图3所示。结果显示GAP-43基因片段已经成功插入小鼠的基因组内,经测序后验证基因序列与原序列吻合,并得到9只首建GAP-43高表达小鼠。
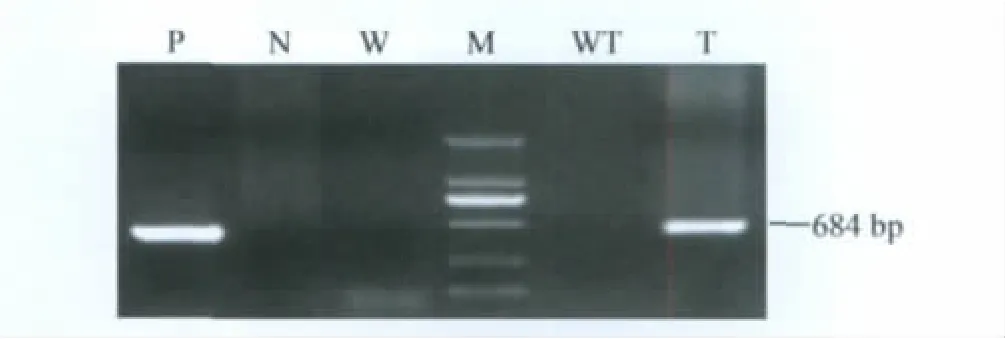
图3 GAP-43基因高表达F1代转基因小鼠PCR检测结果Fig.3 PCR results of F1 transgenic mice with high expression of GAP-43
2.3 蛋白免疫印迹检测GAP-43的表达
4周龄转基因组的小鼠海马中GAP-43蛋白的表达量高于对照组的同胞小鼠(图4)。
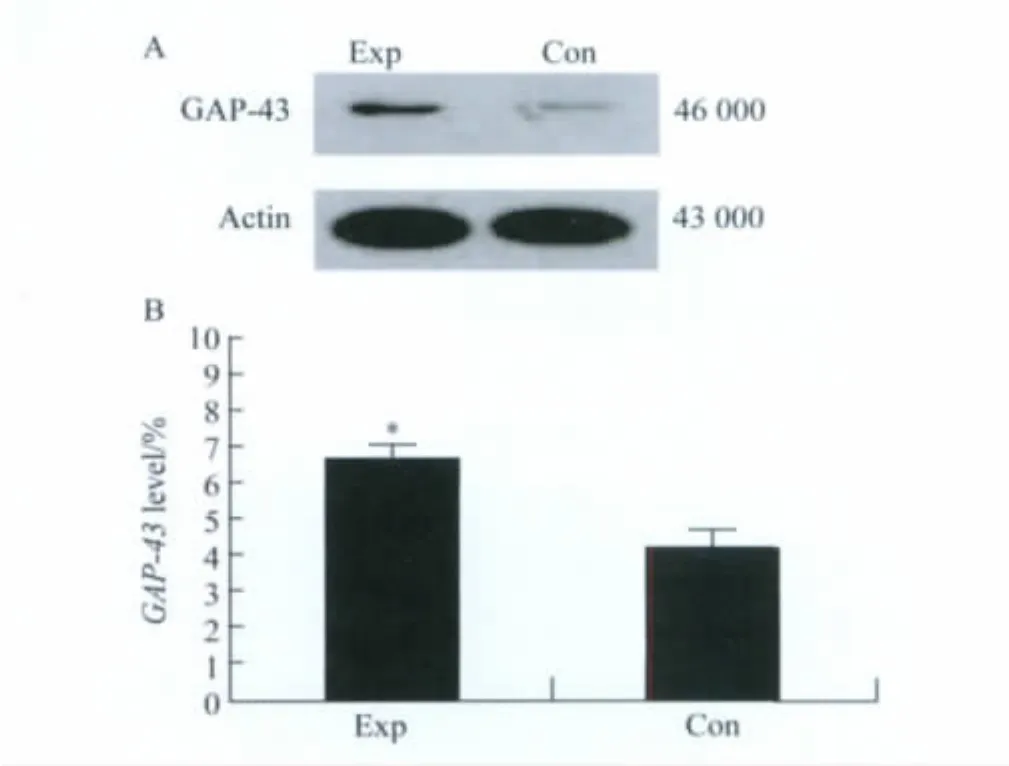
图4 Western blotting法检测GAP-43蛋白在海马的表达Fig.4 Determination of expression of GAP-43 protein by Western blotting in the hippocampus in normal and transgenic mice
2.4 组织免疫荧光检测GAP-43的表达位置
共聚焦显微镜观察P28龄高表达GAP-43转基因阳性小鼠脑区免疫荧光染色切片,可见GAP-43阳性反应物弥散分布于大脑皮质和海马区且特异性存在于神经元中(图5)。
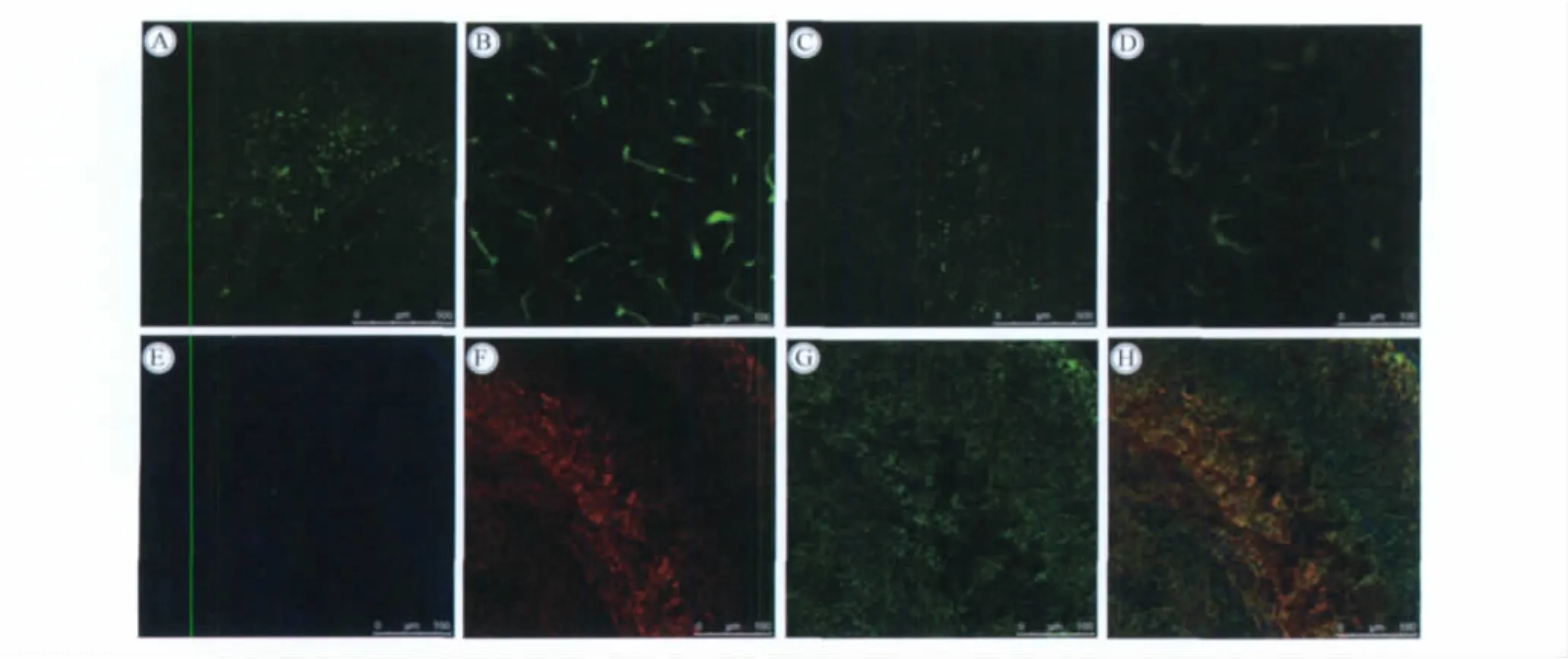
图5 免疫荧光技术显示GAP-43的表达Fig.5 Photomicrographs showing a comparison of immunofluorescence of GAP-43 in the cerebral cortex and hippocampus
3 讨论
转基因动物是指将外源基因用实验方法插入动物生殖细胞的基因组而获得的具有插入基因特性并能正常繁衍的动物[9-11]。众所周知,GAP-43在神经系统参与的生理和病理过程,在体实验多选用GAP-43基因敲除小鼠为研究的基础模型,但是GAP-43在体内缺失后,并不能完全屏蔽其作用。近年来研究[8]发现,GAP-43基因敲除小鼠发育正常,基本生理和认知功能未受到明显影响。相反,对高表达GAP-43基因小鼠的中枢神经系统的表现却研究很少。鉴于人们已经关注到GAP-43基因与中枢神经系统发育相关[3,12],因此,培育 GAP-43 高表达的转基因小鼠就有了重要的价值。
本实验以GAP-43为靶基因,成功构建了携带神经系统特异性启动子的pCEP4-PDGF打靶载体,通过显微注射技术建立了GAP-43高表达转基因小鼠。获得9只F0代转基因小鼠,将这些小鼠与C57BL/6J野生型小鼠交配产生F1代转基因小鼠。PCR结果显示GAP-43基因片段已经成功的插入小鼠的基因组内。PCR技术简单、快捷,通过对转入基因片段的扩增来检测动物的转基因事件,已被广泛用于转基因动物基因整合、表达的检测,但当转基因拷贝数较低或者与所转动物同源性较高时容易出现假阳性[13]。生产转基因动物关键在于外源蛋白是否表达,表达的蛋白质是否具有活性。目前蛋白质水平的检测方法主要有Western印迹法(Western blotting)和酶联免疫吸附法(enzyme linked immunos orbent assay,ELISA)。因为GAP-43 mRNA在海马区保持较高水平,而GAP-43蛋白的表达水平与GAP-43 mRNA的水平有很大的相关性,本研究取材4周龄小鼠海马区用于蛋白免疫印迹[14]。研究结果显示GAP-43高表达转基因组的小鼠,其GAP-43蛋白的表达量高于同胞对照组的小鼠且差异有统计学意义。正常大鼠脑内许多区域有GAP-43免疫组化反应阳性物:在大脑,阳性物弥散分布于皮质中,在边缘系统和联合区,包括与突触可塑性相关的一些区域如海马,GAP-43呈持续高水平表达[15]。为了进一步检测GAP-43高表达转基因小鼠的GAP-43蛋白表达位置,我们又采用了免疫荧光化学的方法,研究结果显示,GAP-43阳性反应物弥散分布于大脑皮质和海马中,且特异性存在于神经元中。GAP-43基因敲除小鼠在神经发育过程中不能表达GAP-43,因此,干扰了神经前体细胞分化为神经元的这一过程,从而导致神经元的数量减少,但其中的机制并不清楚[8]。本研究建立了GAP-43高表达转基因小鼠,初步观察到小鼠的运动能力较野生型小鼠有所增强,这是否是由于神经元的数量改变所引起有待于进一步的研究。综上所述,本研究通过显微注射法使外源基因GAP-43在小鼠基因组中整合并在子代小鼠中稳定遗传,并且在成年鼠的海马区高表达,即GAP-43高表达转基因小鼠在转录水平及表达水平建立成功。
过去认为,GAP-43只在成熟的神经元表达,在神经元轴突的再生和突触可塑性方面发挥重要功能[3,16]。现在人们对GAP-43有了新认识,发现GAP-43在神经发生早期就有表达,当GAP-43缺失时,神经发生就会被抑制[17-19]。体内研究[20]表明,当 GAP-43缺失时,神经前体细胞增生受抑制,未成熟神经元凋亡,星形胶质细胞分化受抑制。然而,人们对GAP-43蛋白的这些功能的机制却远远没有认识清楚。因此,GAP-43高表达转基因小鼠的成功建立应该为深入研究GAP-43在神经损伤修复及神经发育中的作用提供有力的动物模型基础。
[1]Benowitz L I,Perrone-Bizzozero N I.The expression of GAP-43 in relation to neuronal growth and plasticity:when where how and why?[J].Prog Brain Res,1991,89:69-87.
[2]Skene J H.Axonal growth-associated proteins[J].Annu Rev Neurosci,1989,12:127-156.
[3]Benowitz L I,Routtenberg A.GAP-43:an intrinsic determinant of neuronal development and plasticity[J].Trends Neurosci,1997,20(2):84-91.
[4]Horner P J.Regenerating the damaged central nervous system[J].Nature,2000,407(6807):963-970.
[5]So K F,Yip H K.Regenerative capacity of retinal ganglion cells in mammals[J],Vision Res,1998,38(10):1525-1535.
[6]Buffo A,Fronte M,Oestreicher A B,et al.Degenerative phenomena and reactive modifications of the adult rat inferior olivar neurons following axotomy and disconnection from their targets[J].Neuroscience,1998,85(2):587-604.
[7]Dusart I,Ghoumari A,Wehrle R,et al.Cell death and axon regeneration of Purkinje cells after axotomy:challenges of classical hypotheses of axon regeneration[J].Brain Res Brain Res Rev,2005,49(2):300-316.
[8]Mani S,Shen Y,Schaefer J,et al.Failure to express GAP-43 during neurogenesis affects cell cycle regulation and differentiation of neural precursors and stimulates apoptosis of neurons[J].Mol Cell Neurosci,2001,17(1):54-66.
[9]Miquerol L,Beyer S,Kelly RG.Establishment of the mouse ventricular conduction system[J].Cardiovascular Res,2011,91(2):232-242.
[10]马双陶,曹廷兵,马丽群,等.瞬时受体电位通道家族M 8型受体转基因小鼠模型的建立[J].中国医科大学学报,2010,39(4):251-254.
[11]张洪海,孙玉,柳雅立,等.gp120转基因小鼠制备及初步鉴定[J].首都医科大学学报,2010,31(6):695-700.
[12]Palacios G,Mengod G,Sarasa M,et al.Denovo synthesis of GAP-43:in situ hybridization histochemistry and light and electron microscopy immunocytochemical studies in regenerating motor neurons of cranial nerve nuclei in the rat brain[J].Brain Res Mol Brain Res,1994,24(1-4):107-117.
[13]杨继山,潘庆杰,董晓.转基因动物检测方法的研究进展[J].中国农业科技导报,2010,12(3):45-49.
[14]Kruger L,Bendotti C,Rivolta R,et al.Distribution of GAP-43 mRNA in the adult rat brain[J].J Comp Neurol,1993,333(3):417-434.
[15]Perrone-Bizzozero N I,Sower A C,Bird E D,et al.Levels of the growth-associated protein GAP-43 are selectively increased in association cortices in schizophrenia[J].Proc Natl Acad Sci USA,1996,93(24):14182-14187.
[16]Esdar C,Oehrlein S A,Reinhardt S,et al.The protein kinase C(PKC)substrate GAP-43 is already expressed in neural precursor cells,colocalizes with PKCeta and binds calmodulin[J].Eur J Neurosci,1999,11(2):503-516.
[17]Shen Y,Mani S,Meiri K F.Failure to express GAP-43 leads to disruption of a multipotent precursor and inhibits astrocyte differentiation[J].Mol Cell Neurosci,2004,26(3):390-405.
[18]Shen Y,Mishra R,Mani S,et al.Both cell-autonomous and cell no-autonomous functions of GAP-43 are required for normal patterning of the cerebellum in vivo[J].Cerebellum,2008,7(3):451-466.
[19]Mishra R,Gupta S K,Meiri K F,et al.GAP-43 is key to mitotic spindle control and centrosome-based polarization in neurons[J].Cell Cycle,2008,7(3):348-357.
[20]Shen Y P,Mani S,Meiri K F.Failure to express GAP-43 leads to disruption of a multipotent precursor and inhibits astrocyte differentiation[J].Mol Cell Neurosci,2004,26(3):390-405.

