局部亚低温对大鼠脑缺血再灌注基质金属蛋白酶9及细胞外基质蛋白表达的影响
李 芳 刘向荣 闫 峰 张陈诚 罗玉敏 方伯言 吉训明*
(1.辽宁医学院研究生院,辽宁锦州 121001;2.首都医科大学宣武医院脑血管病研究室,北京 100053;3.航天中心医院神经内科,北京 100049)
随着人口老龄化的到来,缺血性脑血管病的发病率逐年上升,给家庭及社会带来了沉重的负担。目前对缺血性脑血管病的公认有效治疗方法仍为超早期溶栓治疗,但溶栓后不可避免地造成脑缺血再灌注损伤。亚低温是指维持组织处于32℃ ~34℃,国内外研究[1-2]发现亚低温可以通过多种途径减轻脑缺血再灌注后损伤。脑缺血再灌注损伤可造成血脑脊液屏障(blood-brain barrier,BBB)的显著破坏。
基质金属蛋白酶9(matrix metalloproteinase 9,MMP9)主要作用于胶原(Ⅳ、Ⅴ、Ⅶ、Ⅹ)和层黏连蛋白(laminin,LN)、纤维连接蛋白(fibronectin,FN)等细胞外基质(extracellular matrix,ECM)成分[3],可导致 BBB 的损伤。LN和FN是基底膜的组成部分,是维持BBB完整性的重要蛋白质。严重的BBB破坏可以导致血管源性的脑水肿、颅内高压和脑缺血后致命性的出血转化[4]。
本实验主要探讨局部亚低温处理对大鼠脑缺血再灌注损伤时MMP9、LN及FN表达的影响,探明局部亚低温是否通过改变MMP9、LN及FN的表达来发挥神经保护作用。
1 材料与方法
1.1 材料
1.1.1 实验动物
选取清洁级、成年健康雄性SD大鼠45只,体质量280~310 g,由首都医科大学宣武医院动物实验室提供并饲养。实验动物许可证号:SCXK(京)2008-0001。
1.1.2 主要试剂及仪器
2,3,5-氯化三苯基四氮唑(2,3,5-triphenyltetrazolium chloride,TTC)购自美国 Amresco公司,MMP9兔源多克隆抗体购自美国Santa Cruz公司,FN和LN兔源多克隆抗体购自英国Abcam公司。四甲基异硫氰酸罗丹明(tetramethyl rhodamine iso-thiocyanate,TRITC)标记的山羊抗兔荧光二抗为美国Jackson Immuno Research Laboratories公司产品。含4',6-二脒基-2-苯基吲哚(4',6-diamidino-2-phenylindole,DAPI)的封片剂购自美国Invitrogen公司。荧光显微镜Nikon 80i为日本Nikon公司产品。
1.2 方法
1.2.1 实验动物分组及模型建立
改良线栓法[5]制作大鼠右侧大脑中动脉缺血再灌注模型,缺血时间为2 h。模型制作采用数字表法随机分7组:①假手术组(sham组,n=5);②正常体温再灌注4 h对照组(N-4 h组,n=5);③局部亚低温再灌注4 h组(H-4 h组,n=5);④正常体温再灌注24 h对照组(N-24 h组,n=10)⑤局部亚低温再灌注24 h组(H-24 h组,n=10);⑥正常体温再灌注72 h对照组(N-72 h组,n=5);⑦局部亚低温再灌注72 h组(H-72 h组,n=5)。
大鼠称体质量后,5%恩氟烷诱导麻醉,2%恩氟烷混合70%N2O及30%O2维持麻醉。取颈部正中切口,分离右侧颈外动脉和颈内动脉。于颈外动脉远端1.5 cm处结扎、电灼、切断其相应分支。将头端直径0.26 mm线栓由右侧颈外动脉断端经颈总动脉分叉至右侧颈内动脉,缓慢进线至有轻微阻挡感,此时线栓头端位于右侧大脑中动脉开口处。栓塞2 h后,取出线栓,电凝颈外动脉断端。局部亚低温再灌注组于缺血即刻在大鼠头部放置冰块,测温探头插入颞肌中,监测脑温维持于32.5℃ ~33.5℃,并持续至再灌注后1 h,低温共持续3 h,自动控温电热毯使肛温维持于36.5℃~37.5℃。正常体温再灌注组除头部不放置冰块,其余均与局部亚低温再灌注组一致。假手术组只分离暴露血管,不结扎颈外动脉,不插入尼龙鱼线。分别于再灌注4 h、24 h和72 h时处死大鼠,收集标本。假手术组于手术后24 h处死,取标本。
1.2.2 脑梗死体积测定
缺血再灌注24 h组大鼠经腹腔注射10%水合氯醛2 mL,诱导过度麻醉后,迅速断头取脑,横断面由前向后,取视交叉前4 mm及其后大脑做连续冠状切片(层厚2 mm),共取6片。将切片置于1.5%TTC溶液中,37℃避光孵育至大脑切片着色。TTC染色后可见正常脑组织呈成红色,梗死组织不着色。以Image J软件画图分析计算梗死体积比(%)。梗死体积比(%)=(健侧大脑半球体积-梗死侧非梗死区大脑半球体积)/健侧大脑半球体积×100%。健侧大脑半球体积=(A1+A2+……+A6)×H。梗死侧非梗死区大脑半球体积=(A1'+A2'+……+A6')×H。其中,An表示每张脑片健侧大脑面积,An'表示每张脑片梗死侧非梗死区大脑面积,H表示脑片厚度。
1.2.3 大鼠神经功能测定
神经功能测定采用Ludmila Belayev12分评分法[6]于再灌注24 h进行。(1)姿势反射测验,即提尾悬空试验:无明显神经功能缺失为0分,梗死对侧肢体屈曲为1分,侧推试验阳性为2分。(2)前肢放置试验:①视觉亚实验,即前方刺激。实验者将动物握于手中,使其前爪悬空,自桌面上方10 cm处向桌面缓慢斜线靠近(此时桌子位于大鼠前方),大鼠正常反应为前肢即刻抓向桌面,损伤大鼠则表现为肢体反应延迟。0分:动物肢体放置反应正常;1分:反应延迟但不超过2 s;2分:反应延迟且超过2 s。侧方刺激,此时桌子位于动物侧方,其余实验方法及评分标准同前方刺激。②触觉亚实验,将动物双眼遮住,并使其前爪悬空,此时大鼠既看不见,也不能用胡须触及桌面,用其前爪背侧轻触桌面,刺激深度仅达皮肤和毛发,动物反应及评分同视觉亚实验,触觉刺激同样分前方及侧方刺激。③本体觉亚实验,操作及评分同触觉亚实验,仅刺激深度不同,本体觉亚实验给予前爪较大压力,刺激深达肌肉及关节。该亚实验只有前方刺激。前肢放置实验总分范围0~10分,神经功能缺损越重,得分越高。
1.2.4 免疫荧光测定各组大鼠MMP9、FN及LN的表达
大鼠断头取脑,4%多聚甲醛(pH 7.0)固定48 h,以2 mm层厚将鼠脑均匀切为5片。常规脱水、透明、石蜡包埋后在切片机上连续冠状切片,片厚4 μm。组织切片依次进行二甲苯脱蜡、下行梯度乙醇水化,0.3%H2O2/甲醇溶液10 min消除内源性过氧化物酶活性,20 mg/L蛋白酶K室温作用30 min修复抗原,3%小牛血清室温封闭30 min阻止抗原非特异性结合后,一抗湿盒中4℃孵育过夜。荧光二抗室温孵育30 min后,DAPI封片,显微镜下观察。阴性对照除未用一抗孵育外,其余与上述步骤一致。抗体稀释比例如下:MMP9(1 ∶50),LN(1 ∶525),FN(1 ∶540),TRITC标记的山羊抗兔二抗(1:200)。采用Carl Zeiss公司的图像分析器检测缺血半暗带区域MMP9、LN和FN的免疫荧光强度,采用-log(检测区域的大脑吸光度/阴性对照吸光度)进行分析。
1.3 统计学方法
使用SPSS 13.0软件进行统计分析,计量数据以均数±标准差(x ±s)表示,两组间比较采用t检验,多组间比较采用单因素方差分析(One way ANOVA),均数两两比较采用Student Newman Keuls法,以P<0.05为差异有统计学意义。
2 结果
2.1 脑梗死体积测定结果
TTC是1种水溶性盐类物质,可以与细胞内线粒体脱氢酶反应生成深红色脂溶性物质。缺血2 h再灌注24 h组大鼠右额、顶叶皮质和基底节等缺血区因线粒体脱氢酶失活不染色呈苍白色,周围正常组织染成均匀的深红色。TTC染色结果经Image J软件分析,H-24 h组的脑梗死体积(18.34±7.06)%较N-24 h组(37.12±4.61)%减小,2组差异具有统计学意义(P=0.007)。详见图1。
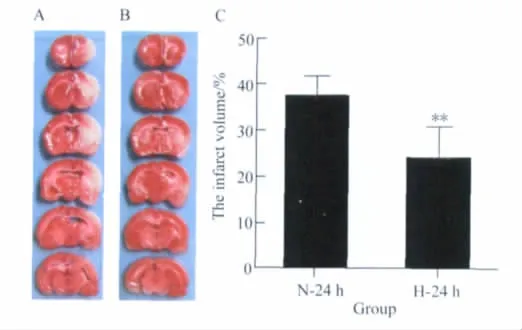
图1 脑梗死体积结果Fig.1 Results of cerebral infarction volume
2.2 大鼠神经功能测定结果
与N-24 h组(8.30±1.16)相比,H-24 h组神经功能评分(6.50±1.43)显著降低(P=0.006),神经功能明显改善,详见图2。
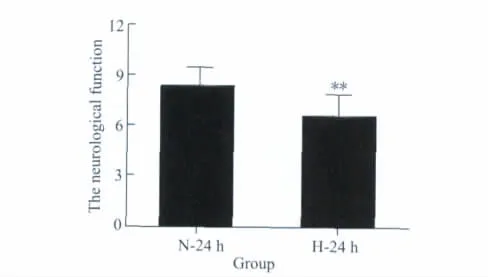
图2 神经功能评分结果Fig.2 Results of neurologic deficits score
2.3 免疫荧光检测MMP9结果
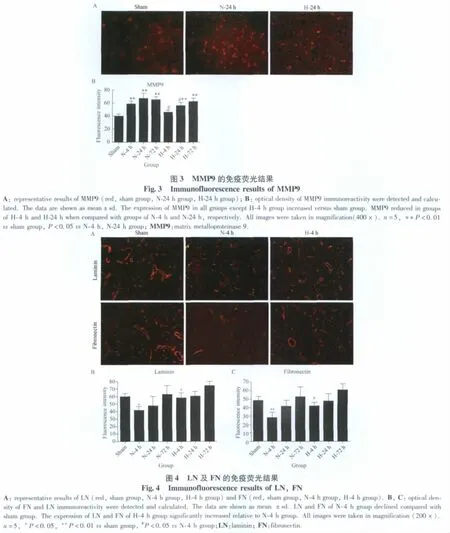
H-4 h组、H-24 h组大鼠脑组织MMP9表达均降低,与N-4 h组、N-24 h组相比差异有统计学意义(P<0.05),详见图3。
2.4 免疫荧光检测LN及FN结果
给予局部亚低温处理,H-4 h组大鼠脑组织LN及FN表达均较N-4 h组升高,且差异有统计学意义(P<0.05)。详见图4。
3 讨论
脑缺血再灌注损伤是一个多环节、多因素、多途径损伤的酶促级联反应过程[7]。在缺血再灌注过程中,BBB结构和功能常遭破坏。BBB由内皮细胞、内皮细胞间的紧密连接、包绕血管的星形胶质细胞足突、周细胞及其间的基底膜等形成并维持其功能[8]。毛细血管外周的ECM泛指细胞分泌的以基底膜或不定形式存在于细胞外间隙的分子,主要有IV型胶原、LN、FN、硫酸乙酞蛋白多糖等,对血液中的物质经过内皮细胞进入脑起了电荷屏障和分子筛的作用。BBB破坏基础上ECM的构成变化,可以直接影响神经系统疾病的演变[9]。
Rosenberg等[10]研究发现缺血再灌注损伤后数小时BBB开放,但此时的开放是短暂的,随后24 h至48 h BBB有一个更严重的破坏。我们发现,与假手术组比较,正常体温再灌注4 h MMP9表达即增加,24 h达高峰,这与血脑脊液屏障的第2次开放时间一致,表明MMP9可能参与血脑脊液屏障的破坏。而局部亚低温再灌注4 h组MMP9表达无明显增加,提示局部亚低温在缺血再灌注早期即可抑制MMP9的表达。局部亚低温再灌注24 h、72 h组MMP9表达虽较假手术组增加,但分别较正常体温再灌注24 h、72 h组表达下降,说明局部亚低温处理可在缺血再灌注4 h~24 h明显抑制MMP9的表达。同时,局部亚低温处理再灌注24 h可减少脑梗死体积,改善大鼠神经功能,提示局部亚低温处理可能在缺血再灌注早期通过抑制MMP9的表达发挥神经保护作用。目前,局部亚低温处理导致MMP9表达下调的机制还没有确切报道。肿瘤坏死因子-α (tumor necrosis factor-α,TNF-α)可以刺激周细胞释放MMP9[11],局部亚低温处理缺血再灌注模型后,TNF-α表达是否有变化,待于进一步研究。金属蛋白酶组织抑制因子(tissue inhibitors of metalloproteinases,TIMPs)可以调节 MMP9的活性。其中,TIMP-1优先与MMP9特异性结合,形成可溶性非共价复合物而发挥其抑制作用[12]。已有研究[13]证明,缺血后低温处理可以增加内源性TIMPs的水平,表明局部亚低温处理有可能是通过增加TIMP-1表达从而抑制MMP9的活性来发挥神经保护作用。
LN主要由内皮细胞和上皮细胞合成与分泌,与Ⅳ型胶原特定位点结合形成复杂立体结构,维持基底膜正常功能和稳定结构,对BBB的功能和完整性有重要作用[14]。FN广泛存在于细胞表面、结缔组织、细胞外液和大部分的基底膜上,是ECM的重要组成部分。细胞表面及ECM中的FN分子间通过二硫键相互交联,组装成纤维,维持细胞和基底膜的功能[15]。FN和LN在基底膜内起支持作用,可防止由于静水压和渗透压改变引起的血管变形[3]。MMP9在缺血再灌注损伤早期通过降解细胞外基质成分,包括IV型胶原、LN、FN和内皮紧密连接的闭锁小带,导致BBB的破坏。正常体温再灌注4 h组LN和FN表达较假手术组显著减少,而局部亚低温再灌注4 h组LN和FN表达较正常体温再灌注4 h组显著增加,提示缺血再灌注可以减少LN和FN的表达,局部亚低温处理则可在缺血再灌注早期抑制LN和FN降解。局部亚低温在缺血再灌注早期可抑制MMP9的表达,表明局部亚低温处理早期可通过抑制MMP9表达,从而抑制其对LN和FN的降解发挥神经保护作用。局部亚低温再灌注24 h组MMP9表达也明显较正常体温再灌注24 h组下降,而此时LN和FN表达与后者比较差异无统计学意义,是由于样本量较少所致误差,还是二者表达还受MMP9外其他因素影响,有待于进一步研究。
综上所述,局部亚低温可能通过抑制缺血再灌注后MMP9的表达,增加LN和FN的表达发挥神经保护作用。
[1]Zgavc T,Ceulemans A G,Sarre S,et al.Experimental and clinical use of therapeutic hypothermia for ischemic stroke:opportunities and limitations[J].Stroke Res Treat,2011,2011:689290.
[2]Turner R J,Vink R.Combined tissue plasminogen activator and an NK1 tachykinin receptor antagonist:an effective treatment for reperfusion injury following acute ischemic stroke in rats[J].Neuroscience,2012,220:1-10.
[3]Copin J C,Bengualid D J,Da Silva R F,et al.Recombinant tissue plasminogen activator induces blood-brain barrier breakdown bya matrix metalloproteinase-9-independent pathway after transient focal cerebral ischemia in mouse[J].Eur J Neurosci,2011,34(7):1085-1092.
[4]Feiler S,Plesnila N,Thal S C,et al.Contribution of matrix metalloproteinase-9 to cerebral edema and functional outcome following experimental subarachnoid hemorrhage[J].Cerebrovasc Dis,2011,32(3):289-295.
[5]Longa E Z,Weinstein P R,Carlson S,et al.Reversible middle cerebral artery occlusion without craniectomy in rats[J].Stroke,1989,20(1):84-91.
[6]Belayev L,Alonso O F,Busto R,et al.Middle cerebral artery occlusion in the rat by intraluminal suture.Neurological and pathological evaluation of an improved model[J].Stroke,1996,27(9):1616-1622.
[7]Klassman L.Therapeutic hypothermia in acute stroke[J].J Neurosci Nurs,2011,43(2):94-103.
[8]Banerjee S,Bhat M A.Neuron-glial interactions in bloodbrain barrier formation [J].Annu Rev Neurosci,2007,30:235-258.
[9]Baeten K M,Akassoglou K.Extracellular matrix and matrix receptors in blood-brain barrier formation and stroke[J].Dev Neurobiol,2011,71(11):1018-1039.
[10]Rosenberg G A,Yang Y.Vasogenic edema due to tight junction disruption by matrix metalloproteinases in cerebral ischemia[J].Neurosurg Focus,2007,22(5):e4.
[11]Takata F,Dohgu S,Matsumoto J,et al.Brain pericytes among cells constituting the blood-brain barrier are highly sensitive to tumor necrosis factor-α,releasing matrix metalloproteinase-9 and migrating in vitro[J].J Neuroinflammation,2011,8:106.
[12]Dafnis I,Tzinia A K,Tsilibary E C,et al.An apolipoprotein E4 fragment affects matrix metalloproteinase 9,tissue inhibitor of metalloproteinase 1 and cytokine levels in brain cell lines[J].Neuroscience,2012,210:21-32.
[13]Zhao H,Li C S,Gong P,et al.Molecular mechanisms of therapeutic hypothermia on neurological function in a swine model of cardiopulmonary resuscitation [J].Resuscitation,2012,83(7):913-920.
[14]Cui J,Chen S,Zhang C,et al.Inhibition of MMP-9 by a selective gelatinase inhibitor protects neurovasculature from embolic focal cerebral ischemia [J].Mol Neurodegener,2012,7(1):21.
[15]Khan M M,Gandhi C,Chauhan N,et al.Alternativelyspliced extra domain A of fibronectin promotes acute inflammation and brain injury after cerebral ischemia in mice[J].Stroke,2012,43(5):1376-1382.

