6A,6A'-苯胺-6B,6B'-硒桥联-β-CD 底物的特异性
吕绍武,吕冰聪,宗 慧,陶 进,王宏龄
(1.吉林大学分子酶学工程教育部重点实验室,长春130012;2.玉米深加工国家工程研究中心,长春130033)
谷胱甘肽过氧化物酶(gluathione peroxidase,GPx,EC.1.11.1.9)在生物体内具有维持体内活性氧(reactive oxygen species,ROS)平衡的作用,对预防和治疗白内障、心血管病及癌症等有明显效果[1].由于天然GPx稳定性较差,且其催化中心硒代半胱氨酸(Sec)由终止密码子UGA编码,不易用基因工程方法量产而限制了其应用,因此GPx模拟物成为抗氧化治疗的研究热点[2-3].
本文基于调节催化基团硒(Se)氧化还原环境和引入底物结合部位的原理,设计合成了6A,6A'-二苯胺-6B,6B'-二硒桥联-β-CD(6-AnSeCD)分子[4],并测定了6-AnSeCD 催化谷胱甘肽(GSH)还原不同结构氢过氧化物的GPx活力,分析了6-AnSeCD稳态动力学常数的差异,确定6-AnSeCD的首选底物为枯烯过氧化氢(CumOOH).
1 实验
1.1 试剂与仪器
β-环糊精(β-CD)购自上海惠世生化试剂有限公司,经蒸馏水重结晶3次,120℃真空干燥12 h备用;硼氢化钠(NaBH4)、谷胱甘肽还原酶、还原型辅酶(NADPH)、还原型谷胱甘肽(GSH)、硒粉(Se)、1,3-间苯磺酰氯(1,3-benzenedisulfonyl chloride)、叔丁基过氧化氢(t-BuOOH)、枯烯过氧化氢(CumOOH)和依布硒啉(Ebselen)均购自美国Sigma公司;双氧水购自英国Alfa Aesar公司;DEAE-52购自英国Whatman公司;Sephadex G-25购自瑞典Pharmacia公司;其他试剂均为购自北京化学试剂厂的分析纯试剂.
240-DS型元素分析仪(美国 Perkin-Elmer公司);IFS66型傅里叶变换红外光谱仪(德国Bruker公司);UNITY-400型核磁共振仪(美国Varian公司);ESCALAB MKⅡ型 X-ray光电子能谱仪(英国VG公司);ALPHAL-2型冻干机(德国 Christ公司);UV-2550型分光光度计(日本Shimadu公司).
1.2 6-AnSeCD的合成与表征
按照文献[4]合成6-AnSeCD,表征结果与文献[4]报道一致.
1.3 GPx活力测定及稳态动力学分析
采用双酶体系,按Wilson方法[5]测定模拟物的GPx活力.向反应池中加入缓冲液、GSH溶液、GSH还原酶和模拟物,37℃保温7 min后先加入NADPH,再加入氢过氧化物启动反应.用含有体积分数为0.2%TritonX-100的PBS溶解有机氢过氧化物(t-BuOOH,CumOOH),模拟物的活力由在340 nm(εNADPH=6 220 L/(mol·cm))处NADPH光吸收值的降低确定.以缓冲溶液代替模拟物为空白以消除非酶促反应.酶活力单位定义为37℃每分钟氧化1 μmol NADPH所需的模拟物量.动力学分析是保持一种底物的浓度不变,改变另一种底物的浓度,测定NADPH在340 nm处光吸收值的变化确定其初速度.
2 结果与讨论
2.16 -AnSeCD的GPx活力
表1列出了6-AnSeCD与其他模拟物催化GSH还原氢过氧化物的GPx活力比较结果.由表1可见,6-AnSeCD和6-SeCD催化GSH还原H2O2的GPx活力分别为6.1 min-1和4.2 min-1,高于Ebselen的GPx活力(1.9 min-1).这是由于Ebselen分子缺少有效的底物识别及结合作用,而在6-AnSeCD和6-SeCD的分子结构中,β-CD的疏水空腔能结合形状和大小匹配的底物,因此6-AnSeCD和6-SeCD与Ebselen相比具有更好的底物识别及结合能力,具有较高的GPx活力.
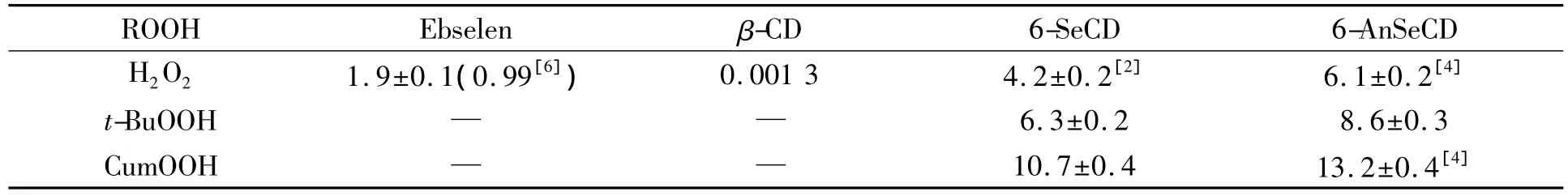
表1 6-AnSeCD与其他模拟物催化GSH还原氢过氧化物的GPx活力比较(min-1)Table 1 Comparison between GPx activities of 6-AnTeCD-catalyzed reduction of hydroperoxides by GSH and other mimics(min-1)
6-AnSeCD催化GSH还原H2O2,t-BuOOH,CumOOH时的GPx活力分别为6.1,8.6,13.2 min-1,均高于6-SeCD催化GSH还原相应的氢过氧化物.该结果可用Wilson理论[5]解释.催化巯基化合物还原ROOH的催化机理如图1所示,该催化机理包括氧化和巯基还原两个过程.由图1可见,N原子接近活性部位的Se原子可稳定硒氢基的催化中间体,从而增加二硒化合物的GPx活力.6-AnSeCD对不同结构的ROOH显示出不同的底物特异性,其催化上述3种氢过氧化物的GPx活力顺序为CumOOH>t-BuOOH>H2O2.
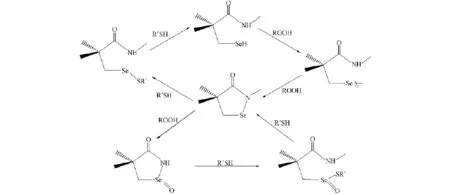
图1 Wilson提出的催化机理Fig.1 Catalytic mechanism proposed by Wilson
2.2 6-AnSeCD的稳态动力学分析
固定一种底物浓度,改变另一种底物浓度,测定不同条件下的反应初速度.初速度与浓度的双倒数曲线如图2所示,为一系列平行线,表明6-AnSeCD的催化机制与天然GPx类似,均为乒乓机制.
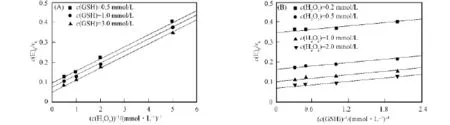
图2 6-AnSeCD催化谷胱甘肽还原过氧化氢的双倒数曲线Fig.2 Double-reciprocal plots for the reduction of H2O2by GSH catalyzed by 6-AnSeCD
比较动力学参数可确定模拟物对不同底物动力学行为的差异,本文根据该反应的稳态动力学方程计算了模拟物的动力学常数,结果列于表2.该反应的稳态动力学方程为
其中:v0为反应初速度;c(E)0为GPx模拟物的浓度;kmax为假一级反应速度常数;KROOH和KGSH分别为ROOH和GSH的米氏常数(Km).

表2 6-AnSeCD的动力学参数Table 2 Kinetic parameters of the 6-AnSeCD
由表2可见,对于同种巯基底物(GSH),kmax值的变化顺序为kmax(CumOOH)>kmax(t-BuOOH)>kmax(H2O2).由于kmax值一般指该反应的最大kcat值[7],因此每秒钟每个酶分子转换ROOH底物分子数的顺序为CumOOH>t-BuOOH>H2O2,表明6-AnSeCD可高效转化CumOOH;Km值的变化顺序为KCumOOH<Kt-BuOOH<KH2O2,该结果可用尺寸匹配理论解释[8],即CumOOH的分子形状和大小与β-CD的疏水空腔匹配,因此结合能力最强,t-BuOOH的分子中侧链基团较多,产生的空间位阻影响了匹配程度,因此结合能力较强,H2O2分子依靠自由运动与疏水空腔结合,因此结合能力最弱,该结果与文献[9]结果相符;二级反应速率常数k(k=kmax/KROOH)的变化顺序为 kCumOOH>kt-BuOOH>kH2O2,表明6-AnSeCD对不同的ROOH底物具有不同的结合能力和底物特异性.
综上所述,本文可得如下结论:6-AnSeCD还原CumOOH的GPx活力最高;6-AnSeCD的催化机制为乒乓机制;CumOOH为6-AnSeCD的最适底物.
[1]Mugesh G,Mont W W,du,Sies H.Chemistry of Biologically Important Synthetic Organoselenium Compounds[J].Chem Rev,2001,101(7):2125-2179.
[2]LUO Gui-min,REN Xiao-jun,LIU Jun-qiu,et al.Towards More Efficient Glutathione Peroxidase Mimics:Substrate Recognition and Catalytic Group Assembly[J].Curr Med Chem,2003,10(13):1151-1183.
[3]HUANG Xing,LIU Xiao-man,LUO Quan,et al.Artificial Selenoenzymes:Designed and Redesigned[J].Chem Soc Rev,2011,40(3):1171-1184.
[4]ZHENG Qing-chuan,LÜ Shao-wu,ZHAO Yong-shan,et al.Effects of GSH on the Activity of Two Glutathione Peroxidase Mimic[J].Chemical Journal of Chinese Universities,2008,29(12):2337-2340.(郑清川,吕绍武,赵勇山,等.GSH对两种谷胱甘肽过氧化物酶模拟物活性影响的研究[J].高等学校化学学报,2008,29(12):2337-2340.)
[5]Wilson S R,Zucker P A,Huang R R C.A Spector,Development of Synthetic Compounds with Glutathione Peroxidase Activity[J].J Am Chem Soc,1989,111(15):5936-5939.
[6]ZOU Xian-feng,LÜ Shao-wu.A Tetrapeptide Containing Selenium(SecRGD)with Glutathione Peroxidase Activity[J].Chemical Journal of Chinese Universities,2012,33(5):983-987.(邹险峰,吕绍武.具有谷胱甘肽过氧化物酶(GPx)活力的含硒四肽(SecRGD)的研究[J].高等学校化学学报,2012,33(5):983-987.)
[7]Bell I M,Hilvert D.Peroxide Dependence of the Semisynthetic Enzyme Selenosubtilisin[J].Biochemistry,1993,32(50):13969-13973.
[8]Inoue Y,Hakushi T,LIU Yu,et al.Thermodynamics of Molecular Recognition by Cyclodextrins.1.Calorimetric Titration of Inclusion Complexation of Naphthalenesulfonates with.alpha.-,.beta.-,and.gamma.-Cyclodextrins:Enthalpy-Entropy Compensation[J].J Am Chem Soc,1993,115(2):475-481.
[9]LÜ Shao-wu,ZHENG Qing-chuan,MU Ying,et al.Evaluating Substrate Specificity of Glutathione Peroxidase Mimic by Molecular Dynamics Simulations and Kinetics[J].J Incl Phenom Macro,2008,60(1/2):139-144.

