纳米PbO2/TiO2催化电极的制备及其对己二醛氧化的电催化性能
朱传高,王凤武,徐 迈,方文彦
(淮南师范学院化学系,安徽淮南232001)
二氧化钛(TiO2)易被激发出电子或得到电子,具有较高的催化活性;TiO2掺杂金属修饰[1]和复合半导体均可显著提高其催化活性.二氧化铅(β-PbO2)作为氧化性电极[2-3]具有抗氧化能力强和电催化活性好等优点,广泛应用于蓄电池及半导体材料中.文献[4-5]用化学法将PbO2与TiO2掺杂,有效改变了PbO2的性能,提高了电极的坚固性、导电性和耐腐蚀性,在电催化反应和电极使用寿命上均具有显著效果.由于组成掺杂不均匀和前驱体中缺少足够的有机体,因此化学法[6-7]制备得到的纳米PbO2/TiO2电极催化活性不稳定,煅烧过程中易发生团聚,导致电极的有效表面积减小,电催化活性降低.本文在有机体系中采用铅、钛金属电解合成铅、钛醇盐配合物,先对金属醇盐的有机体系直接水解,再煅烧制备纳米PbO2/TiO2电极,并考察掺杂PbO2对电极催化性能的影响.结果表明,纳米TiO2掺杂PbO2制备的电极材料颗粒较小,对己二醛有较强的催化氧化效果.
1 实验
1.1 试剂与仪器
导电盐采用四丁基溴化铵Bu4NBr(上海凌峰化学试剂有限公司);活化处理金属钛片(贵州省遵义钛厂)和铅片(上海化学试剂公司)作为阳极备用;其他试剂均为国产分析纯.
使用傅里叶变换红外光谱仪(AVATAR360型,美国Nicolet公司)测试前驱体的结构,收集范围400~4 000 cm-1(KBr压片).Raman测试采用共聚焦显微Raman系统(LabramⅠ型,法国Dilor公司),He-Ne激光器激发线波长为632.8 nm.采用LCQ Advantage MAX型质谱仪(美国Finnigan公司)测试分子量.微晶结构采用XRD-6000型X射线衍射仪(日本Shimadzu公司,Cu Kα靶,λ=0.154 06 nm,35 kV,25 mA)鉴定,扫描范围10°~70°,扫速4°/min;扫描电镜(SEM)表征采用FE-SEM 电子扫描显微镜(JSM-6700F型,日本JEOL公司).采用自行设计的两电极无隔膜玻璃电解槽进行电解实验;电化学实验使用CHI660A型电化学工作站(美国CH Instrument公司).
1.2 电极制备方法
1)纳米TiO2掺杂PbO2粉体的制备:打磨、清洗后的铅片为阴极,钛片为阳极(面积均为1.5 cm×3 cm),置于干燥的无隔膜电解槽中,电解液为含0.03 mol/L(Bu4N)Br的乙二醇溶液.在磁力搅拌下,向电解反应装置中通入经干燥处理后的氩气.先电解钛片4 h,再交换阴阳电极电解铅片2 h(电解液30~40℃,电流0.20 A).向所得溶液中滴加稀氨水,控制pH≈8.0.磁力搅拌1 h,溶液逐渐变黏稠,约5 h后生成淡黄色均质胶状物.用无水乙醇清洗,以1 500 r/min离心分离胶状物2次,放置24 h胶体凝固,将干凝胶体置于马弗炉中,450℃煅烧2 h生成纳米PbO2/TiO2粉体.
2)制备纳米PbO2/TiO2膜电极:用砂纸打磨Ti丝后,将Ti丝插入n(HCl)∶n(HF)=1的混合溶液中,表面浸蚀片刻,用无水乙醇清洗Ti丝后晾干.将Ti丝插入上述黄色胶状物中,采用提拉法进行表面涂覆,放置晾干后在红外灯下加热约30 min置于马弗炉中,450℃煅烧30 min,自然降温后取出.重复上述过程4次即可制得Ti基纳米PbO2/TiO2膜电极.
1.3 循环伏安测试和电解合成
在纳米PbO2/TiO2膜电极(0.01 cm2)的三电极系统中,以HCl溶液和不同浓度的己二醛溶液为电解液,饱和甘汞电极(SCE)为参比电极,Pt片为辅助电极,在100 mV/s扫描速度下得到循环伏安曲线,考察PbO2对催化氧化己二醛的影响.
Ti基纳米PbO2/TiO2膜电极作为阳极电解氧化己二醛,电解槽为三室离子膜,两边为阳极室,中间为阴极室,阴极为面积较大的Ti片电极,用8511B型恒电位仪控制电位电解,电解液温度30℃.阳极液为0.2 mol/L OHC-(CH2)4CHO+0.1 mol/L HCl溶液,阴极液为0.1 mol/L HCl溶液.电解产物用NaOH标准液与Na2SO3溶液测定;采用重结晶法提取己二酸,通过红外谱测试其结构.
2 结果与讨论
2.1 复合金属醇盐的合成与结构表征
在乙二醇溶液中电解得到的淡黄色铅和钛醇盐配合物可稳定存在.在干燥的Ar气氛下分离提纯电解产物,用重蒸过的苯对其进行重结晶,产物熔点187~201℃.
图1为前驱体PbTi2(OCH2CH2OH)12-x和纳米PbO2/TiO2的红外光谱.由图1中曲线a可见:在3 126 cm-1和2 942~2 869 cm-1处出现O—H和C—H振动吸收峰;在1 163 cm-1附近出现C—O键吸收峰;在710,597 cm-1处分别出现Ti—O键和Pb—O键吸收峰[8].由曲线b可见,在712,599 cm-1处分别出现Ti—O键和Pb—O键的振动吸收峰,未见杂质峰,表明粉体纯度较高.经元素分析可得产物测试值(计算值,%)分别为Pb 51.56(51.94)和Ti 23.87(24.00).
图2为前驱体PbTi2(OCH2CH2OH)12-x的Raman光谱.由图2可见:在3 094 cm-1和2 900 cm-1附近出现O—H和C—H振动吸收峰;1 217 cm-1附近出现C—O键吸收峰;在712,603 cm-1处出现Ti—O和Pb—O键吸收峰[9].前驱体的Raman光谱与红外光谱基本吻合.
反应原理如下:

四价或二价金属离子和乙二醇氧负离子可形成环状螯合物[10],这种金属醇盐的结构较稳定,可避免在水解时产生团聚现象.
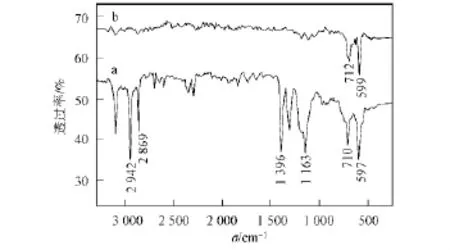
图1 前驱体(a)及纳米PbO2/TiO2(b)的红外光谱Fig.1 IR spectra of the precursor(a)and nano-PbO2/TiO2(b)

图2 前驱体PbTi2(OCH2CH2OH)12-x的Raman光谱Fig.2 Raman spectrum of the precursor PbTi2(OCH2CH2OH)12-x
2.2 纳米PbO2/TiO2电极的物相与形貌
在450℃煅烧铅和钛醇盐配合物的干凝胶粉体,所得产物的XRD谱如图3所示.由图3可见,产物 PbO2的2θ值在25.45°,32.01°,36.22°,49.09°,52.17°处出现衍射峰,参照标准卡片(PDF41-1492),峰位置与强度分别对应于 β-PbO2的(111),(101),(200),(211)和(220)晶面峰,在25.22°,37.74°,48.13°,55.04°和 62.65°处出现的特征峰显示为锐钛矿型 TiO2晶体,参照标准卡片(PDF21-1272),峰位置与峰强度分别对应于TiO2的(101),(004),(200),(211)和(204)晶面峰.
图4为450℃煅烧2 h所得纳米PbO2/TiO2电极的SEM照片.由图4可见,颗粒粒径集中分布在100~150 nm,尺寸较均匀.这是由于干凝胶中的有机体经煅烧可分解产生大量CO2气体,使得粉体不易团聚,因而PbO2/TiO2表面粉体粒径较小.当干凝胶煅烧温度大于700℃时,得到的样品团聚现象较严重.因此,应将干凝胶的煅烧温度控制在450℃.
2.3 纳米PbO2/TiO2电极催化合成己二酸
表1列出了纳米PbO2/TiO2膜电极(n(Pb)∶n(Ti)=1∶2)在阳极溶液为(0.10~0.30 mol/L)OHC(CH2)4CHO+(0.10~0.20 mol/L)HCl溶液中电催化实验的结果.由表1可见:增强酸性对电极的催化性能影响较小;PbO2/TiO2膜电极比TiO2膜电极的催化氧化效果好,绝大部分己二醛被电解氧化生成己二酸,产率为97.4%.当n(Pb)∶n(Ti)=1∶4或1时,在相同条件下电解产率均低于86%,这可能是由于掺杂不同量的PbO2在晶格中引入缺陷位置或改变其结晶程度不同,同时在电极表面形成了不同的表面效应和隧穿效应,从而对质子或电子的吸引能力不同,产生不同的催化氧化活性.因此,选用n(Pb)∶n(Ti)=1∶2较适宜.

图3 纳米PbO2/TiO2的XRD谱Fig.3 XRD pattern of nanometer PbO2/TiO2

图4 纳米PbO2/TiO2电极的SEM照片Fig.4 SEM image of nanometer PbO2/TiO2
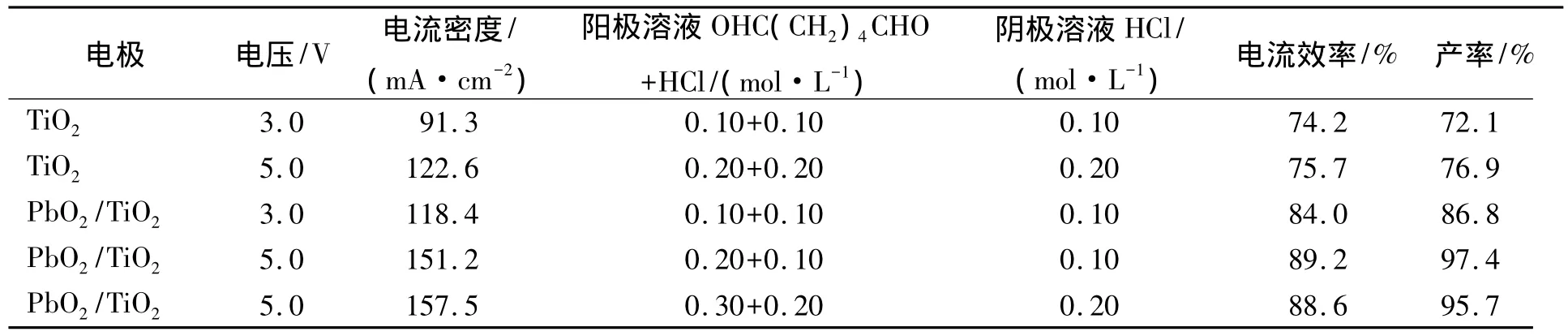
表1 不同电极对电合成己二酸的影响因素Table 1 Effect of different electrodes on electro-synthesis of tricarboxylic acid
图5为电解产物经重结晶提纯后所得己二酸的红外光谱.由图5可见:在3 236 cm-1处为O—H键伸缩振动峰,由于氢键作用向低波数方向移动;在 2 927cm-1处为 C—H键伸缩振动峰;在1 769 cm-1处为 C O键伸缩振动峰;在1 452 cm-1处出现—CH2—官能团的吸收峰.与己二酸标准红外光谱中特征峰的位置和强度基本一致.将己二酸进行质谱测试,结果为m/z(%):100(100%),60(49.5%),69(43.1%),87(40.4%),73(29.4%),58(11.9%),与己二酸的标准质谱一致,表明产物纯度较高.

图5 己二酸的红外光谱Fig.5 IR spectrum of HOOC(CH2)4COOH
2.4 纳米PbO2/TiO2修饰电极的电催化活性
图6为纳米PbO2/TiO2膜电极以100 mV/s的扫描速度在不同溶液中的循环伏安(CV)曲线,其中曲线a为0.1 mol/L HCl+0.2 mol/L OHC(CH2)4CHO溶液的CV曲线,曲线b为0.1 mol/L HCl溶液的CV曲线.由图6可见:曲线a在0.67~0.77 V出现第一个氧化峰,在回扫时未发现还原峰,为非可逆反应;在0.7~0.8 V出现第二个氧化峰,且峰电流较大,回扫时出现相对较弱的还原峰,为准可逆反应.表明膜电极在阳极较低电位下可将己二醛氧化为己醛酸,在较高电位下再将己醛酸氧化为己二酸,且氧化活性较强.这是由于己醛酸中的羧基具有较强的吸电子效应,使醛基中电子密度降低,需在较高电位下氧化;酸性增强可增加电极的氧化性和溶液的导电性,使氧化性电极具有更好的催化氧化效果.
图7为纳米TiO2电极与PbO2/TiO2电极在0.1 mol/L HCl+0.2 mol/L OHC(CH2)4CHO溶液中的CV曲线.由图7可见,电解中出现了较强的氧化峰.与纳米TiO2电极相比,PbO2/TiO2电极的氧化峰电位负移,峰电流显著增大,峰电位差明显减小,表明电极有较好的催化活性和稳定性[11].
Simond等[12]认为:金属氧化物(MOx)电极未直接参与氧化有机物,而是水分子在电极表面反应生成吸附态羟基自由基;由吸附态羟基自由基生成更高价态的氧化物MOx+1.高价态氧化物和羟基自由基间接氧化有机物,羟基自由基氧化有机物的反应为非可逆反应.反应原理如下:
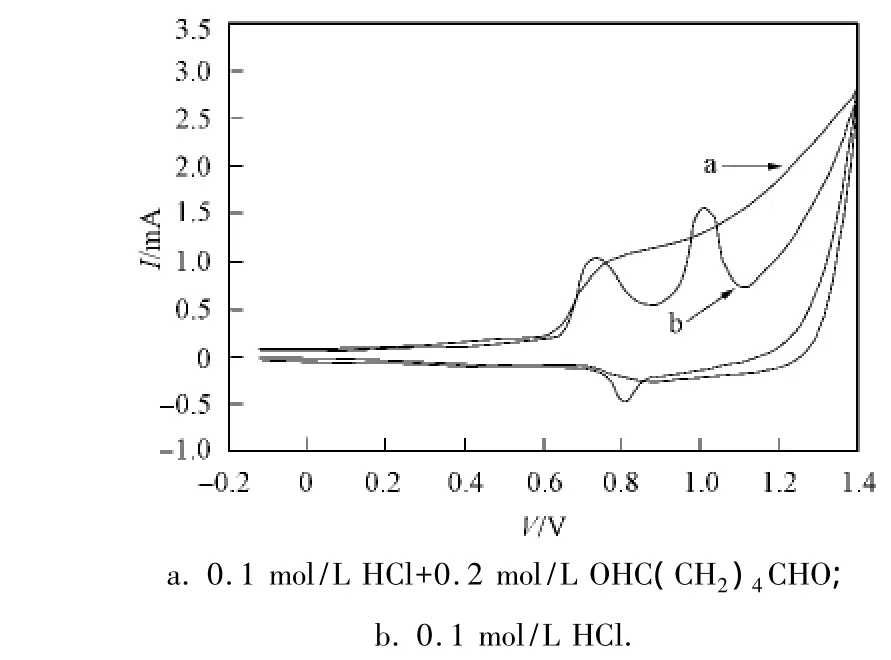
图6 纳米PbO2/TiO2膜电极在不同溶液中的CV曲线Fig.6 Cyclic voltammetric curves of the nano-PbO2/TiO2 electrode in different solutions
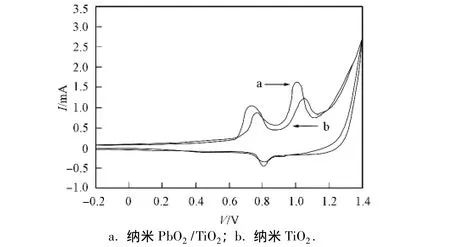
图7 不同膜电极在0.1 mol/L HCl+0.2 mol/L OHC(CH2)4CHO溶液中的CV曲线Fig.7 Cyclicvoltammetric curvesofthe different electrodes in the solution of 0.1 mol/L HCl+0.2 mol/L OHC(CH2)4CHO
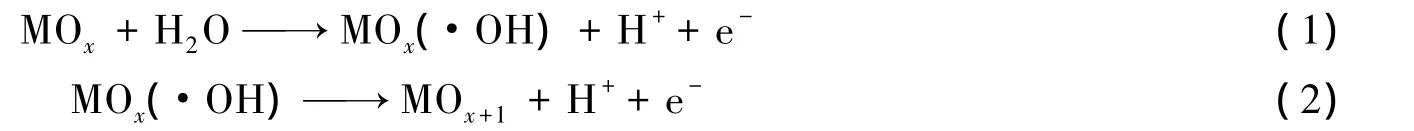
由曲线b可见,在-0.2~1.2 V扫描电位区间出现一对氧化还原峰,Δ Ep>120 mV,表明该反应为准可逆电荷跃迁过程[13],TiO2电极可能发生如下反应:
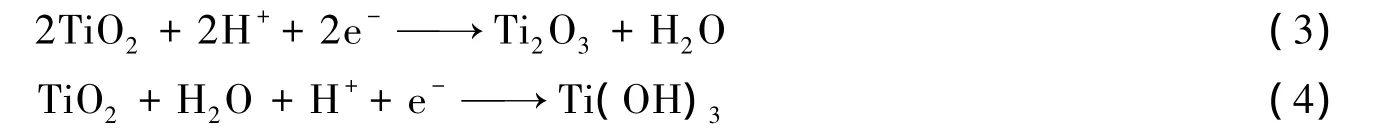
由式(3),(4)可见,增强酸性有利于提高电极的催化性能,这是由于H+参与电极反应,有利于生成Ti2O3和Ti(OH)3.但增强酸性不利于形成羟基自由基,从而影响PbO2的催化活性.因此,PbO2/TiO2膜电极不宜在酸性过强(c(H+)>2.0 mol/L)的条件下使用.
图8为PbO2/TiO2膜电极在不同浓度己二醛溶液中的 CV曲线.图9为纳米 TiO2电极和PbO2/TiO2电极在0.1 mol/L HCl+0.2 mol/L OHC(CH2)4CHO溶液中1.0 V电极电势下电解1 h的计时电流密度曲线.

图9 不同膜电极在0.1 mol/L HCl+0.2 mol/L OHC(CH2)4CHO溶液中的计时电流密度曲线Fig.9 Chronoamperograms of different electrodes in the solution of 0.1 mol/L HCl+0.2 mol/L OHC(CH2)4CHO
由图8可见:当扫描速度相同时,氧化-还原峰电位变化较小;峰电流随己二醛浓度增加而增大,这是因为己二醛与电极活性点的接触频率增大,使得反应几率增大所致;己二醛的氧化电位与PbO2/TiO2膜电极的可逆电位相近,有利于电极活性物质的转化,从而提高电极的充电效率.由图9可见:电解电流密度初始较高,这是由于双电层充电电流较大所致,6.667 min后电极电流趋于平缓;纳米PbO2/TiO2电极比TiO2电极对己二醛的催化电流密度高,约为TiO2电极的1.8倍,表明纳米PbO2/TiO2电极对己二醛的催化活性更高.使用纳米PbO2/TiO2膜电极在阳极扫描区间内(-0.2~1.4 V)经5次电解实验后,膜未脱落或溶解,未发现阳极溶解行为,电极催化活性基本保持不变.纳米PbO2/TiO2膜电极的电化学活性受酸中阴离子种类影响较小,应用于酸性介质的可选择性较宽,有利于纳米PbO2/TiO2催化电极在工业上的应用.
综上,本文在乙二醇溶液中以铅和钛金属为电极,合成醇盐配合物PbTi2(OCH2CH2OH)12-x,对电解液进行水解、干燥后经450℃煅烧,得到分散较均匀的纳米PbO2/TiO2粉体,再通过提拉法得到高活性的纳米PbO2/TiO2修饰电极,晶粒尺寸为100~150 nm.通过循环伏安法研究发现:纳米PbO2/TiO2膜电极氧化峰电流密度明显增大,为157 mA/cm2;间接电氧化己二醛生成己二酸产率为97.4%.
[1]GUO Nan,GUO Kun,SHENG Ye,et al.Optical Properties and Energy Transfer Mechanism of Tb3+/Gd3+Co-doped Nanometer TiO2Thin Film[J].Journal of Jilin University:Science Edition,2009,47(2):367-375.(郭楠,郭坤,盛野,等.Tb3+和Gd3+掺杂的纳米TiO2薄膜的制备及发光性能与发光机理[J].吉林大学学报:理学版,2009,47(2):367-375.)
[2]LIN Hai-bo,LIU Xiao-bo,SUN Zhi-quan,et al.Electrochemical Oxidation-Degradation of Phenol on Ti/PbO2and Ti/Ru-Ti-Sn Oxide Coating Electroodes[J].Chemical Journal of Chinese Universities,2005,26(9):1709-1711.(林海波,刘小波,孙智权,等.Ti/PbO2和Ti/Ru-Ti-Sn氧化物涂层电极上苯酚的电化学氧化和降解[J].高等学校化学学报,2005,26(9):1709-1711.)
[3]Bertoncello R,Cattarin S,Frateur I,et al.Preparation of Anodes for Oxygen Evolution by Electrodeposition of Composite Oxides of Pb and Ru on Ti[J].J Electroanal Chem,2000,492(2):145-149.
[4]FENG Jian-ren,Johnson D C.Electrocatalysis of Anodic Oxygen-Transfer Reactions:Titanium Substrates for Pure and Doped Lead Dioxide Films[J].J Electrochem Soc,1991,138(11):3328-3337.
[5]LI Guo-ting,QU Jiu-hui,ZHANG Xi-wang,et al.Electrochemically Assisted Photocatalytic Degradation of Acid Orange 7 with β-PbO2Electrodes Modified by TiO2[J].Water Research,2006,40(2):213-220.
[6]Velichenko A B,Knysh V A,Luk’yanenko T V,et al.PbO2-TiO2Composite Electrodes[J].Protection of Metals and Physical Chemistry of Surfaces,2009,45(3):327-332.
[7]CAI Tian-xiao,JU He,WU Hong-rang,et al.The Property of β-PbO2Electrode by Adding of Nanograde TiO2Powders[J].Rare Met Mater Eng,2003,32(7):558-560.(蔡天晓,鞠鹤,武宏让,等.β-PbO2电极中加入纳米级TiO2的性能研究[J].稀有金属材料与工程,2003,32(7):558-560.)
[8]Selvaraj U,Brooks K,Parasadaro A V,et al.Sol-Gel Fabrication of Pb(Zr0.52Ti0.48)O3Thin Films Using Lead Acetylacetonate as the Lead Source[J].J Am Ceram Soc,1997,76(6):1441-1447.
[9]ZHU Chuan-gao,CHU Dao-bao.Preparation of Nanocrystalline PbTiO3Powder by Lead and Titanium Ethoxide Complexes[J].Journal of Jilin University:Science Edition,2005,43(4):507-512.(朱传高,褚道葆.由铅、钛乙醇盐配合物制备纳米PbTiO3粉体[J].吉林大学学报:理学版,2005,43(4):507-512.)
[10]ZHU Chuan-gao,WANG Feng-wu,XU Mai,et al.Synthesis of Metal Alkoxide Complex and Nano-NiFe2O4in HOCH2CH2OH Solution[J].Chinese Journal of Inorganic Chemistry,2009,25(7):1177-1181.(朱传高,王凤武,徐迈,等.在乙二醇溶液中合成复合金属醇盐和纳米NiFe2O4[J].无机化学学报,2009,25(7):1177-1181.)
[11]MA Chun-an,ZHU Xiu-shan,ZHAO Feng-ming.Electrolytic Synthesis of Succinic Acid on Ti/TiO2Film Electrode[J].Chemical Journal of Chinese Universities,2010,31(10):2046-2051.(马淳安,朱秀山,赵峰鸣.丁二酸在Ti/TiO2膜电极上的电化学合成[J].高等学校化学学报,2010,31(10):2046-2051.)
[12]Simond O,Schaller V,Comninellis C.Theoretical Model for the Anodic Oxidation of Organics on Metal Oxide Electrodes[J].Electrochimica Acta,1997,42(13/14):2009-2012.
[13]高小霞.电化学和电分析化学[M].北京:北京大学出版社,1983:7-30. (责任编辑:单 凝)

