大孔树脂混用技术分离纯化桑叶总酚
王 艺,彭国平*,欧阳臻,李存玉,郑云枫,李贺敏,李红阳
1南京中医药大学药学院,南京 210023;2江苏大学药学院,镇江 212013
桑叶为桑科植物桑(Morus alba L.)的干燥叶。有疏散风热、清肺润燥、清肝明目之功效。主治风热感冒、肺热燥咳、头晕头疼、目赤晕花等症。现代药理学研究表明,桑叶可抑制血糖升高,具有预防和治疗糖尿病的作用,这与桑叶中含有的酚类成分有关[1],所以对桑叶中酚类成分的研究成为目前桑叶研究的热点之一。
目前,对酚类成分的富集方法主要有大孔树脂富集[2],聚酰胺富集[3]。其中大孔树脂以其成本低,操作方便等特点被广泛用于总酚的吸附纯化,王俊[4]等利用大孔树脂分离纯化桑叶总黄酮,陈伟[5]等利用大孔树脂联用技术制备升麻总酚酸。但是大孔树脂一次富集得到的总酚纯度不高,二次上柱则又繁琐耗时。本研究在对桑叶总酚进行富集纯化时对大孔树脂型号进行了筛选,研究树脂混合使用的新工艺方法。对树脂混合比例以及上样量、浓度、流速和洗脱剂浓度进行考察,并通过试验重复验证。本研究对主要成分富集提供了一种新颖的分离途径,且方法简单易操作,为工业生产提供了一定的参考依据。
1 材料与方法
1.1 仪器和试剂
Spectrum 752型紫外分光光度计(上海光谱仪器有限公司);Agilent 1100高效液相色谱仪(美国安捷伦公司);LIBROR AEL-40SM电子天平(十万分之一);KQ-100B超声波清洗器(昆山市超声仪器有限公司);PTHW型电热套(巩义市英峪予华仪器厂);TGL-16C高速离心机(上海安亭科学仪器厂)。
桑叶采自江苏大学校园内,晾干,经南京中医药大学吴启南教授鉴定为桑叶;咖啡酸对照品(批号110885-200102,中国药品生物制品检定所);大孔树脂(HPD400、HPD826、HPD417、HPD722、HPD100、HPD600、D101、ADS-17,均购于河北沧州宝恩化工有限公司);其它试剂均为国产分析纯。
1.2 大孔树脂预处理
用95%乙醇浸泡过夜,湿法装柱,水洗至无醇味,用2.5 BV(树脂体积)的5%NaOH溶液洗脱至无色,后用水洗脱至中性;再用2.5 BV的5%HCl洗脱至无色,用水洗脱至中性,备用。
1.3 桑叶水提液的制备
取粉碎过筛的桑叶药材适量,加14倍(生药量)的水回流提取3次,每次1.5 h,过滤,合并滤液,减压浓缩,加水溶解至每1 mL含0.5 g生药,过滤,备用。
1.4 桑叶总酚的制备
分别取经过预处理的大孔树脂 HPD400、HPD826、HPD417、HPD722、HPD100、HPD600、D101和ADS-17各200 mL,装柱,取桑叶提取液(含生药量120 g),共8份,以浓度100 mg/mL,上样流速为10 mL/min上样,树脂用 70%乙醇洗脱。另取HPD400和HPD826树脂各100 mL,混合均匀,同法操作得洗脱液。
1.5 HPLC检测条件
流动相:乙腈(A)-0.5%乙酸水(B);洗脱梯度(0~5 min:30%A;5~10 min:30%→35%A;10~15 min:35%→40%A;15~18 min:40%→50%A;18~40 min:50%→80%A);检测波长358 nm;色谱柱:Hedera C18(4.6 mm × 250 mm,5 μm)。
1.6 MS条件
ESI离子源:源电压为3.5 kV;正、负离子检测;鞘气(N2)流速80 a.u.;辅助气(N2)流速15 a.u.;碰撞气体为He;毛细管温度为250℃;毛细管电压±5 V。采用全离子扫描方式,扫描范围m/z 120~1000。
1.7 桑叶总酚含量测定方法
1.7.1 标准曲线的制备
精密称取咖啡酸对照品适量,用60%乙醇溶解,制成1 mg/mL的溶液作为咖啡酸对照液。精密吸取对照液 0.5、1、2、4、8 mL 各两份,分别置于 10 mL容量瓶中,一份分别加30%乙醇定容至10 mL作空白溶液;一份精密加入5%Na2SO3溶液0.3 mL,摇匀,放置6 min,再精密吸取10%Al(NO3)3溶液0.3 mL,摇匀,放置6 min,然后加入1 mol/L NaOH 4 mL,用30%乙醇定容至刻度,摇匀,放置10 min,做供试品溶液。利用分光光度法,分别取空白溶液和供试品溶液在510 nm波长出测定吸光度。以吸光度之差为纵坐标y,以咖啡酸浓度为横坐标x,进行线性回归,得回归方程 y=0.4233 x+0.0028,R2=0.9991,对照在0.05 ~ 0.8 mg/mL 线性良好。
1.7.2 样品含量测定
精密量取样品,两份,适当稀释后,按照1.6.1项下,从“分别置于10 mL”,到“在510 nm波长出测定吸光度”,然后带入标准曲线计算得桑叶中总酚的含量。
2 结果与分析
2.1 大孔树脂型号的优选
指纹图谱是中药质量控制的有效手段,本研究采用HPLC检测各种大孔树脂对桑叶提取物的富集信息,比较各有效部位的指纹图谱信息,并通过LC/MS技术和标准品验证识别相关标志性色谱峰,优选出富集能力较好的大孔树脂。
本研究对 HPD400、HPD417、HPD100、HPD600、HPD722、HPD826、D101和 ADS-17八种大孔树脂进行比较分析。如图1所示,HPD400和HPD826的富集成分的指纹图谱的色谱峰的强度和数量均优于其他6种大孔树脂。HPD826对峰1、2和3的对应物质的吸附能力明显优于HPD400;HPD400对峰5和6所对应物质的吸附能力则较优。将HPD400和HPD826以1∶1(v/v)进行混合,该混合树脂对峰1、2、3、5和6所对应物质的吸附能力均较优。
本研究采用LC/MS技术和UV分析法,分别对大孔树脂富集得到成分进行结构鉴别和含量测定,以佐证混合树脂对桑叶提取物中总酚类物质的较优的富集能力。LC/MS分析结果见表1。由表1可见,图1中峰1 ~5,6,9和10对应峰物质分别为新绿原酸、隐绿原酸、绿原酸、槲皮素-3,7-二氧葡萄糖苷、咖啡酸、5-O-咖啡酰莽草酸、芦丁和槲皮素。
经UV分析法分析,对八种大孔树脂和混合树脂所获得的总酚的质量进行综合评分。综合评分=总酚转移率×0.5+总酚质量分数×0.5。总酚转移率和总酚质量分数是按以下方法计算得出:取“1.4”项下各种单一树脂包括混合树脂所得的乙醇洗脱液,根据“1.6.1”项下总酚含量测定方法测得每个树脂洗脱的总酚质量,并求出总酚从提取液中到乙醇洗脱液的转移率;同时精密量取部分洗脱液,干燥,称重,算出总酚的质量分数。如表2所示,HPD400和HPD826各自吸附的总酚转移率和综合评分均优于其他树脂,这和液相检测图谱数据一致。两者混合后的混合树脂图谱综合评分也变高,进一步的验证了上述液相的分析结果。
综上分析,本研究选取HPD400和HPD826两种大孔树脂进行混合使用,以期较好的富集桑叶提取物中的总酚类成分。
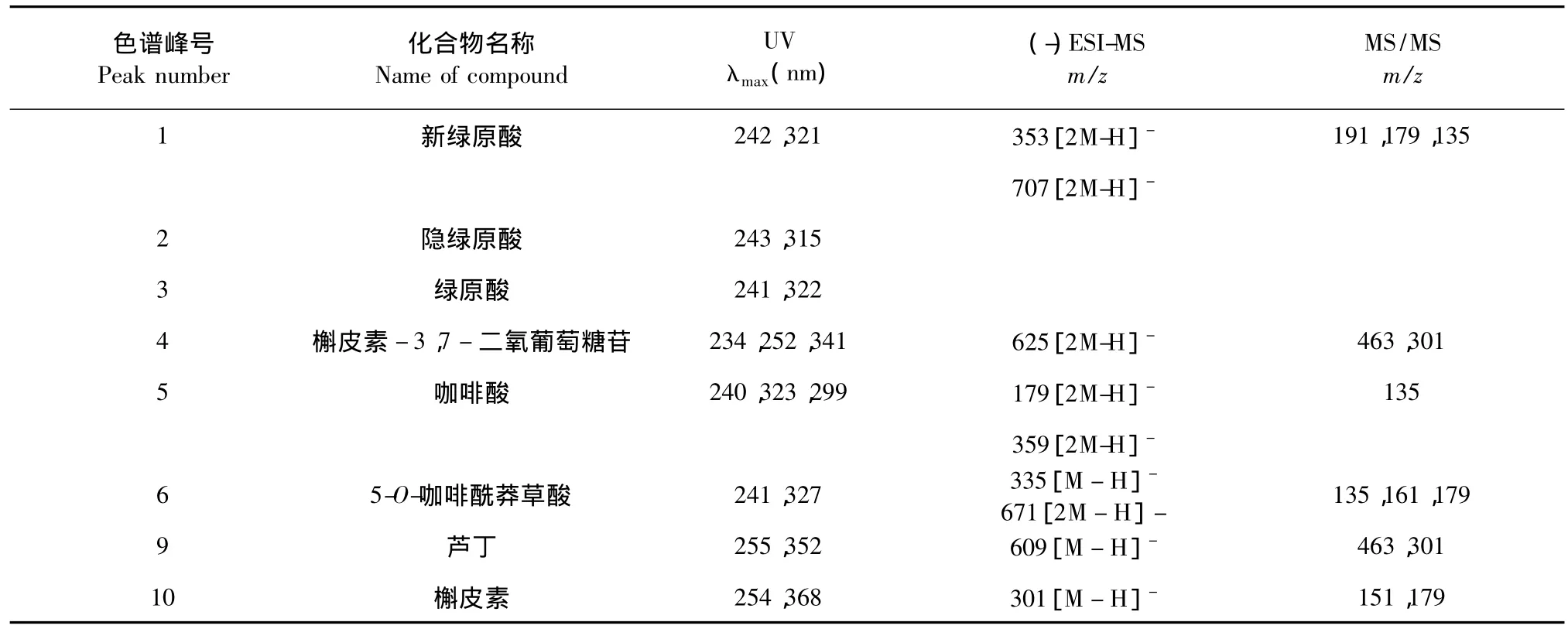
表 1 HPLC-ESI-MS 分析结果[6-10]Table 1 Results of HPLC-ESI-MS analysis
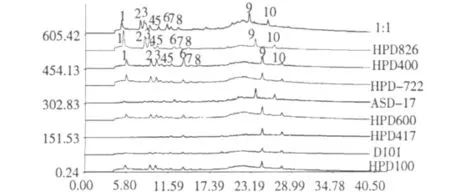
图1 不同树脂吸附总酚的HPLC图谱Fig.1 HPLC chromatograms of total phenols extracted from different resins
2.2 HPD826和HPD400混合比例的筛选
进一步对优选出的HPD826和HPD400两种树脂的混合比例进行研究,以获得较优的富集效果。取 HPD826 和 HPD400 适量,按照 0.5∶1;1∶1;2∶1;3∶1的不同体积比混合成200 mL,分别装柱,按照“1.4”项下装柱,同法操作,得乙醇洗脱液,以上述的综合评分为指标。如表3所示,两者体积比例为1∶1时明显优于其它所考察比例,效果最好。故最终确定HPD826和HPD400的混合体积比为1∶1。
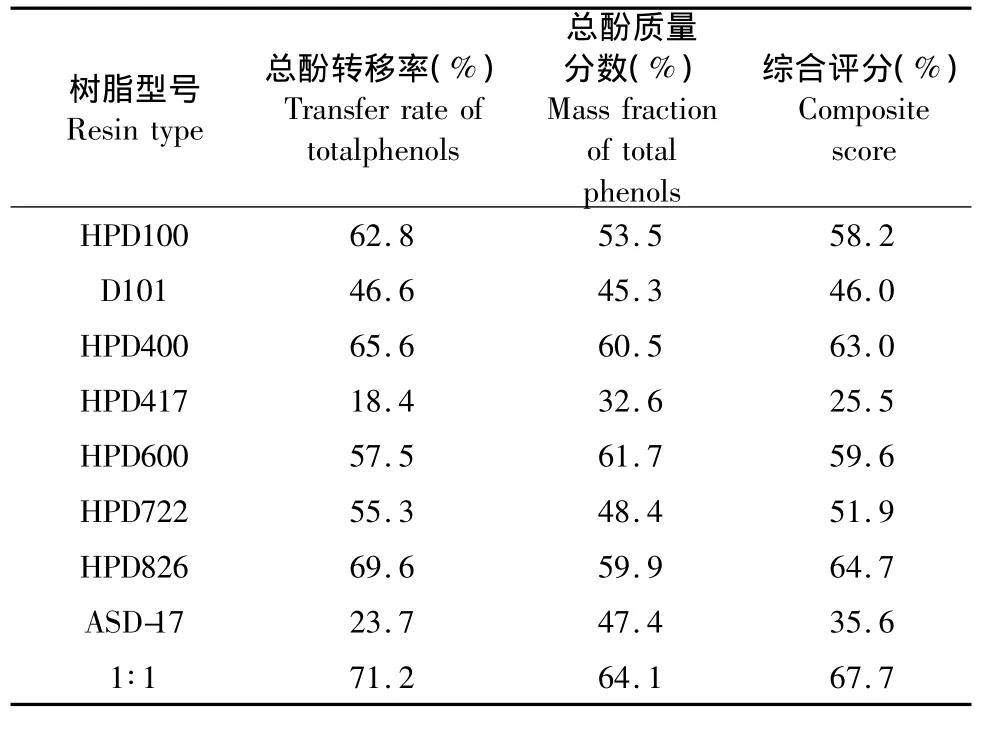
表2 不同树脂洗脱的总酚含量比较Table 2 Comparison of contents of total phenols from different resins
2.3 总酚纯化工艺的优选
总酚的纯化工艺除了要求选择较好的富集材料,对于纯化过程的试验参数,如上样量、上样浓度、上样速度、洗脱剂的浓度等,也需进行考察。
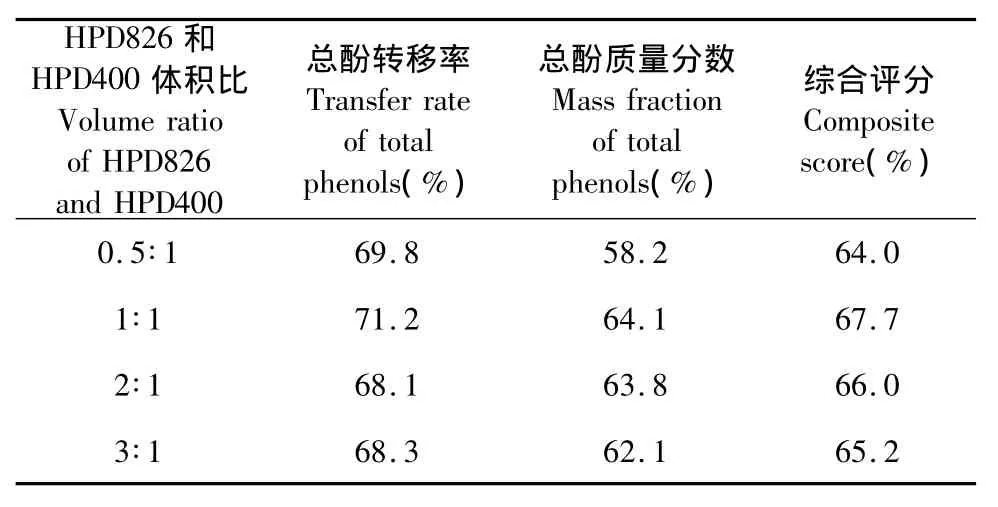
表3 HPD400和HPD826混合比例的筛选Table 3 Determination of the ratio of HPD400 and HPD826
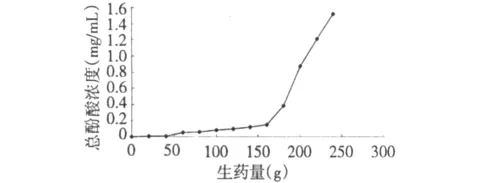
图2 泄漏曲线Fig.2 Leakage curve
2.3.1 泄漏曲线
取经过预处理的混合大孔树脂200 mL,药液浓度为以桑叶药材生药量计为100 mg/mL,上样流速为6 mL/min,每200 mL(即生药量20 g)为一流份,按照“1.6.2”项下方法检测总酚含量,结果见图2。当生药量超过180 g时,总酚浓度陡然上升,出现明显泄漏,因此为在保证总酚的同时又能增大上样量,初步选择160 g生药量作为上样量。
2.3.2 桑叶总酚富集工艺的因素考察
2.3.2.1 正交实验
取经过预处理的大孔树脂200 mL,9份。选取上样量(生药量)、上样浓度、上样流速和乙醇浓度四个因素作为考察因素,设计正交因素水平表,见表4。以综合评分作为考察指标,选用L9(34)正交表进行实验。实验结果见表5,方差分析见表6,从直观分析可看出:四个因素对试验结果影响大小次序为A>C>D>B;从方差分析结果可见上样量对试验结果有显著性影响,上样浓度影响最小,从节省时间考虑选择浓度最大的水平3,综合选择最佳工艺为A2B3C1D2,即上样量160 g,上样浓度150 mg/mL,上样流速10 min/mL,60%乙醇洗脱。2.3.2.2 工艺验证实验

表4 因素水平表Table 4 Factors and levels of orthogonal design
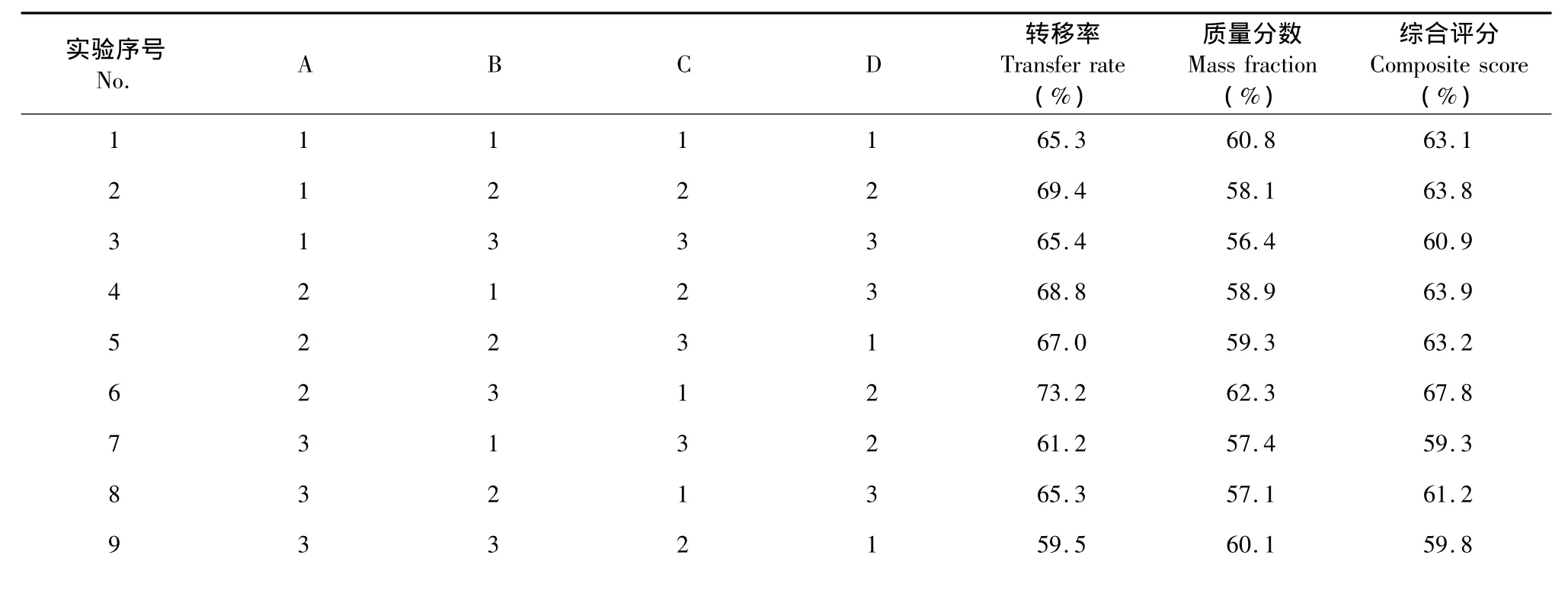
表5 正交实验结果Table 5 Design and results of Orthogonal Design test
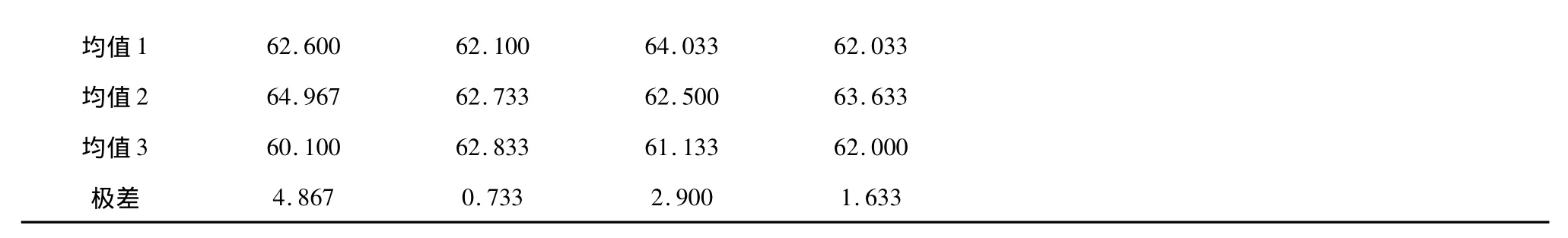
均值1 62.600 62.100 64.033 62.033均值2 64.967 62.733 62.500 63.633均值3 60.100 62.833 61.133 62.000极差4.867 0.733 2.900 1.633

表6 方差分析Table 6 Analysis of variance
按上述最佳工艺进行验证实验,重复三次,结果三次实验总酚转移率的±s为(73.6±1.1)%;质量分数±s为(64.1±1.2)%;综合评分±s为(69.0±0.9)%,结果证明工艺稳定性良好。
3 讨论
目前运用大孔树脂分离纯化总酚比较普遍,但多采用单一树脂或者树脂联用等纯化方式。单一树脂吸附会损失一定的成分,也有着总酚纯度不高的缺点;树脂联用技术工艺相对繁琐。本文通过筛选树脂发现两种型号大孔树脂混合起来使用有着很好的效果,从液相图上看能使各个时间段的峰都能很好的加以保留,而且总酚得率及纯度也都有所提高。在保证质量的同时,提高了效率,但是目前仅对桑叶总酚进行了富集工艺分析,本实验室下一步会逐步采用树脂混用技术,研究中药其它成分的富集的工艺,明确成分的分离原理,阐明成分的富集分离过程。
本文通过对桑叶总酚富集工艺进行研究,确定了HPD400和HPD826两种树脂作为桑叶总酚的纯化树脂,两种树脂的最佳混合比例为1∶1(v/v)。两种树脂虽然极性相近,但都有各自的特征性吸附,HPD826的吸附原理是氢键吸附,能较好的保留一些多酚类及有机酸类成分如桑叶中的绿原酸等;HPD400是中极性的,能较好的吸附一些极性适中的成分如桑叶中的咖啡酸莽草酸和黄酮类成分。两者混合使用可以把两者的吸附特点结合起来,形成互补,达到对桑叶中有效成分的最大保留。
在树脂筛选中,应该以有效成分的富集为目标,筛选适宜的树脂以及混合比例或者联用方式,提升大孔树脂技术在中药成分分离的中的适用性。
1 Yu LY(俞灵莺).Effect of total flavonoids from Mulberry leaf on anti-oxidative of diabetic rats.Mod J Integr Tradit Chin West Med(现代中西医结合杂志),2007,16:5245-5247.
2 Gao M,Huang W,Liu CZ.Separation of scutellarin from crude extracts of Erigeron breviscapus(vant.)Hand.Mazz.by macroporous resins.J Chromatogr B,2007,858:22-26.
3 Miao JW(苗建武),Chen SM(陈绍民),Wang C(王超),et al.Studies on separation and purification of total phenolic acids from Salvia by polyamide resins.Chin J Exp Tradit Med Form(中国实验方剂学杂志),2011,17(3):28-30.
4 Wang J(王俊),Zhao H(赵辉),Wu DA(吴福安).Resin adsorption separation purification of total flavonoids.Ion Exch Adsorp(离子交换与吸附),2008,24:139-147.
5 Chen W(陈伟),Li CY(李存玉),Peng GP(彭国平),et al.Preparation of total phenolic acid in Cimicifuga by macroporous resin combination method.Mod Med Health(现代医药卫生),2012,28:963-965.
6 Tian CX(田晨煦),Xu XP(徐小平),Liao LY(廖丽云),et al.Separation and identification of chlorogenic acid and related impurities by high performance liquid chromatographytandem mass spectrometry.Chin J Chrom(色谱),2007,25:496-500.
7 Yuan XY(袁晓艳),Gao MZ(高明哲),Wang K(王锴),et al.Analysis of chlorogenic acids in Helianthus tuberosus Linn leaves using high performance liquid chromatography-mass spectrometry.Chin J Chrom(色谱),2008,26:335-338.
8 Zhang YC(张语迟),Liu CM(刘春明),Liu ZC(刘志强),et al.HPLC-MS analysis and activity evaluation of flavonoids of Apocynum venetum Leaves before and after hydrolyzed by enzyme.J Instru Anal(分析测试学报),2011,29:1073-1077.
9 Pawlowska AM,Oleszek W,Braca A.Quali-quantitative analyses of flavonoids of Morus nigra L.and Morus alba L.(Moraceae)fruits.J Agric Food Chem,2008,56:3377-3380.
10 Lv H(吕寒),Li WL(李维林),Pei YP(裴咏萍),et al.Detection of flavonoids in Eriobotrya japonica(Thunb.Lindl.)by HPLC-MSn.Res Prac Chin Med(现代中药研究与实践),2009,22(6):56-58.