桑黄抗氧化活性化合物的分离纯化及结构解析
王钦博,杨 焱,冯 娜,艾连中,穆海菠,杭 锋,宋 馨
1乳业生物技术国家重点实验室光明乳业股份有限公司,上海200436;2农业部南方食用菌资源利用重点实验室上海市农业科学院食用菌研究所国家食用菌工程技术研究中心,上海201403
桑黄(Phellinus sp.)俗称桑臣、桑耳、桑黄菇等,主要生长于杨、松、桑、白桦等树的树干上,造成心材白腐,是一种珍贵的传统药用真菌,桑黄隶属担子菌亚门(Basidiomyeotina),层菌纲(Hymenomycetes)、多孔菌目(polyporales)、锈革孔菌科(Hymenochaetacae),针层孔菌属(Phellinus),又分为裂蹄层孔菌(Linteus),鲍氏层孔菌(Baumii),火木层孔菌(Igniarius)、瓦尼木层孔菌(Vaninii),尤地层孔菌(Yucatanensis)等多个种。国内外文献报道的桑黄药理活性已引起国际医药工业界和保健品行业专家的关注,有着相当可观的市场前景。目前对于桑黄药理活性的研究多集中在抑制肿瘤细胞生长和调节免疫能力方面,此外,还有抗菌、抗氧化、降血糖、抗突变、抗纤维化、抗肺炎等作用。
目前对桑黄抗氧化的活性研究主要集中在不同萃取部分[1,2],但少有针对较强抗氧化活性化合物的分离纯化和结构解析的研究报道。本文利用实验室前期得到的抗氧化效果较好的乙酸乙酯萃取相和正丁醇萃取相,针对其中的抗氧化活性化合物进行分离纯化,并对其结构解析。为研究桑黄抗氧化物质的作用原理、构效关系及其活性物质对人体的功效提供了理论基础。
1 材料与试剂
桑黄PB-10(Phellinus baumii)子实体及菌种由上海市农科院食用菌研究所提供,标本存放于上海市农科院食用菌研究所药用真菌研究室。
桑黄(Phellinus Baumii)子实体的乙酸乙酯萃取相和正丁醇萃取相干燥后得到样品;TLC薄层层析板(HSGF254)为烟台汇友硅胶开发有限公司生产;柱层析硅胶(100~200目)为青岛海洋化工厂生产。乙醇、甲醇、丙酮、乙酸乙酯、正丁醇、30%双氧水、氯化亚铜为国药集团化学试剂有限公司分析纯试剂;氘代试剂为美国Cambridge Isotope Laboratorics Inc.产品。0.05%胰蛋白酶、RPMI1640培养基、DMEM培养基、胎牛血清、DMSO(二甲基亚砜)购自GIBCO公司;脂多糖(LPS)、鲁米诺、1,1-二苯基-2-三硝基苯肼(DPPH·)、邻苯三酚、邻菲罗啉、儿茶素[(+)-catechin]购自 Simga公司;MTT(噻唑蓝)购自Biosource公司。PC12来自中国科学院上海生命科学院细胞资源中心。
2 实验方法
2.1 样品的分离纯化
取乙酸乙酯萃取部分进行硅胶(100~200目)层析,氯仿-甲醇(100∶0 ~ 60∶40)梯度洗脱,共收集211个流分。根据薄层层析(TLC)检测结果合并相近的流份,合并为24个组分,分别是:A1(1-9)、A2(10-28)、A3(29-33)、A4(34-37)、A5(38-47)、A6(48-53)、A7(54-57)、A8(58-71)、A9(72-73)、A10(74-75)、A11(76-87)、A12(88-110)、A13(111-117)、A14(118-124)、A15(125-136)、A16(137-142)、A17(143-148)、A18(149-155)、A19(156-162)、A20(163-169)、A21(170-176)、A22(177-183)、A23(184-187)、A24(188-211)。
将A5上Sephadex LH-20柱层析,甲醇洗脱。收集20~36组分再经聚酰胺层析,甲醇-水(30∶70~90∶10)梯度洗脱,其中1~11组分有沉淀析出,用甲醇反复洗涤,得到化合物1。
A6有沉淀析出,甲醇反复洗涤,得到化合物2。
A11有沉淀析出,甲醇反复洗涤,得到化合物3。
将 A12进行聚酰胺层析,甲醇-水(50∶50 ~0∶10)梯度洗脱。其中10~52组分有沉淀析出,用甲醇反复洗涤,得到化合物4。64~81组分也有沉淀析出,用丙酮反复洗涤,得到化合物5。
取正丁醇部分用氯仿-甲醇(7∶3)超声溶解,将其中的沉淀滤出,甲醇洗涤3次,得到的沉淀物质命名为化合物6。
经鉴定化合物5同化合物3为同一化合物,且化合物1和化合物4取得量较少,本文以化合物2、化合物3及化合物6作为抗氧化研究对象。
2.2 清除超氧阴离子实验
对于非酶体系的清除超氧阴离子实验有多种方法可以检测,在本章实验中使用鲁米诺-邻苯三酚-CBS(碳酸钠-碳酸氢钠)体系的化学发光法。在郭蔼光[3]等报道的化学发光方法基础上作适当的修改。将样品及阳性对照均用95%乙醇配制成不同浓度(5、10、20、50、100、200 μg/mL),用 95%乙醇作为空白,以儿茶素做为阳性对照组,在20℃启动发光反应,每0.6 s记录一次发光值,连续记录30 s。超氧阴离子的清除率计算公式如下:

2.3 清除羟基自由基实验
方法参照HongFei Fu[4]的化学发光的方法,并稍作改动。先于96孔板中加入10 μL 1 mmol/L CuCl和10 μL 1 mmol/L 邻菲罗啉。后加入 10 μL用95%乙醇配制的不同浓度的样品及阳性对照(0.05、0.1、0.5、1 、5、10 μg/mL),用 95% 乙醇做为空白对照,以儿茶素做为阳性对照组。在20℃启动发光反应,每0.6 s记录一次发光值,连续记录30 s。羟基清除率公式同超氧阴离子清除率计算公式。
2.4 清除DPPH·自由基实验
根据 Brand-Williams[5]等所述方法,并稍做改动。用70%乙醇将样品及阳性对照配制成不同浓度(5、10、20、50、80 μg/mL)。以 70% 乙醇作为空白,以儿茶素做为阳性对照组。对DPPH·自由基清除率计算如下:

2.5 抑制NO·自由基产生实验
实验方法参照文献[6],并作适当改动。取生长对数期179 μL细胞浓度为5×105的RAW264.7细胞加入96孔板,并加入1 μL不同浓度(2 mg/mL、10 mg/mL、20 mg/mL)样品,1 h后在96孔板中加入20 μL 10 μg/mL LPS,于37 ℃,5%的 CO2培养24 h后,吸取100 μL 上清,并加入 50 μL Griess试剂,混匀后放至25℃ 10 min,并于540 nm下测吸光值,以10 μg/mL LPS 组为阴性对照组。按照文献[7]的方法计算细胞产生NO·含量。
2.6 对PC12神经细胞损伤修复实验
参照胡金霞[8]实验方法,并略作改动。将分离纯化的单体分别用 DMSO溶解并稀释成2、10、20 mg/mL的溶液,取对数生长期的 PC12细胞,用DMEM培养基稀释至2×104个/mL。取190 μL细胞悬液接于96孔板中,然后分别加入10 μL 2.5 mmol H2O2刺激4 h。将全部培养基吸出后加入199 μL新鲜培养基和1 μL不同浓度样品,每个样品重复3孔,于5%CO2,37℃细胞培养箱中培养48 h后,使用MTT方法测定PC12存活率(损伤组表示加入双氧水刺激后不加任何样品,只加入新鲜的培养基)。

2.7 化合物的结构鉴定
对分离纯化获得的抗氧化较强的化合物进行核磁共振和质谱分析。1H NMR谱和13C NMR谱用Varian Inova 500型核磁共振仪(美国Varian公司),以四甲基硅烷(TMS)为内标测定。API-ES用HP.5973N质谱仪(美国HP公司)(以甲醇为溶剂),直接进样测定。
2.8 数据分析
文中各项数据均用标准偏差(SD)表示,并使用SPSS 13.0分析软件统计,将实验样品组与对照组进行比较。
3 结果与分析
3.1 分离化合物清除超氧阴离子实验结果
经过纯化后的化合物3在清除超氧阴离子能力方面有了明显的提高,在高浓度时,乙酸乙酯相和化合物3对超氧阴离子的清除率较为接近,与阳性对照组相比,化合物3在100 μg/mL浓度以上时,对超氧阴离子清除率较高。化合物6也有一定的清除能力,但增加趋势较弱(图1)。实验结果表明,化合物2无清除超氧阴离子能力。

图1 分离化合物清除超氧阴离子实验结果Fig.1 The superoxide scavenging ability of separated compounds and ethyl acetate extracts
3.2 清除羟基自由基实验结果
由图2看出,化合物3清除羟基自由基的作用与原乙酸乙酯相接近,略有提高。与阳性对照组相比,化合物3羟基清除率较低。化合物6也表现了一定的清除羟基自由基作用,但清除效果较乙酸乙酯萃取相低,而化合物2未表现出清除羟基自由基能力。
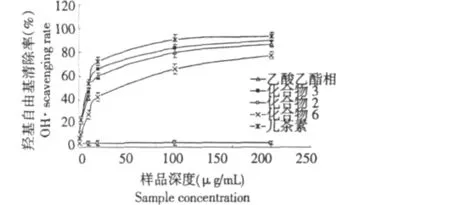
图2 分离化合物清除羟基实验Fig.2 The hydroxyl radical-scavenging activity of separated compounds and ethyl acetate extracts
3.3 清除DPPH·自由基实验结果
清除DPPH·自由基实验结果表明,在20 μg/mL时,化合物3比乙酸乙酯相更有效地清除了DPPH·自由基(图3),与阳性对照组相比,化合物3在50 μg/mL浓度以上时,DPPH·清除率较高。化合物6清除DPPH·的能力相对较弱,化合物2基本无清除能力。当样品浓度高于50 μg/mL时,各样品对DPPH·的清除能力基本达到最高值。

图3 分离化合物清除DPPH·自由基实验Fig.3 The DPPH·scavenging activity of separated compounds and ethyl acetate extracts
3.4 抑制NO·产生实验结果
由于NO脂溶性较强,能够通过细胞膜,因此可以在细胞间起广泛的作用。当NO的含量过高时,NO会与其他自由基发生反应,产生损伤能力更强的亚硝基自由基。NO在体内有三种存在形式—NO·、NO+、NO-,三者能与体内多种化合物起反应,使自由基的链式反应不断增长。因此,有效清除体内过量的NO·自由基也能起到抗氧化作用。
本实验利用巨噬细胞RAW264.7产生NO·自由基作为实验模型,研究了几种分离化合物及乙酸乙酯相对NO·自由基的清除作用(图4),结果表明,乙酸乙酯相和化合物3能很有效地抑制巨噬细胞产生NO·自由基,在高浓度组中,在两者作用下的巨噬细胞产生的NO·自由基量与空白组产生量接近。而化合物6和化合物2在抑制NO·自由基产生上无效果。
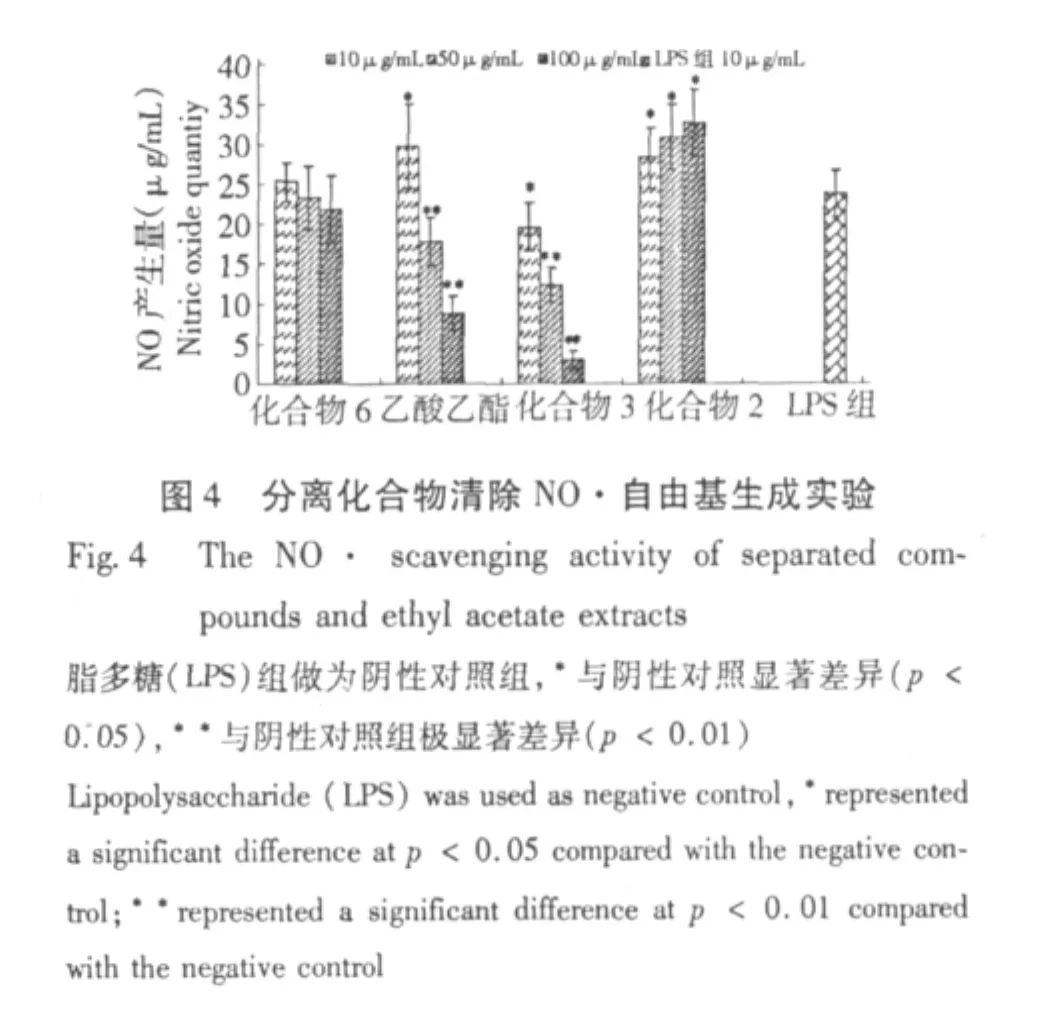

图5 分离化合物修复PC12实验Fig.5 Recovery of damaged PC12 nerve cells with separated compounds and ethyl extracts
3.5 分离纯化样品对神经细胞PC12的损伤修复
从图5中可以看出,乙酸乙酯相及分离的化合物3对损伤PC12细胞均有修复作用,低浓度下,化合物3对损伤PC12的修复作用相对乙酸乙酯相有了一定的提高。化合物6在中高浓度下有一定修复神经细胞的作用。化合物2的修复作用浓度依赖关系不够明显。
3.6 化合物3的结构分析
抗氧化实验表明化合物3具有很好的清除自由基及细胞水平的抗氧化作用,采用核磁共振及质谱分析方法对化合物3进行了结构鉴定,其特征为:黄色无定形粉末,分子式为C25H18O9。
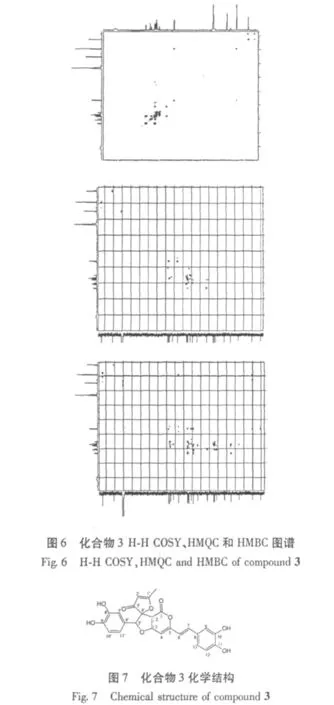
从化合物的正离子API-ES m/z:463.0[M+H]+和NMR谱可推断其分子式为C25H18O9。从1H NMR上质子的化学位移可以判断化合物有一个甲基质子信号δ 1.93(3H,s)、反式双键上的两个质子信号[δ 6.79(1H,d,J=15 Hz),δ 7.32(1H,d,J=14 Hz)]和六个芳香质子信号[7.08(1H,s),7.01(1H,d,J=8.0 Hz),6.78(1H,d,J=8.5 Hz),6.73(1H,d,J=8 Hz),6.67(1H,d,J=1.5 Hz),6.53(1H,t,J=1,8 Hz)]。从耦合常数判断该化合物有两个具有邻位和对位取代的苯环结构和一个反式烯键结构。从13C NMR上的甲基碳信号(δ 16.2)、反式双键的碳信号(115.8、137.5)和芳香碳信号(δ 114.4、145.7、148.2、115.9、121.2、121.1、114.6、144.9、146.3、115.2、118.7)进一步印证了该化合物具有一个甲基、一个反式双键和两个芳香环的结构的推测。此外,从13C NMR上还发现了羰基碳信号(δ 157.3、199.6)。由 H-H COSY、HMQC 和HMBC谱,找到化合物3的各个质子和碳的连接,结合文献报道[10],得出该化合物是一种吡喃酮类的化合物(图7),首次从lnonotus xeranticus的甲醇萃取物中得到该化合物,并命名为Inoscavin A。
4 讨论
自由基的产生和消失在正常的机体状态下总是保持着平衡,当自由基过多就会对机体产生一定的氧化损伤,从而导致细胞衰老、机体产生病变,因而抗氧化活性是天然物质开发重要的评价指标之一。有关环境伤害导致衰老和老年退行性疾病的最新研究多集中在自由基氧化和非酶糖基化的衰老领域中。抗氧化活性物质一方面能够清除自由基的损伤;另一方面,抗氧化活性物质可能通过提高机体内超氧化物歧化酶和谷胱甘肽过氧化物酶活性,抑制脂质过氧化,降低体内丙二醛的生成,从而起到保护和修复机体组织细胞的作用,因而达到延缓衰老的目的[9]。由此可见,修复损伤细胞能力从细胞水平上反映了抗氧化物质的活性。由此可见,修复损伤细胞的能力在细胞水平上为评价抗氧化作用提供了必要的参考。另有研究发现,对于同一种抗氧化活性物质,在不同的抗氧化模型中会出现不一致的作用效果[10],有此,在抗氧化作用的研究中,往往引用多种抗氧化模型进行综合评价。
本文以筛选出的抗氧化能力较强的桑黄(Phellinus baumii)子实体乙酸乙酯萃取相和正丁醇萃取相干燥样品为研究对象,对其进行分离纯化,将纯化后得到的化合物分别进行清除超氧阴离子、羟基、DPPH·及NO·自由基和修复损伤神经细胞的抗氧化实验。实验结果表明了分离得到的化合物3具有较强的清除自由基能力,较乙酸乙酯萃取相的清除能力有所提高;化合物3对损伤的PC12神经细胞也表现出很好的修复能力。对化合物3进行1H NMR、13C NMR、DEPT、1H-1HCOSY、HMQC 等波谱分析并结合相关文献报道[2]数据,鉴定出其化学式为C25H18O9,是一种吡喃酮类的化合物。Jong-Pyung Kim 等[2]首次从 lnonotus xeranticus的甲醇萃取物中得到该化合物,并命名为Inoscavin A,另外,莫顺燕[9]从桑黄(Phellinus igniarius)乙酸乙酯萃取相也分离得到同样的化合物。两位学者对该化合物只进行了清除DPPH·自由基的抗氧化实验。本文首次从桑黄(Phellinus baumii)中分离出Inoscavin A,并着重从清除自由基及细胞水平方面引用多种抗氧化模型综合评价该化合物的抗氧化能力,对该化合物的抗氧化作用做了更深入地研究。
本次实验针对桑黄子实体(Phellinus baumii)抗氧化能力强的化合物进行了分离纯化和结构解析,该活性化合物的发现和鉴定为认识桑黄抗氧化物质的作用原理及其构效关系奠定了基础。有关体内抗氧化实验及其他临床、毒理实验尚未进行,在今后的实验中还需对该活性化合物进行相关验证,为天然抗氧化物质的开发应用提供更多的理论支持。
1 Mo SY(莫顺燕).Studies on chemical constitutes of Phellinus igniarius.Beijing:Beijing Union Medical College(北京:中国协和医科大学),MSc.2003.
2 Jong PK,Bong SY,Young KS,et al.lnoscavin A,a new free radical scavenger from the mushroom inonotus xeranticus.Tetra Letter,1999,40:6643-6644.
3 Guo AG,Wang ZY.Antioxidation of pyrogallol-chemiluminescence assay for superoxide dismutase activity.Plant Physiol Comm,1989,3:54-57.
4 Fu HF,Xie BJ,Fan G,et al.Effect of esterification with fatty acid of β-cryptoxanthin on its thermal stability and antioxidant activity by chemiluminescence method.Food Chem,2010,122:602-609.
5 Brand-Williams W,Cuvelier ME,Berset C.Use of free radical method to evaluate antioxidant activity.LWT-Food Sci Tech,1995,28:25-30.
6 Shang XF(尚小飞).Antinociceptive and anti-inflammatory activities and mechanisms of Iridoid Glycosides extract of Lamiophlomis Rotata(Benth.)Kudo.Gan Su:Lan Zhou U-niversity(兰州大学),MSc.2010.
7 Lin HY,Juan SH,Shen SC,et al.Inhibition of lipopolysaccharide-induced nitric oxide production by flavonoids in RAW264.7 macrophages involves heme oxygenase.Biochem Pharmacol,2003,66:1821-1832.
8 Hu JX(胡金霞),Yang Y(杨焱),Liu YF(刘艳芳),et al.The antioxidant activity of ethanol extracts from Phellinus baumii and their protective effects against oxidative damage of nerve cells.Acta Agricul Shanghai(上海农业学报),2009,25(2):58-61.
9 Chen JX(陈瑾歆),Chen JY(陈建业).The research on the relationship between free radical and ageing.J North Sichuan Med Coll(川北医学院学报),2004,19:207-209.
10 Etsuo N.Assessment of antioxidant capacity in vitro and in vivo.Free Radical Biol Med,2010,49:503-515.