天门冬多糖对环磷酰胺诱导的免疫抑制小鼠的免疫调节作用
佟春玉,孙越春,秦学功,葛文忠,崔玉东
黑龙江八一农垦大学生命科学技术学院,大庆 163319
天门冬,百合科植物。又名天冬。性寒,味甘,微苦。作为一种传统的中药,具有养阴清热,润肺滋肾的功效。用于治阴虚发热、咳嗽吐血、肺痈、咽喉肿痛、消渴、便秘等病症[1]。多糖作为一种免疫调节和促进剂,对巨噬细胞、T淋巴细胞、B淋巴细胞、自然杀伤细胞(NK)和淋巴因子激活的杀伤细胞(LAK)的功能都有调节作用。天门冬多糖(Asparagus cochinchinensis polysaccharide,ASP)是从中药天门冬中提取的生物活性成分,据报道具有清除自由基及抗脂质过氧化活性。近年来,研究人员发现ASP可以刺激猪和小鼠的体外T、B淋巴细胞增殖,但其在体内的实验却未见报道[2,3]。因此,本研究采用环磷酰胺诱导的免疫抑制小鼠模型,研究ASP对免疫抑制小鼠的保护作用,为未来ASP的临床应用提供一定的实验依据。
1 材料与方法
1.1 实验动物
健康Balb/c小鼠,SPF级,雄性,6~8周龄,体重(20±2)g,购于吉林大学基础医学院实验动物中心,合格证号:SCXK(吉2003-0001)。
1.2 实验试剂
ASP购自西安斯诺特生物技术有限公司,刀豆蛋白A(Con A IV型)、脂多糖(LPS)、环磷酰胺(CTX)均为Sigma产品;细胞因子试剂盒购于美国Biolegend公司,RPMI-1640完全培养基(含100 IU/mL青霉素、100 g/L链霉素、1%谷氨酰胺和10%灭活新生胎牛血清,pH 7.2)为Gibco产品;胎牛血清、DMSO、生理盐水均是国产产品。
1.3 方法
1.3.1 动物分组及给药
小鼠50只,雌雄各半,随机分成5组,对照组(生理盐水),模型组,天门冬多糖高、中、低剂量组,连续给药7 d,给药第3 d,除对照组外,其他各组小鼠均腹腔注射CTX 50 mg/kg,连续3 d,建立免疫抑制小鼠模型。
1.3.2 脏器指数测定
7d后,称重,颈椎脱臼处死小鼠,分离胸腺和脾脏称湿重,以小鼠胸腺或脾脏重/体重(mg/g)作为胸腺指数或脾脏指数。
1.3.3 免疫抑制小鼠脾淋巴细胞增殖反应测定
无菌条件下制备Balb/c小鼠脾细胞悬液加入到96孔板中,每孔100 μL,调整脾细胞浓度为5×106个细胞/mL,此后,加入 Con A(终浓度 5 μg/mL)或 LPS(终浓度 20 μg/mL)100 μL,使终体积为200 μL并各设三个复孔。96孔板置于37℃,5%CO2细胞培养箱中培养44 h后,每孔加入20 μL的MTT(5 mg/mL)再继续培养4 h。4 h后移除培养液,每孔加入150 μL DMSO震摇10 min,在570 nm测量吸光值。
1.3.4 免疫抑制小鼠血清细胞因子含量的检测
小鼠第7 d给药后摘除眼球取血并分离血清,采用双抗体夹心ELISA法测定血清IL-2和IL-4含量,参考试剂盒使用说明书步骤操作,于450 nm波长处检测吸光度,根据浓度标准曲线计算IL-2和IL-4含量。
1.3.5 统计分析
所有数据均用SPSS 13.0统计软件包进行处理,数据以均数±标准差(Mean±SD)表示,资料进行正态性检验;多组计量资料采用one-way ANOVA,方差齐时采用LSD法,方差不齐时采用Dunnett's T3法。P<0.05有统计学意义。
2 实验结果
2.1 ASP对免疫抑制小鼠胸腺指数和脾脏指数的影响
ASP对脾脏指数的影响如表1所示,与空白组相比,CTX组的胸腺指数和脾脏指数显著降低,而ASP各剂量组的胸腺指数脾脏指数明显升高(P<0.01),说明ASP在一定的剂量范围内可以缓解CTX对小鼠的免疫抑制作用。
表1 ASP对CTX引起的免疫低下小鼠胸腺指数和脾脏指数的影响(±s)Table 1 Effects of ASP on thymus and spleen index in immunosuppressed mice(±s)

表1 ASP对CTX引起的免疫低下小鼠胸腺指数和脾脏指数的影响(±s)Table 1 Effects of ASP on thymus and spleen index in immunosuppressed mice(±s)
注:与对照组相比,##P<0.01;与CTX组相比,**P<0.01。Note:##P<0.01vs.Control group;**P<0.01 vs.CTX group.
组别Group浓度Concentration(mg/kg)胸腺指数Thymus index(mg/g)脾脏指数Spleen index(mg/g)空白组Control Group - 2.57±0.09 5.19±0.06 CTX组CTX Group CTX(50) 1.35±0.07## 3.08±0.19##实验组 Experimental Group 10+CTX(50) 1.73±0.11** 4.20±0.18**20+CTX(50) 2.16±0.09** 4.53±0.10**40+CTX(50) 2.53±0.08** 4.84±0.12**
2.2 ASP对免疫抑制小鼠脾淋巴细胞增殖的影响
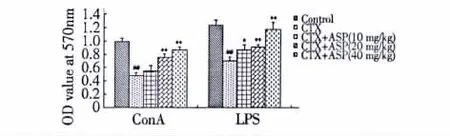
图1 ASP对脾淋巴细胞体内增殖的影响Fig.1 Effect of ASP on splenocyte proliferation in vivo
ASP对小鼠脾淋巴细胞增殖的影响如图1所示。ConA或LPS刺激脾淋巴细胞会引起细胞增殖,而50 mg/kg的CTX能有效地抑制ConA或LPS刺激脾淋巴细胞增殖反应(P<0.01)。与此相反,ASP加上CTX可以有效地缓解CTX对脾细胞增殖反应的抑制作用,并呈剂量依赖的方式。
2.3 ASP对免疫抑制小鼠血清细胞因子IL-2和IL-4的影响
ASP对免疫抑制小鼠血清中主要细胞因子水平的影响如图2所示,我们使用ELISA方法检测小鼠血清中的IL-2和IL-4的细胞因子水平。从图中可以看出,CTX组血清中的细胞因子IL-2和IL-4比对照组显著降低(P<0.01);与CTX组相比,当ASP组剂量为20 mg/kg或40 mg/kg时,免疫抑制小鼠血清中的IL-2和IL-4的水平都显著提高(P<0.01)。

图2 ASP对免疫抑制小鼠血清中IL-2和IL-4分泌水平的影响Fig.2 Effect of ASP on serum IL-2 and IL-4 of immunosuppressed mice
3 讨论
环磷酰胺为氮芥与磷酰胺基结合而成的化合物,是临床常用的烷化剂类免疫抑制剂。可用于治疗各种自身免疫性疾病,即能抑制细胞增殖,非特异性杀伤抗原敏感性小淋巴细胞,限制其转化为免疫母细胞[4]。本文采用CTX所致免疫低下小鼠模型,研究ASP对免疫抑制小鼠免疫功能的影响,探讨ASP的免疫药理效应,摸索其最佳剂量范围。
众所周知,细胞有丝分裂原ConA可以刺激T淋巴细胞增殖,LPS可以刺激B淋巴细胞增殖,T淋巴细胞主要参与机体的细胞免疫反应,B淋巴细胞主要参与体液免疫反应[5-7]。在体内细胞增殖实验中,采用MTT法测定ASP对LPS和ConA诱导的淋巴细胞增殖的影响。结果显示ASP可以缓解CTX组对小鼠脾细胞体内增殖反应的抑制作用,因此说明ASP通过细胞免疫和体液免疫两种方式参与机体免疫反应,并呈现一定的剂量依赖模式。
细胞因子能介导和调节免疫应答,检测细胞因子分泌水平可以密切反映机体的免疫状态。IL-2主要由TH1细胞分泌,参与细胞免疫反应;IL-4主要由TH2细胞分泌,参与体液免疫反应[8-10]。本研究中,在CTX诱导小鼠免疫功能抑制的基础上,给予ASP,可显著增加小鼠血清中IL-2、IL-4含量。表明ASP对CTX诱导的免疫抑制小鼠的免疫功能具有一定的免疫调节作用,能提高小鼠的免疫防御功能。
综上可见,ASP可以消除CTX诱导的小鼠免疫抑制作用,对临床具有一定的应用价值,未来需对ASP免疫增强机制进一步研究,为其临床应用提供科学依据。
1 Li ZX(李志孝),Huang CG(黄成钢),Cai YJ(蔡育军),et al.The chemical structure and antioxidative activity of polysaccharide from Asparagus cochinchinensis.Acta Pharm Sin(药学学报),2000,35:358-362.
2 Pan GZ(潘贵珍),Hu TJ(胡庭俊),Su ZJ(苏子杰),et al.Effect of Asparagus cochinchinensis polysaccharide on proliferation of swine splenic lymphocytes in vitro.J Feed Ind(饲料工业),2012,33:35-37.
3 Kang L(康乐),Yao DB(姚东璧),Hu TJ(胡庭俊),et al.The effect of Asparagus cochinchinensis polysaccharide on proliferation of splenic lymphocytes from mice in vitro.Chin J Anim Hus Vet Med(中国畜牧兽医),2010,37:15-17.
4 Huang XH,Hu YH,Zhao X,et al.Sulfated modi?cation can enhance the adjuvant activity of Astragalus polysaccharide for ND vaccine.Carbohyd Polym,2009,73:303-308.
5 Li R,Chen WC,Wang WP,et al.Extraction,characterization of Astragalus polysaccharides and its immune modulating activities in rats with gastric cancer.Carbohyd Polym,2009,78:738-742.
6 Lu J,Guan S,Shen X,et al.Immunosuppressive activity of 8-gingerol on immune responses in mice.Molecules,2011,16:2636-2645.
7 Contreras OM,Soldevila G,Lopez GP,et al.Role of CRTAM during mouse early T lymphocytes development.Dev Com Immunol,2010,34:196-202.
8 Shao P,Zhao LH,Zhi C,et al.Regulation on maturation and function of dendritic cells by Astragalus mongholicus polysaccharides.Int Immunopharmacol,2006,6:1161-1166.
9 Chu Y,Yan X,Li X,et al.Effect of Chinese herbalmedicinal ingredients on IL-2 mRNA levels of T lymphocytes in mice measured using semiquantification RT-PCR.Agric Sci China,2006,5:873-878.
10 Mitsias DI,Tzioufas AG,Veiopoulou C,et al.The Th1/Th2 cytokine balance changes with the progress of the immunopathological lesion of Sjogren’s syndrome.Clin Exp Immunol,2002,128:562-568.

