缬草与蜘蛛香挥发油的抗菌抗氧化活性研究
赵 兵,郝 萍,高 昂,巩 江,陈千良,倪士峰*
1西北大学 生命科学学院,西安 710069;2陕西师范大学生命科学学院,西安 710062;3西藏民族学院 医学系,咸阳 712082
近年来,由于各种抗生素的滥用,导致临床上细菌与真菌抗药性问题日益严重。随着人类生活水平不断提高,各种富贵疾病发病率急剧增高,国外相关研究发现糖尿病、高血脂及心脑血管类疾病与自由基所导致的生物大分子(如脂质、DNA以及蛋白质)的抗氧化损伤有关[1],因此寻找天然的抗菌抗氧化剂就显得尤为重要。挥发油中含多种活性成分,协同作用,可有效地避免耐药及抗药性,是发挥中草药的治病优势的重要化合物群。
缬草(Valeriana officinalis L.)和蜘蛛香(V.jatamansi Jones.)均为败酱科缬草属(Valeriana Linn.)植物,作为常用的中草药,其应用较为广泛,研究前景好。两者药用部位均为干燥的根及根茎,具有镇静催眠、安神、解痉、镇痛及抗菌等功效[2,3]。研究发现,两种药材均含有挥发油、环烯醚萜类及黄酮类等多种活性成分[4,5]。缬草与蜘蛛香为缬草属植物中具有重要药用价值的资源植物及芳香植物,其含有的挥发油作为天然香料可应用于食品与香烟中。文献报道中对两者的挥发油成分研究较多,对于其体外抗菌及抗氧化等药理活性研究有限,仅有少量文献对缬草挥发油的抑菌作用进行报道。根据文献资料,鉴于两者在化学成分和药理活性方面的相似性[2-5],本实验对两者挥发油的抗菌抗氧化效果进行比较分析,为进一步扩大该属植物的利用价值奠定了基础。
1 仪器与材料
1.1 实验仪器
SW-CJ-1F型无菌操作台(苏净集团苏州安泰空气技术有限公司);LDZX-50KBS型立式蒸汽灭菌锅(上海申安医疗器械厂);MH-2000型电热套(北京科伟永兴仪器有限公司);1000 μL、100 μL 移液器(日本立洋);KW-1型恒温培养箱(银川市金属制品厂);UV-2550紫外可见分光光度计(日本津岛公司)。
1.2 药材及菌株
缬草于2011年6月采自陕西省西安市长安县鸡窝子村,蜘蛛香于2011年10月购自河北安国药材市场,经西北大学倪士峰老师分别鉴定为缬草(Valeriana officinalis L.)的干燥全草及蜘蛛香(Valeriana jatamansi Jones.)的干燥根茎。
大肠杆菌(Escherichia coli)、金黄色葡萄球菌(Staphyloccocus aureus)、枯草芽孢杆菌(Bacillus subtilis);黑曲霉(Aspergullus niiger)、黑根霉(Rhizopus nigricans)、桔青霉(Penicillium citrinum),各供试菌种均由西北大学微生物实验室提供。
1.3 试剂及药品
Mueller-Hinton肉汤(MHB)(中国检验检疫科学研究院);琼脂(青岛水产品加工厂);葡萄糖(天津市天力化学试剂有限公司);1,1-二苯基-2-三硝基苯肼(DPPH,北京奥康科鼎盛生物科技有限公司);2,6-二叔丁基对甲基苯酚(BHT,天津市福晨化学试剂厂);乙醇(天津市富宇精细化工有限公司),均为分析纯。庆大霉素颗粒(云南省玉溪望子隆生物制药有限公司)。
2 实验方法
2.1 挥发油的提取制备
称取缬草及蜘蛛香药材根茎粉末各200 g,分别置于2000 mL圆底烧瓶中,加入1200 mL的蒸馏水浸泡过夜,提取方法参照《中国药典》一部附录中的水蒸气蒸馏法[6],将提取到的挥发油用少量乙醚多次萃取,再加入适量无水硫酸钠进行脱水处理,挥去乙醚后得黄色透明油状物,低温避光保存。
2.2 培养基的制备
细菌培养基的制备:25 g肉汤培养基粉末加入1000 mL蒸馏水,加热至完全溶解,再加入15 g琼脂粉,搅拌均匀使其完全溶解。在三支试管中各加入10 mL的培养基,其余则分装至三个1000 mL锥形瓶中,在103.43 kPa,121℃下高压灭菌20 min。将三支装有肉汤培养基的试管倾斜放置,制成斜面[7]。剩余培养基倒成平板,备用。
马铃薯葡萄糖琼脂(PDA)真菌培养基的制备:称取干净去皮的土豆丁200 g,加入1000 mL水,煎煮30 min,过滤,收集滤液。称取20 g葡萄糖和18 g琼脂加入上述滤液中,加热使其完全溶解,再将体积定容至1000 mL。在三支试管中各加入10 mL培养基,其余则分装至三个1000 mL锥形瓶中,在103.43 kPa,121℃下高压灭菌20 min,取出,将三支装有PDA培养基的试管倾斜放置,制成斜面,放置待水分挥发及凝固[8]。
2.3 菌悬液的制备
将受试菌在斜面培养基上活化2~3代,用接种环从斜面上刮取菌苔两环,分别收集到含100 mL无菌水的250 mL的锥形瓶中,采用平板菌落计数法将受试菌配成终浓度为1×108个/mL的菌悬液,备用。
2.4 抑菌作用的测定
采用纸片扩散法及试管连续稀释法,测定药材挥发油的抑菌圈(Inhibition zone)大小及最小抑菌浓度(Minimal inhibitory concentration,MIC),以判断其抑菌效果。
2.4.1 纸片扩散法
将若干6 mm滤纸片高温灭菌备用。用无水乙醇将挥发油分别稀释成90、50、10 mg/mL的挥发油乙醇溶液。取浓度1×108个/mL的菌悬液0.1 mL将其均匀涂布于各培养基平板表面,将滤纸片分别吸取不同浓度挥发油乙醇溶液(每片吸取10 μL)后,贴于平板表面。用无水乙醇及0.1 mg/mL庆大霉素溶液作为阴性对照和阳性对照,每板3片,每个菌种平行两组。细菌放置于37℃的恒温箱培养中培养24 h,真菌于28℃培养72 h,观察并测量抑菌圈直径,取平均值。运用SPSS软件t检验方法进行统计分析。
2.4.2 试管连续稀释法测定MIC
取8支无菌试管依次编号1~8。在8支无菌试管中分别加入1 mL液体培养基,再加入10 μL吐温-80,1号试管中加入0.1 mg/mL的阳性对照溶液5 μL;2号管再加入1 mL液体培养基和20 mg挥发油样品,混匀,初始浓度为10 mg/mL,然后吸取1 mL混悬液加入第3管,混匀,依次进行二倍稀释至第7管,混匀后去掉1 mL;8号管为阴性对照组,不做任何处理。然后向每管中加入菌悬液0.1 mL,混匀。每个浓度平行3组,细菌于37℃的恒温箱培养中培养24 h,霉菌28℃培养72 h。取出,观察并记录。
2.5 抗氧化作用的测定
抗氧化实验,参考Kim等[9]的方法测定挥发油对DPPH自由基的清除作用,并稍作修改。用95%乙醇将挥发油配制成0.5、0.8、1.2、1.6 mg/mL的样品溶液,将 400 μL上述样品溶液加入 2 mL 0.004%DPPH液中,室温放置10 min,在最大吸收波长517 nm处测其吸光度(A1),以不加提取液的DPPH为空白对照(A0),以BHT乙醇溶液为阳性对照,各实验组平行3组,取平均值。根据公式:清除率=(1-A1/A0)×100%,计算各浓度药液对DPPH自由基的清除率。式中,A1为加药液后DPPH溶液的吸光度;A0为未加药液时DPPH溶液的吸光度。
3 结果与讨论
3.1 抑菌圈测定结果
缬草和蜘蛛香挥发油对供试菌株的抑菌效果与样品浓度呈量效关系,随着样品浓度的增加抑菌效果增强(表1)。缬草挥发油的抑菌效果为:金黄色葡萄球菌>大肠杆菌>枯草芽孢杆菌>根霉>青霉>黑曲霉,其中对黑曲霉,根霉和青霉三种真菌的抑制效果较小。蜘蛛香挥发油的抑菌效果为:金黄色葡萄球菌>枯草芽孢杆菌>大肠杆菌>根霉>青霉>黑曲霉,对各菌株均有一定抑制作用。结果分析表明,缬草与蜘蛛香挥发油均具有一定的抑菌作用,效果显著(P<0.01),其中蜘蛛香挥发油对细菌和真菌的抑菌效果均优于缬草挥发油,而缬草挥发油抗细菌效果强于真菌。
表1 样品挥发油对各供试菌株的抑菌圈直径(±s,n=6)Table 1 Diameters of inhibition zone of essential oil samples against different strains(±s,n=6)

表1 样品挥发油对各供试菌株的抑菌圈直径(±s,n=6)Table 1 Diameters of inhibition zone of essential oil samples against different strains(±s,n=6)
注:抑菌圈直径大于6 mm表示有抑菌作用,小于或等于均为无抑菌作用;*表示与阴性对照组比较,t检验P<0.01。Note:The diameter of inhibition zone greater than 6 mm means having antimicrobial effect,less than or equal to 6 mm means no inhibitory effect;*compare with negative control,P <0.01.
菌种Strains挥发油Essential oils抑菌圈直径Diameter(mm)浓度Concentration(mg/mL)90 50 10庆大霉素Gentamicin(0.1 mg/mL)无水乙醇Anhydrous ethanol大肠杆菌 E.coli 缬草 V.officinalis L. 11.67±0.58* 9.33±0.29* 7.73±0.05* 9.00±0.00* 6.00±0.00蜘蛛香 V.jatamansi Jones. 12.17 ±0.15* 9.36 ±0.15* 8.66 ±0.15*金黄色葡萄球菌 S.aureus 缬草 V.officinalis L. 13.80 ±0.20* 11.95 ±0.07* 11.40 ±0.36* 17.30 ±0.34* 6.00 ±0.00蜘蛛香 V.jatamansi Jones. 12.80 ±0.10* 11.30 ±0.10* 9.23 ±0.20*枯草芽孢杆菌 B.subtilis 缬草 V.officinalis L. 9.60 ±0.14* 8.63 ±0.55* 7.96 ±0.35* 16.00 ±1.00* 6.00 ±0.00蜘蛛香 V.jatamansi Jones. 12.33 ±0.89* 9.77 ±0.15* 8.87 ±0.15*黑曲霉niiger 缬草 V.officinalis L. 7.05±0.07* 6.40±0.10* 6.00±0.00 11.23±0.25* 6.00±0.00蜘蛛香 V.jatamansi Jones. 7.10 ±0.10* 6.63 ±0.20* 6.37 ±0.15*黑根霉 Rhizopus nigricans 缬草 V.officinalis L. 9.06 ±0.15* 6.67 ±0.15* 6.00 ±0.00 9.33 ±0.57* 6.00 ±0.00蜘蛛香 V.jatamansi Jones. 7.43 ±0.15* 7.07 ±0.15* 6.40 ±0.10*桔青霉 Penicillium citrinum 缬草 V.officinalis L. 7.17 ±0.15* 6.60 ±0.14* 6.00 ±0.00 6.66 ±0.57* 6.00 ±0.00蜘蛛香V.jatamansi Jones. 7.23±0.15* 6.50±0.20*6.00±0.00
3.2 最小抑菌浓度(MIC)测定结果
由表1分析可知,缬草和蜘蛛香挥发油的抑菌效果具有量效关系,随着浓度的增加而增加。进一步对最小的样品浓度进行梯度稀释,探索挥发油的最小抑菌浓度(表2)。样品挥发油的初始浓度为50 mg/mL,缬草挥发油对大肠杆菌的MIC为6.25 mg/mL,金黄色葡萄球菌为3.125 mg/mL,枯草芽孢杆菌为12.5 mg/mL,对黑曲霉、根霉、青霉三种真菌最低抑菌浓度均大于25 mg/mL。蜘蛛香挥发油对大肠杆菌的最小抑菌浓度为12.5 mg/mL,对金黄色葡萄球菌和枯草芽孢杆菌MIC均为6.25 mg/mL,对三种真菌的MIC均为25 mg/mL。挥发油呈油状液体,在称量时很难准确量取其体积,用移液器等测量其体积,会严重影响称量的准确性,因此,挥发油初始浓度的计算忽略了样品挥发油自身体积对挥发油乙醇溶液浓度的影响。
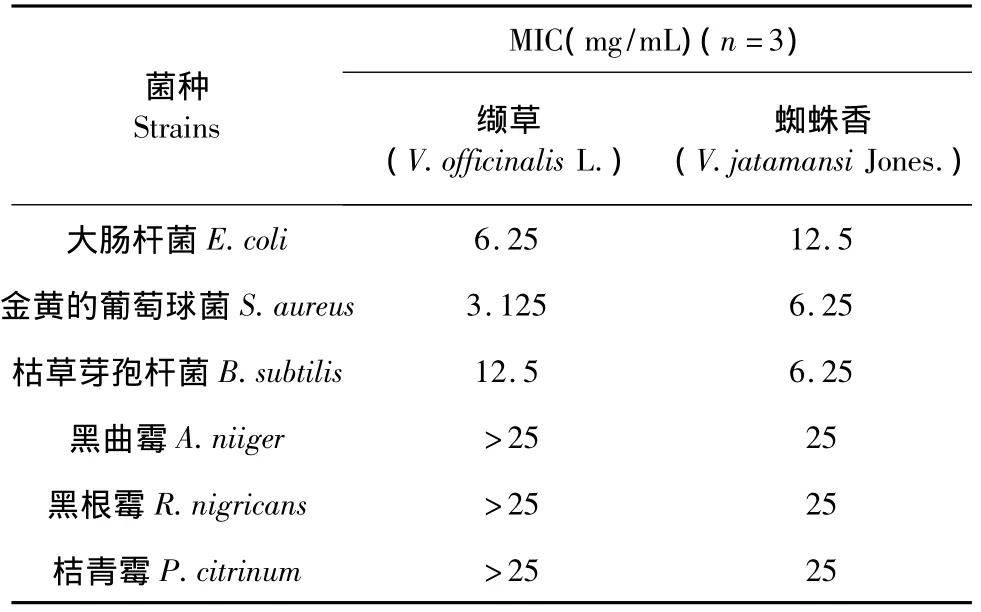
表2 样品挥发油对各供试菌种的最小抑菌浓度Table 2 MICs of essential oil samples against different strains
3.3 对DPPH自由基的清除作用结果

图1 样品对DPPH自由基的清除率Fig.1 DPPH free radical scavenging rate of essential oil samples and BHT
通过对自由基的清除作用衡量样品体外抗氧化活性的大小,清除率越大,则抗氧化活性越强。BHT作为食品加工常用的抗氧化剂,其抗氧化效果明显,因此,本实验采用其作为抗氧化活性的阳性对照。不同浓度的缬草、蜘蛛香及阳性对照BHT的清除DPPH自由基的作用效果见上图。结果表明:缬草和蜘蛛香挥发油均具有清除DPPH自由基的能力,且其清除率均大于阳性对照BHT。自由基清除率与样品浓度成正比,当浓度为1.6 mg/mL时,蜘蛛香挥发油的清除率达71.75%,缬草挥发油的清除率达65.35%,随着浓度增加,其清除率仍然有剂量依赖性,但是渐趋于稳定。
4 结论
本研究表明:缬草与蜘蛛香挥发油对供试菌种均具有不同程度的抑制作用,其中蜘蛛香挥发油对细菌和真菌的抑制作用比较明显,而缬草挥发油对不同菌株也具有一定的抑制作用。与杨杰等[10]文献报道的缬草挥发油对根霉和黑曲霉基本上没抑制效果、对青霉有一定的抑制作用的研究结果有差异,可能与实验采用的条件及方法不同有关。通过对两种挥发油清除DPPH自由基的效果可知,二者均具一定的抗氧化效果,且蜘蛛香挥发油强于缬草挥发油。本实验结果可为今后缬草和蜘蛛香挥发油相关活性的开发利用提供有效借鉴和科学依据。
1 Mates JM,Sanchez-Jimenez FM.Role of reactive oxygen species in apoptosis:implication for cancer therapy.Int J Biochem Cell Biol,2000,2:157-170.
2 Zhang ZX(张振学),Yao XS(姚新生).The advance of chemical study on the medicinal plant Valeriana officinalis L.Chin J Med Chem(中国药物化学杂志),2000,3:226-229.
3 Xu H(徐红),Yuan HN(袁惠南),Pan LH(潘丽华),et al.The pharmacological effects of volatile oil from valeriana on central nervous system.Chin J Pharm Anal(药物分析杂志),1997,6:399-400.
4 Pei QY(裴秋燕),Li X(李璇),Zhu JX(朱军旋),et al.Advances in study on pharmacological action and mechanism of Valeriana Wallichii DC.Chin Arch Tradit Chin Med(中华中医药学刊),2010,9:1864-1865.
5 Chen L(陈磊),Zheng QM(郑清明),Zheng HC(郑汗臣),et al.Advances in study on Valeriana wallichii DC.Chin Wild Plant Res(中国野生植物资源),2002,1:8-11.
6 Chinese Pharmacopoeia Commission(国家药典委员会).Pharmacopoeia of the People’s Republic of China(中华人民共和国药典).Beijing:China Medical Science Press,2010.
7 Xie XF,Cai XQ,Zhu SY,et al.Chemical composition and antimicrobial activity of essential oils of Chaenomeles speciosa from China.Food Chem,2007,4:1312-1315.
8 Liu YM(刘玉民),Liu YM(刘亚敏),Li PX(李鹏霞).Study on antimicrobial activities of essential oil from leaves of Liquidambar formosana Hance as well as its antioxidant activity.Food Sci(食品科学),2009,11:234-137.
9 Kim D,Lee KW,Lee HJ,et al.Vitamin C equivalent antioxidant capacity(VCEAC)of phenolic phytochemicals.J Agric Food Chem,2002,13:3713-3717.
10 Yang J(杨杰),Li ZH(李忠海),Huang L(黄凌),et al.Antimicrobial activity of the volatile oil from Valeriana officinalis L..Lishizhen Med Mater Med Res(时珍国医国药),2009,7:1651-1652.

