HPLC法检测苦杏仁苷及其酶解产物
常 军
江西科技师范大学生命科学学院,南昌 330013
苦杏仁苷(Amygdalin),属苯乙醇腈的β-龙胆二糖苷,是苦杏仁中的主要有效成分之一,其结构见图1。苦杏仁苷广泛存在于杏、桃、李等多种蔷薇科植物果实的种子中[1],具有良好的抗肿瘤[2]、抗氧化作用[3]、调节免疫功能的作用[4]及镇咳平喘的作用[5]。目前对苦杏仁苷的研究主要集中在分离纯化[6]、含量检测[7]及代谢[8]及抗肿瘤药理[9]研究。本课题组在苦杏仁苷在催化转化研究中发现,苦杏仁苷在黑曲酶胞外全酶制剂的催化下,4 h内全部降解,生成4个产物,分别为杏仁腈、野樱苷、苯甲醛及一个新的化合物phenyl-(3,4,5-trihydroxy-6-methyl-tetrahydro-pyran-2-yloxy)-acetonitrile(PTMT),是野樱花苷的6位羟基取代衍生物。苦杏仁苷及其降解产物的结构如图1。本文建立了一个快速、准确的HPLC同时检测苦杏仁苷及其4个产物的方法。

图1 苦杏仁苷及其酶解产物结构图Fig.1 Chemical structures of amygdalin and its meabolites
1 材料与方法
1.1 材料
催化降解用苦杏仁苷从苦杏仁中分离纯化得到,纯度达到85%;苦杏仁苷、杏仁腈、苯由酸、野樱苷标准品均购自sigma公司,纯度98%以上;PTMT从苦杏仁苷的酶解产物中分离、纯化得到,纯度98%[10]。甲醇(Fisher)为色谱纯试剂,其它的均为分析纯试剂。
1.2 标准溶液的制备
精密称取苦杏仁苷、杏仁腈、苯由酸、野樱苷及PTMT各20 mg溶于10 mL去色谱纯甲醇中、定容得到浓度为2 mg/mL的标准溶液母液。制作标准曲线时,取25、125、250、500、750、1000 μL 母液于5 mL容量瓶中定容得到浓度分别为0.01、0.05、0.1、0.2、0.4、0.6、0.8 及 1 mg/mL 的各标准品测试溶液,4℃冰箱中贮藏备用。
1.3 HPLC检测方法
安捷伦液相色谱系统,迪马C18ODS柱(250 mm × 4.6 mm,5 μm),柱温箱控制在25℃,流动相30%甲醇溶液,流速1 mL/min,检测波长210 nm,进样量 10 μL。
1.4 线性关系
应用“1.3”中 HPLC 方法分析 0.01、0.0、0.1、0.2、0.4、0.6、0.8、1 mg/mL 的各标准品,以质量(μg)为横坐标(X),以峰面积为纵坐标(Y)进行线性回归,得到回归方程。
1.5 不同温度条件下稳定性的测定
分别取浓度为0.2 mg/mL的各标准溶液5 mL置于10 mL试管中,分别置于30、40、50保温12 h,每2 h取样一次进行分析。
1.6 不同pH条件下稳定性的测定
取5支10 mL试管,各装去离子水5 mL,并用1 mol/L 的 HCl调节 pH 值为 3.0、4.0、5.0、6.0、7.0,用移液管吸取1 mL 0.2 mg/mL各标准溶液,移入上述各试管中,25℃保温12 h,每2 h取样一次进行分析。
1.7 精密度和准确度测定
取浓度 0.1、0.4、0.8 mg/mL 的样品各2 mL,分别于同一天和隔天的采用“1.3”的HPLC方法进行检测含量,每个样品重复6次,分别计算天内和隔天的RSD和RE值。
1.8 回收率测定
黑曲霉总酶制备将黑曲霉斜面菌种接入4 L培养基(8 g/L葡萄糖,5 g/L蛋白胨,5 g/L酵母膏,5 g/L KH2PO4,5 g/L NaCl,1 g/L MgSO4·7H2O,1 g/L MnSO4·4H2O,pH 6.5)中,28℃培养5 d。发酵液用饱和(NH4)2SO4沉淀12 h后,再在4℃条件下盐析12 h,随后冷冻干燥得黑曲霉总酶。
82 U/mL的总酶溶液配制 称取黑曲霉总酶冻干粉40.3 mg,溶于10 mL水溶液中得酶溶液,得82 U/mL的黑曲霉总酶溶液。
用移液器准确移取准确移取5 mL上述黑曲霉总酶溶液,加入2 mL 1 mol/L的Na2CO3溶液钝化酶,0.1、0.5、1 mL浓度为l mg/mL各标准溶液到1 mL上述钝化酶溶液,按照“1.3”中的方法检测各成分含量,每个样品重复3次。
2 结果与讨论
2.1 HPLC分析方法
从图2中可看出,苦杏仁苷及其4外酶解产物色谱形为良好,样品中的杂质没有对峰的分辨率产生干扰,苦杏仁苷、PTMT、野樱花苷、苯甲醛和杏仁腈的保留时间分别为 5.087、13.836、16.357、22.775和3.307 min,样品与标准品中的相应峰保留时间一致。
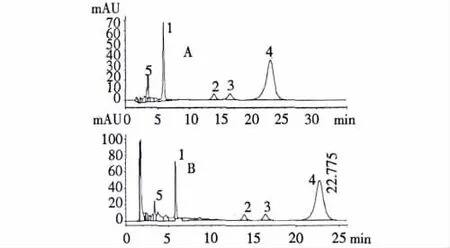
图2 苦杏仁苷及其酶解产物的HPLC图Fig.2 HPLC chromatograms of amygdalin and its metabolites
2.2 线性关系
苦杏仁苷、PTMT、野樱花苷、苯甲醛和杏仁腈的线性回归方程分别为:Y=8.94×105+3.76×103X(R=0.9998),Y=4.54 × 106-2.84 × 104X(R=0.9997),Y = 6.75 × 105-7.73 × 103X(R=0.9998),Y =8.31 × 104+5.22 × 103X(R=0.9998),Y = 7.19 × 105-4.38 × 103X(R=0.9996)。苦杏仁苷的线性范围为0.05~0.44 μg,PTMT的线性范围为0.043~0.51 μg,野樱花苷的线性范围为0.05~0.54 μg,苯甲醛的线性范围为0.06~0.48 μg,杏仁腈的线性范围为0.05~0.52 μg。从各回归方程的R值可以看出,各化合物在此HPLC条件下线性回归良好,满足要求。
2.3 不同温度条件下稳定性
结果表明,温度低于40℃时,苦杏仁苷、PTMT、野樱花苷、苯甲醛和杏仁腈12 h后的峰面积RSD值均分别为0.8%、1.1%、1.2%、1.1%、0.9%。当在50℃保温时,苦杏仁苷在6 h时的RSD值为4.5%,杏仁腈的RSD值为3.7%,这表明苦杏仁苷和杏仁腈在此温度下不稳定。50℃保温12 h时PTMT、野樱花苷、苯甲醛的RSD值分别为1.2%、1.3%和1.1%,这说明PTMT、野樱花苷、苯甲醛在50℃时稳定。因此,同时测试苦杏仁苷及其酶解产物的温度不应超过30℃。
2.4 不同pH条件下的稳定性
实验结果表明,当pH值为5.0时,苦杏仁苷和杏仁腈在溶液中不稳定,4 h时峰面积的RSD值分别为8.7%和7.4%。当pH为6.0时,各成分在溶液中稳定,12 h时苦杏仁苷、PTMT、野樱花苷、苯甲醛和杏仁腈峰面积的RSD值分别为1.1%、1.2%、1.4% 、0.93% 、1.3% 。
2.5 精密度和准确度
表1为日间和日内的精密度和准确度测试结果,从表中可以看出,所有样品的日内RSD值低于5.3%,日间RSD值低于4.9,日内的RE值介于0.3~3.3%,日间的RE值介于0.7~4.1%。以上结果表明,该HPLC方法具有较好的精密度和准确度。

表1 日间和日内的精密度和准确度n=6Table 1 Intra-day and inter-day precision and accuracy(n=6)(mg/mL)
2.6 回收率结果
回收率分析结果表明,苦杏仁苷、PTMT、野樱花苷、苯甲醛和杏仁腈的回收率分别为99%、100.4%、98%、99%、99%。这表明,所采用HPLC方法回收率符合要求。
3 结论
对苦杏仁苷的研究主要集中在苦杏仁苷的脱毒、加工、分析、检测等方面[11,12],尚没有关于对苦杏仁苷及其酶解产物的分析检测的研究报道。本文建立了一个高效、快速的同时检测苦杏仁苷及其4个酶解产物的HPLC方法,应用该方法,可以在23 min内完成一次检测分析。该HPLC分析方法稳定、可靠,精密度和准确度符合要求,结果能很好的重现,柱温25℃,pH 6.0~7.0。
1 Gurib-Fakim A,Brendler T.Medicinal and Aromatic Plants of indian Ocean Islands.Germany:Medpharm Scientific Publisher,2004.
2 Griffin GE.World Without Cancer:The Story of Vitamin B-17.US:Thousand Oaks,1974.103-104.
3 Dong J(董捷),Yin C(尹策),Zhang HC(张红城),et al.Research on antioxidative activities of amygdlin from Almond Pollen.Food Sci(食品科学),2000,28:65-68.
4 Fang WR(方伟蓉),Li YM(李运曼),Zhong LL(钟林霖).Experimental study of effects of amygdalin on adjuvant inflammatory.Chin J clinical pharmacol therapeut,2004,9:289-293.
5 Zhou JH(周金黄),Wang JM(王筠默).Pharmacology of Chinese Materia Medica(中药药理学).Shanghai:Shanghai Science and Technology Press,1986,219.
6 Chen ZH(陈志红),Wang LP(王莉平),LI M(李敏).Study on the extraction of amygdalin from walnut.App Chem Ind,2010,39:949-951.
7 Zhang W(张薇),Chang JM(常军民),Sheng MY(沈美英),et al.RP-HPLC determination of amygdalin,rutin,hyperoside and hesperidin in fruit of Sorbus tianschanica Rupr.Chin J Pharm Anal(药物分析杂志),2011,31:935-937.
8 Fang MF(房敏峰),Fu ZL(付志玲),Wang QL(王启林),et al.Effect of cream processing on metabolism and tissue distribution of bitter almond in rat.Chin J Expl Tradit Med Formulae(中国实验方剂学杂志),2011,17:132-137.
9 Kwon HJ,Lee JH,Hong SP.Improvement of the extraction efficiency of d-amygdalin from Armeniacae Semen powder through inactivating emulsin and suppressing the epimerization of d-amygdalin.Arch Pharm Res,2010,1:81-86.
10 Chang J,Zhang Y.Catalytic degradation of amygdalin by extracellular enzymes from Aspergillus niger.Process Biochem,2012,47:195-200.
11 Rauws AG,Gramberg LG,Olling M.Determination of amygdalin and its major metabolite prunasin in plasma and urine by high pressure liquid chromatography.Pharm World Sci,1982,6:172-175.
12 Nout MJ,Tuncel G,Brimer L.Microbial degradation of amygdalin of bitter apricot seeds(Prinus armeniaca).Int J Food Microbiol,1995,24:407-412.

