环境内分泌干扰物双酚A对小鼠甲状腺滤泡上皮细胞增殖和凋亡的影响*
刘泽兵, 王 丽, 叶宣光△, 于秀杰, 张友元
(1复旦大学附属金山医院病理科,上海 201508; 2天津医科大学内分泌研究所卫生部激素与发育重点实验室,天津 300070)
环境内分泌干扰物双酚A对小鼠甲状腺滤泡上皮细胞增殖和凋亡的影响*
刘泽兵1, 王 丽1, 叶宣光1△, 于秀杰2, 张友元1
(1复旦大学附属金山医院病理科,上海 201508;2天津医科大学内分泌研究所卫生部激素与发育重点实验室,天津 300070)
目的探讨环境内分泌干扰物双酚A(BPA)对小鼠甲状腺原代培养细胞增殖和凋亡的影响。方法取雌性BALB/cnu/nu小鼠甲状腺组织,采用胶原酶I/中性蛋白酶联合消化并进行滤泡上皮细胞培养,Western blotting检测甲状腺球蛋白表达对细胞进行鉴定。采用不同浓度的BPA干预稳定培养48 h的小鼠甲状腺原代培养的滤泡上皮细胞,作用24 h后,光学显微镜观测干预前后细胞生长状态的变化,流式细胞术分析细胞增殖和凋亡,real-time PCR法和免疫细胞化学染色法测定干预前后肿瘤坏死因子相关凋亡诱导配体受体1(TRAIL-R1) mRNA和蛋白的表达变化。结果原代培养的小鼠甲状腺滤泡上皮细胞随BPA刺激浓度的增加,生长状态呈现先促进后抑制的趋势;0.01~0.1 μmol/L BPA作用24 h后,细胞增殖呈剂量依赖性增长,0.1 μmol/L BPA可显著刺激细胞增殖(P<0.05),而1 μmol/L BPA刺激后则表现为细胞增殖水平显著下降(P<0.05);0.1 μmol/L BPA刺激后凋亡指数减低(P<0.05);0.1 μmol/L和1 μmol/L BPA刺激后TRAIL-R1 mRNA表达均显著下调(均P<0.05),蛋白表达与mRNA表达结果趋势一致。结论低、中浓度BPA可刺激原代培养的小鼠甲状腺滤泡上皮细胞增殖并抑制细胞凋亡,而高浓度BPA对细胞主要表现为毒性损害作用。BPA对细胞凋亡的影响可能与TRAIL-R1相关途径有关。
双酚A; 细胞增殖; 细胞凋亡; 甲状腺
环境内分泌干扰物(environmental endocrine disruptors, EEDs)包括杀虫剂、洗涤剂等工业化学物,释放至人类、动物的生存环境中并产生类激素活性效应。近些年,多项研究发现器官形成期暴露于EEDs可能会导致雄性个体生殖道畸形以及肿瘤形成。而对欧美成年男性人群的一项调查发现,暴露于EEDs可导致精子质量下降并导致男性不育[1]。此外,对于EEDs的致癌性也得到普遍认同,其中因EEDs与激素产生器官和激素作用靶器官特异性肿瘤的发生密切相关而成为研究热点之一。双酚A(bisphenol A, BPA)是一类经典的EEDs,具有类雌激素的化学结构并可产生微雌激素效应和雄激素拮抗作用[2]。研究发现,BPA既能刺激前列腺癌、乳腺癌、子宫内膜癌和卵巢癌等细胞增殖,也能刺激正常人脐静脉血管内皮细胞增殖[3]。甲状腺作为机体内最大的内分泌器官参与激素的分泌并受激素调节。因此,我们推测BPA可能对甲状腺功能调节、肿瘤形成等产生影响。在本研究拟通过观测BPA对原代培养的小鼠甲状腺滤泡上皮细胞(thyroid follicular epithelium cells, TFECs)增殖和凋亡的影响,为进一步探讨BPA对甲状腺相关疾病的影响提供实验数据。
材 料 和 方 法
1材料
1.1动物 选用BALB/cnu/nu小鼠(属SPF/VAF级动物),约4周龄,雌性,8只,购自北京华阜康生物科技股份有限公司。
1.2主要试剂 BPA和二甲基亚砜(dimethyl sulfoxide, DMSO)均购自Sigma。Trizol、逆转录试剂盒、rTaq DNA聚合酶、dNTP mixture和SYBR Green定量PCR试剂盒均购自大连TaKaRa。F-12 Coon’s Modification培养基购自Sigma,胶原酶I和中性蛋白酶(dispase)购自Gibco,胎牛血清(fetal calf serum, FCS)购自Biochrom。小鼠抗甲状腺球蛋白(thyroglobulin, Tg)Ⅰ抗购自Lab Vision/Thermo Scientific,β-actin Ⅰ抗购自Sigma,肿瘤坏死因子相关凋亡诱导配体(TNF-related apoptosis-inducing ligand,TRAIL)受体1(TRAIL-R1)Ⅰ抗购自Santa Cruz,Ⅱ抗及其它免疫细胞化学染色试剂购自上海太阳生物科技公司。
2方法
2.1小鼠甲状腺滤泡上皮细胞原代培养方法的建立 将小鼠实施安乐死,无菌分离双侧甲状腺组织。将每侧甲状腺组织剪切成约15小块后,收集至1.5 mL Eppendorf管中,无血清培养基吹洗2遍后,于每只管中加入消化酶(含胶原酶I 206 kU/L和dispase 2.75 kU/L各0.5mL),37 ℃水浴振荡消化40 min,振荡频率260次/min,然后800 r/min离心10min,弃去上清消化酶并加入1 mL含10%FCS的F-12 Coon’s完全培养基。用滴管反复轻柔吹打(避免产生过多气泡),将离心沉淀再次悬匀,直到肉眼几乎不能见组织块为止。将细胞悬液接种在24孔细胞培养板上,其中部分孔内预先加入玻璃盖片以备免疫细胞化学检测之用。最后置于37 ℃、5%CO2培养箱(Forma Scientific)内培养。次日换液,以后每隔3 d换液1次。每天用倒置显微镜(Olympus)观察细胞形态和生长情况,并拍照记录观测结果。F-12 Coon’s完全培养基各添加成分的终浓度分别为:氢化考的松5 μg/L,转铁蛋白5 mg/L,胰岛素10 mg/L,L-谷氨酰胺0.3 g/L,青霉素1×105U/L,链霉素100 mg/L,FCS 10%[4]。
2.2Western blotting检测Tg蛋白表达 收集培养72 h且生长状态良好的甲状腺滤泡上皮细胞,利用RIPA裂解缓冲液冰上裂解提取蛋白,参照文献标准方法进行。以β-actin为内参照。
2.3实验分组 对稳定培养48 h的TFECs进行分组,分为4组,每组6孔:(1)对照组:加入0.01 μmol/L DMSO;(2)低剂量组:加入0.01 μmol/L BPA;(3)中剂量组:加入0.1 μmol/L BPA;(4)高剂量组:加入1 μmol/L BPA。刺激因素作用时间均为24 h。
2.4形态学观测 在倒置相差显微镜下观测刺激前后原代培养的TFECs滤泡单位、单个细胞形态及折光性等方面的改变,并进行拍照纪录。
2.5流式细胞术检测细胞增殖与凋亡 刺激因素作用24 h后,胰酶消化并反复吹打至单细胞、过筛,调整细胞浓度约1×106/L,借助流式细胞仪检测细胞周期,计算细胞增殖指数(proliferation index, PI)参考公式:PI(%)= (S+G2/M)/(G0/G1+S+G2/M)×100%。同时计算凋亡指数(apoptotic index, AI),依据公式:AI(%)=凋亡细胞数/所测细胞总数×100%。
2.6免疫细胞化学染色法测定TRAIL-R1蛋白表达 将长有细胞的玻璃盖片从细胞培养板内取出,4%中性多聚甲醛固定6 h,PBS浸泡2 h后按照试剂操作说明书对TFECs进行TRAIL-R1蛋白标记,以PBS代替Ⅰ抗作为阴性对照,用已知阳性组织切片作为阳性对照,DAB显示8 min,最后苏木素复染。结果判定:经DAB显色后细胞质内出现棕黄色细小或斑块状物为阳性细胞。
2.7Real-time PCR法检测TRAIL-R1 mRNA表达 采用上述方法收集单细胞,加入适量Trizol提取细胞总RNA,然后RT-PCR法合成cDNA,以cDNA为模板借助SYBR Green real-time PCR法检测TRAIL-R1 mRNA表达差异。以3-磷酸甘油醛脱氢酶(glyceraldehyde-3-phosphate dehydrogenase, GAPDH)为内参照。各引物序列如下:TRAIL-R1 正义链5’-ACGTCTCCAGTCTGAGTC-3’,反义链5’-ACGTCTCCAGTCTGAGTC-3’;GAPDH 正义链5’-CCTGGAGAAACCTGCCAAGT-3’,反义链5’-TGGGAGTTGCTGTTGAAGTC-3’。反应条件:95 ℃预变性1 min,95 ℃ 5 s,62 ℃ 20 s,72 ℃ 10 s,共40个循环。
3统计学处理
数据以均数±标准差(mean±SD)表示,SPSS 13.0统计软件包进行分析,多组间比较采用方差分析或秩和检验(K-W检验),以P<0.05为差异有统计学意义。
结 果
1TFECs形态学改变
成功培养的小鼠甲状腺滤泡上皮细胞呈贴壁式生长、细胞呈上皮样、多角形,培养体系稳定后细胞的折光性强表示细胞活力好,反之则表示细胞活力下降。与对照组比较,0.01~0.1 μmol/L BPA刺激后TFECs折光性增强,且随浓度的增加细胞密度显著增加,1 μmol/L BPA干预后滤泡团折光性下降呈暗黑色,细胞角突缩短,且胞质内深色颗粒增多,细胞密度下降,主要表现为类毒性损害作用,见图1。
2TFECs表达Tg蛋白
Western blotting检测到原代培养的TFECs稳定表达甲状腺滤泡上皮特异性标志Tg,见图2。
3BPA对TFECs增殖与凋亡的影响
与对照组比较,0.1 μmol/L BPA组PI显著增高,约为对照组的5倍(P<0.05);1 μmol/L BPA组PI则明显下降,约为DMSO组的0.7倍(P<0.05)。与对照组比较,0.1 μmol/L BPA组AI显著减低,约为对照组的0.6倍(P<0.05),见图3、4。
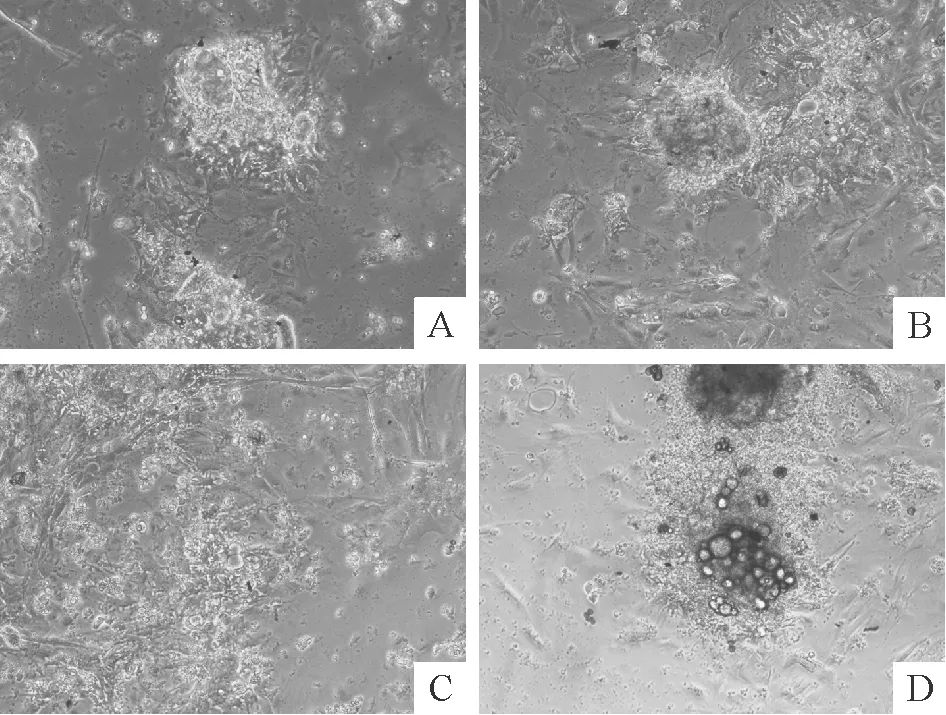
Figure 1. The morphological changes of primarily cultured TFECs with the stimulation of different concentrations of BPA under light microscope (×100).A:DMSO; B: 0.01 μmol/L BPA; C: 0.1 μmol/L BPA; D: 1 μmol/L BPA.
图1倒置相差显微镜下观测不同浓度BPA刺激原代培养的TFECs形态学变化

Figure 2. The expression of thyroglobulin (Tg) in cultured TFECs (Western blotting).
图2甲状腺滤泡上皮细胞Tg蛋白表达
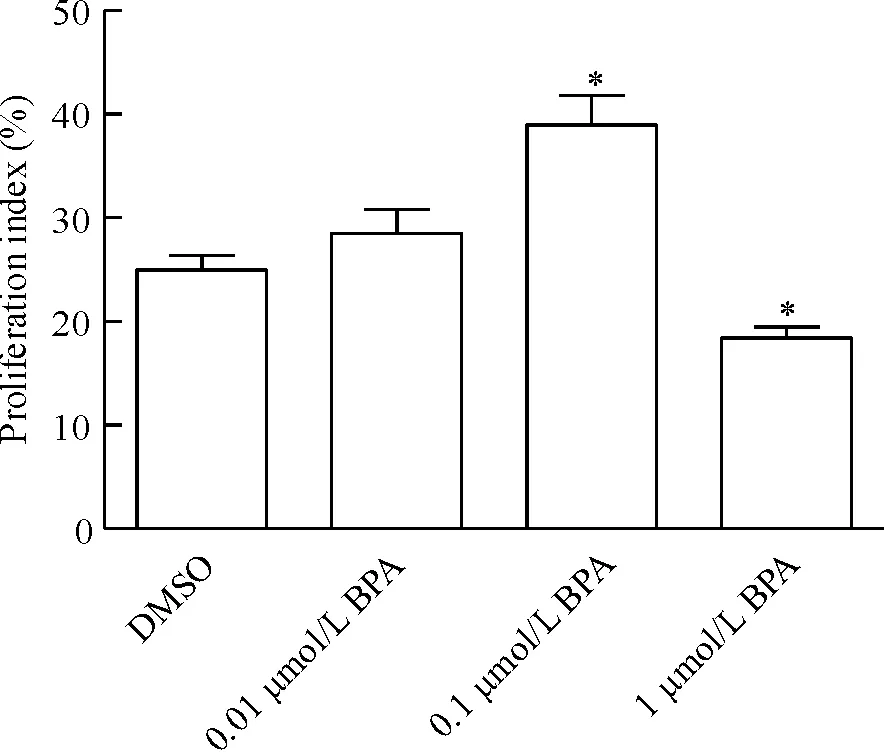
Figure 3. Effect of different concentrations of BPA on proliferation index of TFECs.Mean±SD.n=6.*P<0.05vsDMSO group.
图3不同浓度BPA对增殖指数的影响
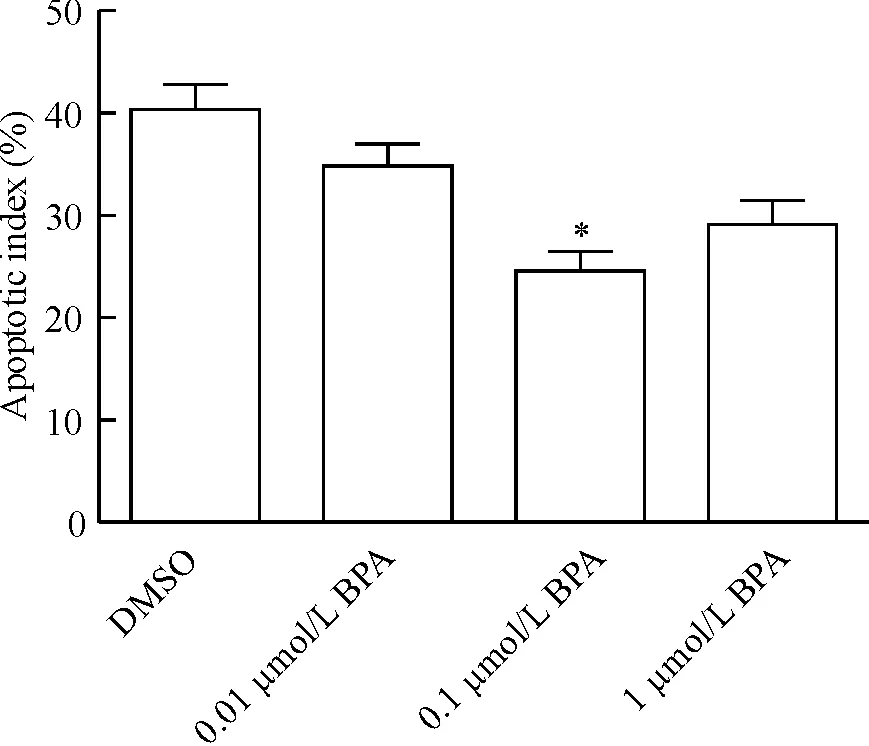
Figure 4. Effect of different concentrations of BPA on apoptotic index of TFECs.Mean±SD.n=6.*P<0.05vsDMSO group.
图4不同浓度BPA对凋亡指数的影响
4凋亡相关基因TRAIL-R1mRNA表达变化
Real-time PCR检测目的基因所得数据采用2-ΔΔCt法比较相关基因在各浓度组TFECs中的表达差异。与对照组比,0.1 μmol/L BPA组和1 μmol/L BPA组TRAIL-R1 mRNA表达均显著下调(均P<0.05),见图5。

Figure 5. The changes of TRAIL-R1 mRNA expression in the TFECs stimulated by different concentrations of BPA.Mean±SD.n=6.*P<0.05vsDMSO group.
图5不同浓度BPA刺激下TRAIL-R1mRNA表达变化
5TRAIL-R1蛋白表达变化
免疫细胞化学法分析不同浓度BPA作用下TFECs表达TRAIL-R1蛋白情况,结果显示阳性TFECs胞质存在棕褐色颗粒或片状物。与对照组比较,其余3组着色强度均呈一定程度下降,但0.1 μmol/L BPA组和1 μmol/L BPA组下降较为明显,其中0.1 μmol/L BPA组着色强度下降最为显著,见图6。
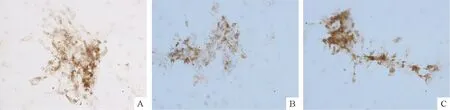
Figure 6. The immunocytochemical analysis of TRAIL-R1 expression in primarily cultured TFECs stimulated by different concentrations of BPA (×100). A: DMSO; B: 0.1 μmol/L BPA; C: 1 μmol/L BPA.
图6免疫细胞化学法分析不同浓度BPA作用下TRAIL-R1蛋白的表达
讨 论
BPA 是人工合成的苯酚和丙酮的衍生物之一,并作为原料被广泛应用于化工、医药等领域。随着全球环境污染的日益严重, 人群暴露于BPA的危害得到普遍关注。目前,BPA的研究主要集中在人体暴露途径、暴露程度、机体内药物代谢动力学、毒性机制以及与肿瘤的相关性等方面[2]。多项研究证实,BPA具有类雌激素的化学结构并可产生微雌激素效应和雄激素拮抗作用。Dairkee等[5]利用BPA刺激原代培养的高危人群乳腺上皮细胞,结果BPA能够持续激活mTOR途径,同时伴剂量依赖性细胞凋亡逃逸和增殖促进。进一步研究发现,BPA可显著下调细胞周期前凋亡负性调节因子(p53、p21WAF1及Bax)的表达,同时上调增殖启动基因(增殖性核抗原、细胞周期蛋白及pRb)表达[6]。
本实验首先采用双酶联合消化法收获单个甲状腺滤泡,而这些滤泡区别传统意义上的组织块培养和单细胞原代培养,我们将单个滤泡体外接种后短期内可维持极性状态,与细胞系比较则更接近细胞的在体状态,同时我们采用Western blotting法检测到原代培养的TFECs 稳定表达Tg蛋白,从而完成细胞鉴定。此原代培养方法的建立,有利于对甲状腺滤泡上皮细胞功能调节以及肿瘤形成等方面的研究。低~中等浓度BPA刺激 TFECs后,细胞显示活力增强、生长旺盛;而浓度继续升高至1 μmol/L时细胞活力显著下降,表现为细胞角突缩短、生长缓慢、细胞内出现黑色类似中毒颗粒样物及折光性减弱。张帅帅等[7]实验证明高浓度BPA可导致人乳腺癌细胞系MCF-7细胞核DNA严重受损、细胞增殖显著受抑以及细胞膜通透性改变伴大量乳酸脱氢酶等细胞毒性损害作用,与本实验所观测到的结果一致。
本研究利用流式细胞术检测不同浓度BPA对TFECs增殖指数和凋亡指数的影响,结果发现低、中浓度BPA主要表现其弱雌激素样作用,可导致剂量依赖性PI增加和AI减低,而高浓度BPA则表现为PI和AI显著减低。结合参考文献,进一步分析推测高浓度BPA对TFECs可能主要表现为毒性损害作用、导致细胞活力下降,增殖必然受抑,而凋亡指数由于可能受到细胞死亡等混杂因素影响不一定会显著改变。郑继翠等[3]报道BPA能够促进人脐静脉血管内皮细胞的体外增殖与Ptak等[8]实验证实BPA能够促进卵巢癌细胞系OVCAR-3细胞增殖同时抑制凋亡相关因子caspase-3活性等结果与本研究结果一致。此外, TRAIL-R1在诱导细胞凋亡过程中发挥重要作用,是凋亡信号转导通路中的关键分子。TRAIL-R1与炎症形成及肿瘤发生、发展密切相关[9-10],靶向TRAIL-R1抗肿瘤策略也不断被报道[11]。我们还对BPA影响TFECs凋亡的机制进行了初步探讨,在mRNA和蛋白水平检测凋亡相关基因TRAIL-R1的表达,并发现中、高浓度BPA能够显著抑制TRAIL-R1 mRNA表达,中等浓度BPA可抑制TRAIL-R1蛋白表达,表现为阳性细胞数量的减少以及阳性细胞着色强度的减低。
总之,低、中浓度BPA对原代培养的TFECs增殖具有促进作用,对其凋亡产生抑制作用,而高浓度BPA则主要表现细胞毒性损害作用;低、中浓度BPA对细胞凋亡的影响可能是通过TRAIL-R1途径实现的。
[1] Lagos-Cabré R, Moreno RD. Contribution of environmental pollutants to male infertily: a working model of germ cell apoptosis induced by plasticizers [J]. Biol Res, 2012, 45(1): 5-14.
[2] Soto AM, Sonnenschein C. Environmental causes of cancer: endocrine disruptors as carcinogens [J]. Nat Rev Endocrinol, 2010, 6(7): 363-370.
[3] 郑继翠, 肖现民, 郑 珊, 等. 环境内分泌干扰物对人脐静脉血管内皮细胞增殖的影响及其相关机制[J]. 复旦学报:医学版, 2006, 33(6): 718-726.
[4] 刘泽兵, 臧晓怡, 于秀杰, 等. 小鼠甲状腺细胞原代培养及鉴定[J]. 中国地方病学杂志, 2007, 26(6): 620-623.
[5] Dairkee SH, Seok J, Champion S, et al. Bisphenol A induces a profile of tumor aggressiveness in high-risk cells from breast cancer patients [J]. Cancer Res, 2008, 68(7): 2076-2080.
[6] Dairkee SH, Luciani-Torres MG, Moore DH, et al. Bisphenol-A-induced inactivation of the p53 axis underlying deregulation of proliferation kinetics, and cell death in non-malignant human breast epithelial cells [J]. Carcinogenesis, 2013,34(3):703-712.
[7] 张帅帅, 刘 堰, 刘树深, 等. 不同终点检测5种双酚A类化合物对MCF-7的细胞毒性[J]. 环境科学, 2012, 33(11): 3935-3940.
[8] Ptak A, Wróbel A, Gregoraszczuk EL. Effect of bisphenol-A on the expression of selected genes involved in cell cycle and apoptosis in the OVCAR-3 cell line [J]. Toxicol Lett, 2011, 202(1): 30-35.
[9] 陈慎仁,郑志超,罗毅平,等. 凋亡相关因子参与自身免疫性甲状腺疾病发病的研究[J]. 中国病理生理杂志, 2004, 20(3):440-444.
[10] 刘泽兵, 臧晓怡, 李庆欣, 等. Poly(I:C)加重碘过量诱发的NOD鼠慢性淋巴细胞性甲状腺炎[J]. 中国病理生理杂志, 2010, 26(3): 549-553.
[11] Szliszka E, Jaworska D, Ksek M, et al. Targeting death receptor TRAIL-R2 by chalcones for TRAIL-induced apoptosis in cancer cells [J]. Int J Mol Sci, 2012, 13(11): 15343-15359.
EffectsofenvironmentalendocrinedisruptorbisphenolAonproliferationandapoptosisofmousethyroidfollicularepitheliumcells
LIU Ze-bing1, WANG Li1, YE Xuan-guang1, YU Xiu-jie2, ZHANG You-yuan1
(1DepartmentofPathology,JinshanHospitalofFudanUniversity,Shanghai201508,China;2KeylaboratoryforHormoneandDevelopmentofMinisterofHealth,InstituteofEndocrinology,TianjinMedicalUniversity,Tianjin300070,China.E-mail:yypertussis@163.com)
AIM: To investigate the effect of environmental endocrine disruptor bisphenol A (BPA) on the proliferation and apoptosis of primarily cultured mouse thyroid follicular epithelium cells (TFECs).METHODSThe thyroids of female BALB/cnu/numice were digested by the combination of collagenase I and dispase. The isolated TFECs were cultured and identified by Western blotting. After cultured for 48 h, the TFECs were stimulated with different concentrations of BPA for 24 h. The morphological changes of TFECs were observed under light microscope. The cells were digested and harveste,and the proliferation and apoptosis were determined by the application of flow cytometry. The expression of TNF-related apoptosis-inducing ligand receptor 1 (TRAIL-R1) at protein and mRNA levels was investigated by the methods of immunocytochemistry and real-time PCR, respectively.RESULTSWith the increase in BPA concentration, the growth of TFECs was firstly promoted and then inhibited. Dose-dependent proliferation was exhibited by the stimulation of BPA at 0.01~0.1 μmol/L, and proliferation index (PI) was significantly enhanced by 0.1 μmol/L BPA and attenuated by 1 μmol/L BPA. The apoptotic index (AI) was significantly decreased by 0.1 μmol/L BPA. The expression of TRAIL-R1 at mRNA and protein levels was drastically down-regulated by 0.1 μmol/L and 1 μmol/L BPA.CONCLUSIONProliferation of TFECs is promoted by the stimulation of low to medium concentrations of BPA,while high concentration of BPA mainly exhibits a toxic effect. Additionally, the effect of BPA on apoptosis is potentially mediated through TRAIL-R1-related pathway.
Bisphenol A; Cell proliferation; Apoptosis; Thyroid gland
R736.1
A
10.3969/j.issn.1000- 4718.2013.06.021
1000- 4718(2013)06- 1076- 05
2013- 04- 02
2013- 04- 13
上海市金山科学技术创新项目(No. 2011-3-12); 上海市卫生局面上科研基金资助项目(No. 20100051)
△通讯作者 Tel: 021-34189990-5376; E-mail: yypertussis@163.com

