邻苯二甲酸二丁酯——蜡蚧霉代谢产物
高英,薛皎亮,熊琦,毛立新,谢映平
(山西大学 生命科学学院,山西 太原 030006)
蜡蚧霉Lecanicilliurn lecanii(Zimmermann)(或蜡蚧轮枝菌Verticillium lecanii(Zimmermann)Gams&Zare)是一种主要寄生同翅目、鳞翅目、缨翅目等昆虫的重要昆虫病原真菌,其地理分布和寄主范围都非常广泛,在分类上属于子囊菌门Ascomycota,粪菌纲Sordariomycetes,肉座菌目 Hypocreales,麦角菌科Clavicip itaceae[1].Nivter于1861年在锡兰发现蜡蚧霉.自20世纪70年代以来,国内外学者对其进行了广泛研究,其研究主要集中在对蚜虫[2-3]、粉虱[4-5]、蚧虫[6-7]等害虫的防治.昆虫病原真菌分泌的毒素物质在致死寄主的过程中起关键作用.蜡蚧霉代谢产物成分复杂.Kanaoka等[8]推断蜡蚧霉菌丝体提取物环状多肽球孢交酯对家蚕具有毒杀作用.Claydon等[9](1982)研究认为蜡蚧霉代谢液中具有杀虫活性的物质为2,6-吡啶二羧酸,2,6-吡啶二羧酸钠盐对红头丽蝇(Calliphora erythrocephala)有毒性.研究表明蜡蚧霉菌丝体的毒素可能为磷脂类,但具体结构均不清楚[10-12].
国内外大量研究已证实动、植物和微生物可产生具有生理活性物质的DBP.海洋来源的放线菌代谢产物中的抗肿瘤活性成分DBP对小鼠乳腺癌细胞(温敏型tsFT210)具有G0/G1期细胞周期抑制作用[13].放线菌SPRI0518次级代谢产物丙酮提取物DBP具有除草活性[14].炭团菌活性物DBP对樟子松枯梢病菌具有较高抑菌作用[15].链霉菌(Streptomyces)代谢物中的 DBP具有抗菌性能[16-17]和抑制水解酶α-糖苷酶、β-糖苷酶和α-甘露糖酶、β-甘露糖酶的作用[18].作者利用高速逆流色谱(High speed counter current chromatography,HSCCC)分离纯化了蜡蚧霉次生代谢产物,发现该真菌产生邻苯二甲酸二丁酯(Dibutyl Phthalate,DBP).
1 材料与方法
1.1 材料
菌株:蜡蚧霉菌株CGMCC NO.3.4505(从蚧虫体上分离)与CGMCC NO.3.4504(从稻飞虱体上分离),购于中国科学院微生物研究所菌种保藏管理中心,储存于4℃冰箱中备用.
主要仪器:半制备型逆流色谱仪(TBE-300A,上海同田生化技术有限公司产),ATKA Prime泵系统、检测系统及组分收集系统,温控恒温水浴锅(北京博康医疗器械有限公司),气质联用仪(安捷伦GC-MS,Agilent 7890A-5975C),旋转蒸发仪(上海申生),气相色谱仪(GC-2010,日本岛津).
试剂:乙酸乙酯、乙醇、甲醇、硝酸钠、磷酸氢二钾、硫酸镁、氯化钾、硫酸亚铁、葡萄糖均为分析纯.
1.2 菌株的培养
将蜡蚧霉菌株NO.3.4505与NO.3.4504分别接入装有PDA斜面培养基的试管中,放入培养箱中,于温度25℃,相对湿度75%下培养7d,获得一级菌种.
在100mL三角瓶中加入约40mL液体查氏培养基,高压灭菌30min,冷却后将一级菌种接种至液体查氏培养基,接种量为100mL三角瓶接1支一级斜面菌种,于25℃下恒温震荡培养7d获得二级菌种.
在7L液体发酵罐中加入5L液体查氏培养基,高压灭菌30min,待冷却后,接种500mL二级菌种,通气量按体积比1∶1,压力0.1MPa在25℃培养10d.
1.3 代谢产物的提取
将培养好的菌株发酵液于5000r/min下离心15min,去除菌丝体.然后将上清液于50℃下减压浓缩至原体积的1/5.在浓缩液中加入3倍体积乙醇进行醇沉,室温下静置24h,5000r/min下离心10min,去除沉淀.然后将上清液于50℃下减压浓缩至原体积的1/5,得浓缩脱醇液.将等体积的乙酸乙酯萃取剂加入脱醇后的浓缩液中,超声波萃取3次,将有机相合并浓缩干燥,用少量的乙酸乙酯重新溶解粗提物,干燥后得乙酸乙酯粗提物.
1.4 高速逆流色谱分离、纯化粗提物
根据多次试验结果,确定两相溶剂系统为正己烷∶乙酸乙酯∶甲醇∶水(4︰5∶4∶5,V/V),并将两相溶剂用力充分混合后静置过夜(切勿使用超声波进行混合),使用前将两相分离至两试剂瓶中,超声波脱气30min,取上相为固定相,下相为流动相.将固定相以50mL/min的流速用泵充满整个螺旋柱,启动色谱仪,调节转速为820r/min,流动相流速为1mL/min.当流动相从主机出口流出时体系已经达到平衡,此时固定相保留值为70%.将乙酸乙酯粗提物100mg溶于10mL固定相中并用0.2μm有机滤膜过滤,然后将其打入样品环后进行分离.大约450min后停止分离,将螺旋柱中的固定相用氮气吹出收集,将收集液减压浓缩,获得菌株NO.3.4505与NO.3.4504代谢产生的无色油状液体L3.4505与L3.4504.
1.5 GC与GC/MS分析
通过GC与GC/MS分析检测无色油状液体,确定收集样品的化学成分.
GC/MS分析条件:柱温45℃起,恒温4min,以15℃/min的速率升温至235℃并保保持25min,压力26.4psi(0.182MPa),进样量1μL,分流比10︰1,FFAP柱(30m×250μm×0.25μm),检测器温度250℃,接口温度280℃,EI源温度230℃,四级杆温度150℃.
GC分析条件:柱温80℃起,恒温3min,以15℃/min的速率升温至210℃并保保持3min,以10℃/min的速率升温至280℃并保持10min,进样量1μL,分流进样20∶1,CP-8柱,FIT检测器.
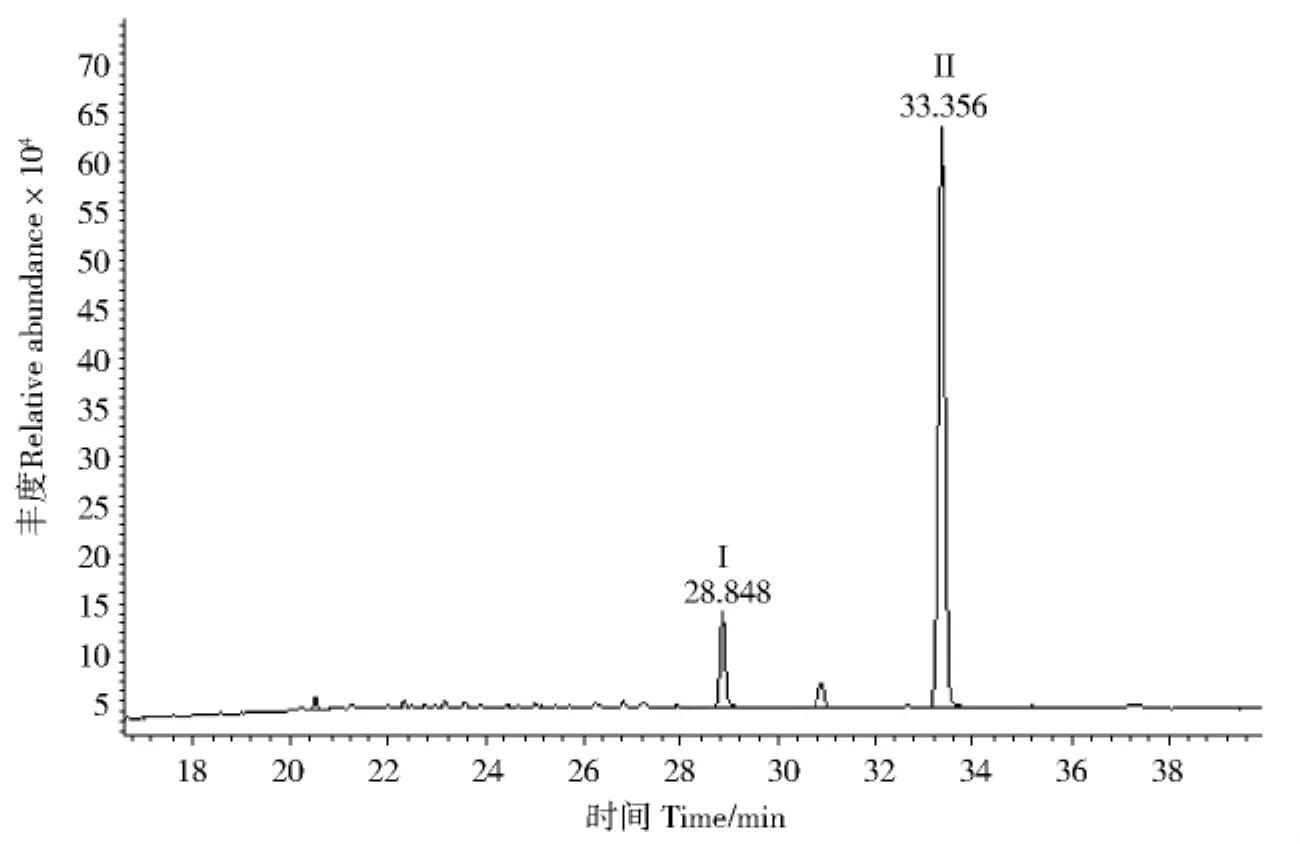
图1 L3.4505GC/MS检测的总离子流色谱图Fig.1 Total ion chromatogram of L3.4505with GC/MS
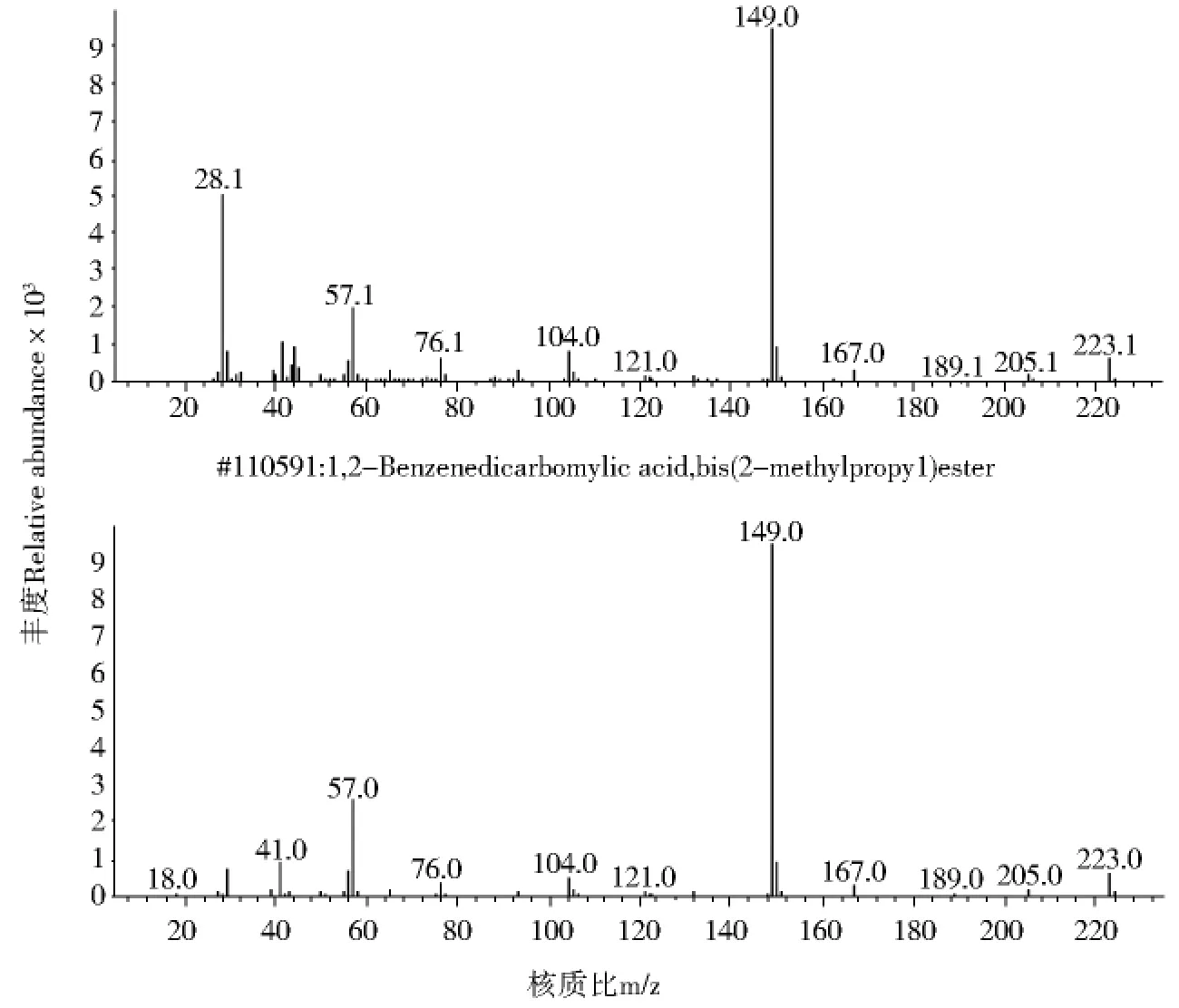
图2 L3.4505离子流色谱图中峰I与DIBP质谱图比较Fig.2 Comparison of mass spectra of the peak I of L3.4505and DIBP
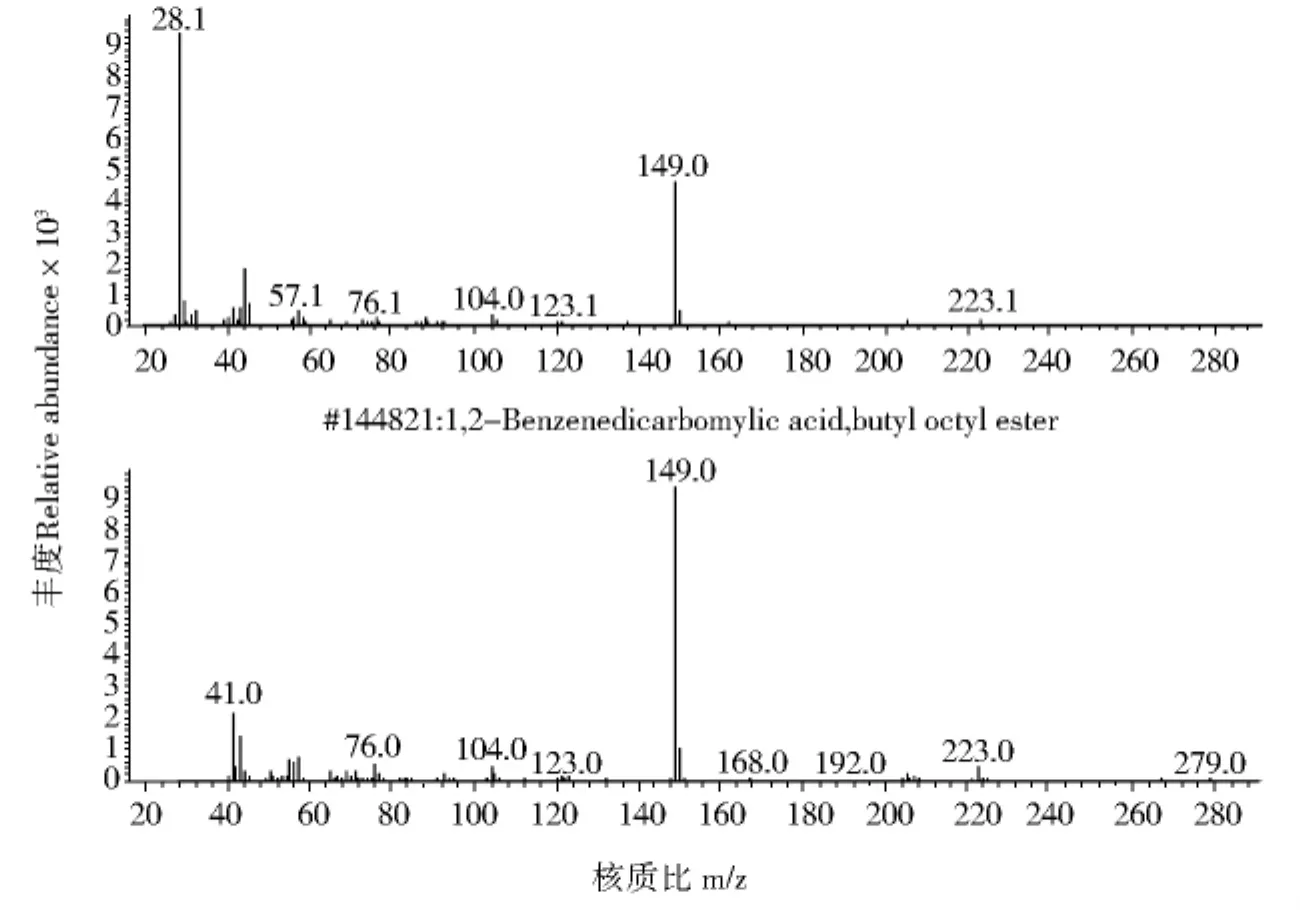
图3 L3.4505离子流色谱图中峰II与DBP质谱图比较Fig.3 Comparison of mass spectra of the peak II of L3.4505and DBP
2 结果与分析
应用GC/MS对无色油状液体检测.从无色油状液体L3.4505GC/MS离子流色谱图(图1,P97)可知其组分较纯,图1中峰I、峰II的质谱与谱库检索质谱比较见图2与图3,分析峰II为DBP(RT=33.356,质量匹配数97),峰I为邻苯二甲酸二异丁酯(Diisobutyl Phthalate DIBP,RT=28.848),面积归一法计算峰II的相对含量为98%.比较无色油状液体L3.4505(图4,P99)和标准品DBP(图5,P99,RT=17.849)、DIBP(图6,P99,RT=16.709)的气相色谱图,结果二者的出峰时间均相同,证明无色油状液体L3.4505主要为DBP.无色油状液体L3.4504的GC/MS离子流色谱图见图7(P100),谱库检索结果无色油状液体L3.4504为DBP.

图4 L3.4505气相色谱图Fig.4 Gas chromatogram of L3.4505
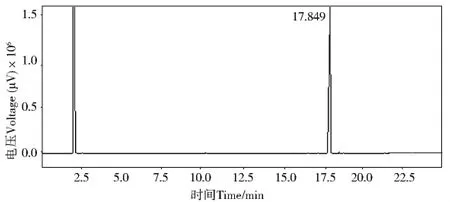
图5 DBP气相色谱图Fig.5 Gas chromatogram of DBP

图6 DIBP气相色谱图Fig.6 Gas chromatogram of DIBP
3 讨论
本研究利用高速逆流色谱首次从两株蜡蚧霉菌株的代谢液中分离得到DBP.Savard等曾从青霉菌(Penicillium bilaii)PB-50的次级代谢产物中分离得到DBP[19].中药材怀牛膝的有效生理活性物质中含有DBP[20].云南干巴菌中DBP的相对含量为2.25%[21].Chen等在人造海水中培养的红藻(Bangia atropurpurea)同样也产生DBP,且不同藻类在同一环境中的产量差异显著,表明DBP是由于藻类内在的固有性质决定的[22].两种可食褐藻(Undaria pinnatifida 和Laminaria japonica)和绿藻(Ulvasp.)代谢可产生含丰富的天然14C的DBP[23].Basaran首次从一株产黄曲霉毒素的寄生曲霉(Aspergillus parasiticus)代谢产物中提取得到DBP[24].Ruikar从枪弹木(Mimusops elengi)中首次分离出DBP[25].Pfordt检测没有任何确定污染的31种食品和人乳中的邻苯二甲酸二丁基盐(酯)的浓度为10~51mg/kg[26].
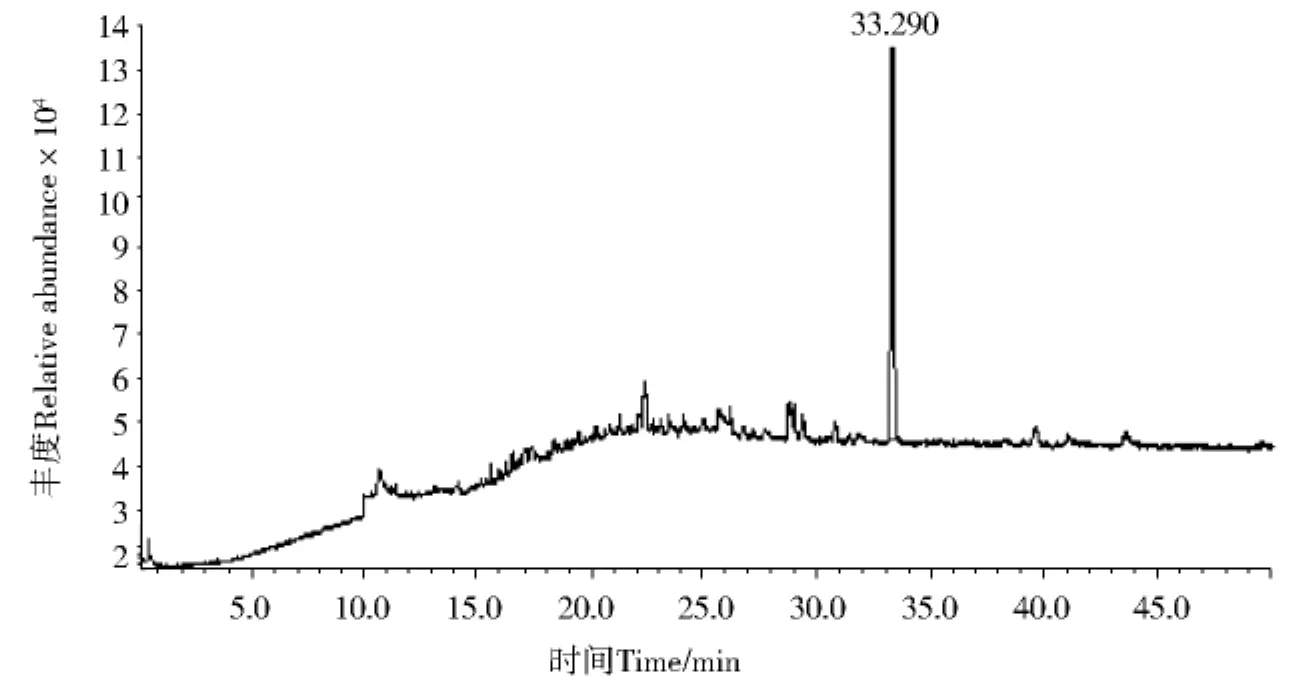
图7 L3.4504GC/MS检测的总离子流色谱图Fig.7 Total ion chromatogram of L3.4504with GC/MS
4 结论
本次研究利用高速逆流色谱,以正己烷-乙酸乙酯-甲醇-水(4∶5∶4∶5)为两相溶剂系统,首次从两株昆虫病原真菌蜡蚧霉的次生代谢产物中分离得到DBP.本研究对开发生物资源进行害虫生物防治具有重要意义.
[1]Sung G H,Sung J M,Hywel-Jones N L.A multi-genephylogeny of Clavicip Itaceae(Ascomycota,Fungi):Identification of Localized Incongruence Using a Combinational Bootstrap Approach[J].Molecular Phy logenetics and Evolution,2007,44:1204-1223.
[2]Askary H,Benhamou N,Brodeur J.Ultrastructural and Cytochemicalcharacterization of Aphid Invasion by the Hyphomycete Verticillium Lecanii[J].Journal of Invertebrate Pathology,1999,74(1):1-13.
[3]Lee J Y,Kang S W,Yoon S S,et al.Verticillium Lecanii Spore Formulation Using UV Protectant and Wetting Agent and the Biocontrol of Cotton Aphids[J].Biotechnology Letter,2006,28:1041-1045.
[4]Gindin G,Geschtovt N U,Raccah B,et al.Pathogenicity of Verticillium Lecanii to Different Developmental Stages of the Silverleaf Whitefly,Bemisia Argentifolii[J].Phytoparasitica,2000,28(3):229-239.
[5]Cuthbertson A G,Walters K F.Pathogenicity of the Entomopathogenic Fungus,Lecanicillium Muscarium,Against the Sweet Potato Whitefly,Bemisia Tabaci Under Laboratory and Glasshouse Conditions[J].Mycopathologia,2005,160(4):315-319.
[6]Liu W M,Xie Y P,Xue J L,et al.Histopathological Changes of Ceroplastes Japonicus Infected by Lecanicillium Lecanii[J].Journal of Invertebrate Pathology,2009,101:96-105.
[7]Liu W M,Xie Y P,Xue J L,et al.Ultrastructural and Cytochemical Characterization of Brown Soft Scale Coccus Hesperidum (Hemiptera:Coccidae)Infected by the Lecanicillium Lecanii(Ascomycota:Hypocreales)[J].Micron,2011,42:71-79.
[8]Kanaoka M,Isogai A,urakoshi S,et al.Bassianolide,a new Insecticidal Cyclodepsipeptide from Beauveria Bassiana and Verticillium Lecanii[J].Agricultural and Biological Chemistry,1978,42 (3):629-635.
[9]Claydon N,Grove J F.Insecticidal Secondary Metabolic Products from the Entomoenous Fungus Vercillicum Lecanii[J].Journal of Invertebrate Pathology,1982,40:413-418.
[10]Gindin G,Barash I,Harari N,et al.Effect of Endotoxin Compounds Isolated from Verticillium Lecanii on the Sweet Potato Whitefly,Bemisia Tabaci[J].Phytoparasitica,1994,22 (3):189-196.
[11]秦小萍,张亚平,杨美林,等.蜡蚧轮枝菌 Km9803代谢产物对蚜虫的毒杀作用[J].西北农业学报,2009,18(1):159-161.
[12]王联德.蜡蚧轮枝菌毒素及其对烟粉虱种群控制作用的研究[D].福州:福建农林大学博士学位论文,2003.
[13]曲新颜,顾谦群,崔承彬,等.海洋来源的放线菌3295代谢产物的结构鉴定及抗肿瘤活性(I)[J].中国海洋药物杂志,2004,23(6):1-4.
[14]张李桃,孙军利,顾学斌,等.放线菌SPRI0518次级代谢产物的分离提纯及结构鉴定[J].化学与生物工程,2006,23(9):29-31.
[15]宋瑞清,高海燕.炭团菌提取物对樟子松枯梢病菌的抑菌活性及稳定性[J].微生物学报,2009,49(7):910-917.
[16]El-Naggar M Y M.Dibutyl Phthalate and the Antitumor Agent F5A1,Two Metabolites Produced by Streptomyces nasrisubmutant H35[J].Biomed Lett,1997,55:125-131.
[17]Roy R N,Laskar S,Sen S K.Dibutyl Phthalate,the Bioactive Compound Produced by Streptomyces Albidoflavus 321.2[J].Microbiological Research,2006,161:121-126.
[18]Lee D S.Dibutylphthalate,anα-glucosidase Inhibitor from Streptomyces Melanosporofaciens[J].Journal of Bioscence and Bioengineerwg,2000,89:271-273.
[19]Savard M E,Miller J D,Blais L A,et al.Secondary Metabolism of Penicillium Bilaii Strain PB-50[J].Mycopathologia,1994,127(1):19-27.
[20]韦松,梁鸿,赵玉英,等.怀牛膝中化合物的分离鉴定[J].中国中药杂志,1997,22(5):293-295.
[21]吕瑜平,文净,朱伟明.云南干巴菌挥发油化学成分的研究[J].天然产物研究与开发,2000,13(1):39-41.
[22]Chen C Y.Biosynthesis of Di-(2-ethylhexyl)Phthalate(DEHP)and di-n-butyl Phthalate(DBP)from Red Alga-Bangia Atropurpurea[J].Water Research,2004,38:1014-1018.
[23]Michio Namikoshi,Takeshi Fujiwara,Teruaki Nishikawa and Kazuyo Ukai.Natural Abundance14C Content of Dibutyl Phthalate(DBP)from Three Marine Algae[J].Marine Drugs,2006,4:290-297.
[24]Basaran P,Demirbas R M.Spectroscopic Detection of Pharmaceutical Compounds from an Aflatoxigenic Strain of Aspergillus Parasiticus[J].Microbiological Research,2010,165:516-522.
[25]Ruikar A D,Gadkari T V,Phalgune U D,et al.Dibutyl Phthalate,a Secondary Metabolite from Mimusops Elengi[J].Chemistry of Natural Compounds,2011,46(6):955-956.
[26]Pfordt J.Levels of Di(2-ethylhexyl)Phthalate(DEHP)and Dibutyl Phthalates in Some Food Stuffs with Plastic Packagings and in Mother’s Milk[J].Deutsche Lebensmittel Rundschau,2004,100:431-436.

