工业硫酸锰的净化和高纯锰酸锂的制备
包新军 ,王志坚 ,刘吉波 ,苏正夫 ,黄 志 ,成 维 ,周德壁
(1.湖南稀土金属材料研究院,湖南长沙 410026;2.中南大学化学化工学院)
随着锂离子电池的快速发展,锰系列正极材料凭借价格低、电位高、环境友好、安全性能高等优点,已成为具有良好应用前景的锂离子电池正极材料。硫酸锰是生产其他锰氧化物及锰盐的重要工业中间产品[1],在涂料、造纸、陶瓷、印染、矿石浮选、饲料和畜牧业等领域均有广泛的应用。传统的硫酸锰制备工艺是将锰矿石和硫铁矿分别细磨成浆,并按照一定比例混合,加水和硫酸,经加热、除铁、除重金属、中和、压滤等工序后制备而得。传统工艺中对锰矿物品位有较高的要求,含锰34%(质量分数)以上的高品位矿才能生产出纯度为98%~99%的硫酸锰产品,含锰10%~20%(质量分数)的低品位矿只能生产纯度96%的产品。中国锰矿资源大多为贫杂矿,富矿严重短缺[2-3],由低品位的锰矿制备的硫酸锰及工业中间产品,杂质含量(特别是钙、镁、铁等)高,因此去除钙、镁、铁等杂质一直是硫酸锰生产工业的难题[4-6]。
针对湖南郴州市某企业生产的硫酸锰产品中钙、镁、铁杂质含量较高的问题,采用较独特的MnF2除钙和镁、高锰酸钾氧化、水解除铁实验,制备高纯度的硫酸锰产品,进而制备高纯尖晶石结构的锰酸锂(LiMn2O4)产品。所得产品达到了锂离子电池正极材料用高纯硫酸锰的要求,有很高的应用价值。
1 实验部分
1.1 原料
高锰酸钾、LiOH·H2O、K2S2O8,均为分析纯;工业MnF2;硫酸锰溶液(郴州市某企业生产的工业硫酸锰配制而成),其主要杂质成分:w(Ca)=0.14%、w(Mg)=0.072%、w(Fe)=0.00085%
1.2 硫酸锰除杂反应原理
使用MnF2作为净化剂,一方面可以与溶液中的 Ca2+、 Mg2+反应生成难溶的 CaF2、MgF2沉淀物,另一方面又可以为溶液体系补充Mn2+。加入高锰酸钾氧化剂,氧化溶液中的铁转化为Fe3+,通过水解生成Fe(OH)3絮状物并除去,同时可以氧化溶液中小部分锰离子,生成具有活性的MnO2絮状物,吸附CaF2和MgF2以生成Fe(OH)3絮状物沉淀。主要化学反应式:
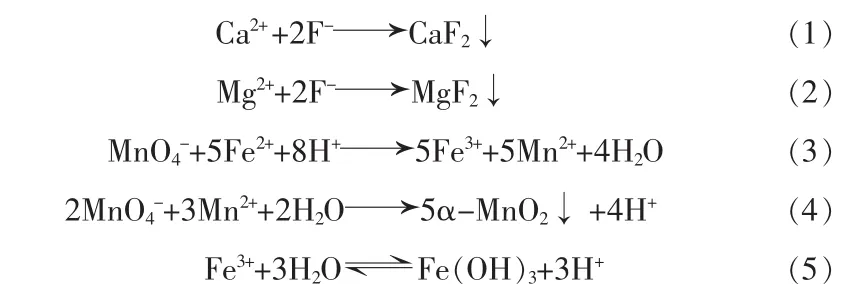
1.3 合成LiMn2O4原理
以除杂后的MnSO4为锰源,采用液相共沉淀法合成MnO2[7],再经高温锂化合成LiMn2O4产品。反应式(8)的标准 Gibbs 自由能(ΔG0)约为-151 kJ/mol,反应具有很强的向右进行的趋势,在温和的条件下就可生成MnO2,再经锂化制备LiMn2O4产品。主要化学反应式:

1.4 实验过程
1)Ca、Mg、Fe 除杂。 称取工业硫酸锰原料置入烧杯中,加入去离子水,搅拌,待温度升至90℃时加入MnF2,反应2 h,静置、过滤,向滤液中加入KMnO4,调节 pH 至 2.5~4,反应 30 min 后,静置、过滤,得到纯度较高的MnSO4溶液。
2)合成LiMn2O4产品。以除杂后的MnSO4溶液为锰源,加入同体积、同浓度的K2S2O8溶液。酸性条件下,60℃水浴反应22 h,过滤,制得黑色沉淀,用去离子水和乙醇反复洗涤至溶液呈中性,100℃真空干燥 12 h 得到 α-MnO2样品。 按 n(MnO2)/n(LiOH·H2O)=2∶1.05 称样,研磨混合,置入管式炉中,450 ℃下煅烧12 h,再在760℃下煅烧6 h,自然冷却至室温,得到LiMn2O4产品。
2 结果与讨论
2.1 MnF2除钙、镁的效果
图1为硫酸锰质量浓度对钙、镁去除率的影响。由图1可知,使用MnF2除杂Ca2+和Mg2+的效果显著,其中Ca2+的去除率在95%以上。当MnSO4溶液质量浓度为350 g/L时,Ca2+和Mg2+的去除率分别为96.67%和88.13%,Mg2+的去除率未达到90%,可能原因在于 CaF2的溶度积(Ksp,CaF2=2.70×10-11)远小于MgF2的溶度积(Ksp,MgF2=6.5×10-9),因此除杂过程中优先生成CaF2沉淀物。

图1 不同硫酸锰质量浓度下钙、镁的去除率
为进一步提高Mg2+的去除率,达到锂离子电池正极材料用高纯硫酸锰的要求,实验对除杂工艺进行了改进。调整MnF2实际加入量为理论用量的1.05倍,加入之前先将MnF2搅拌成浆,加入用量的1/2反应1 h后,再加入另外1/2。实验结果如表2所示。
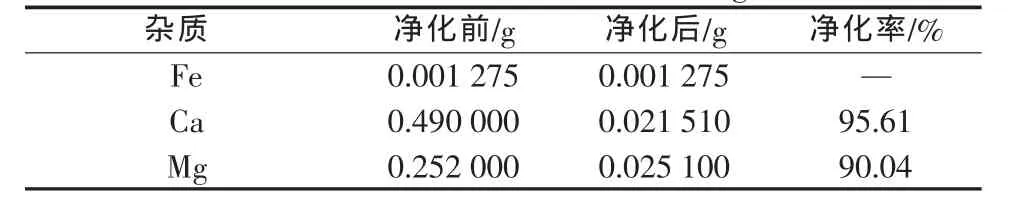
表2 改进后钙和镁去除结果分析(以350 g/L MnSO4计)
由表2可见,与传统工艺比较,使用氟化锰净化除钙、镁新工艺,没有带来新杂质,净化效果也较为理想。在已有Ca2+、Mg2+净化率分别为95.61%和90.04%的基础上,笔者进一步做了深化实验。按氧化溶液中1%(质量分数)Mn2+的消耗量加入高锰酸钾,KMnO4部分氧化Mn2+,生成具有活性的MnO2沉淀,可以吸附CaF2、MgF2沉淀物。实验结果见表3。
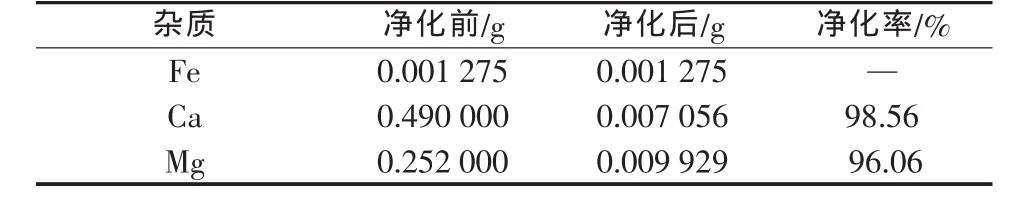
表3 加入高锰酸钾除钙和镁的结果分析(以350g/LMnSO4计)
同时,高锰酸钾氧化 Fe2+变成 Fe3+,根据 Fe(OH)3溶度积(常温下 Ksp,Fe(OH)3=4.0×10-38)公式计算:
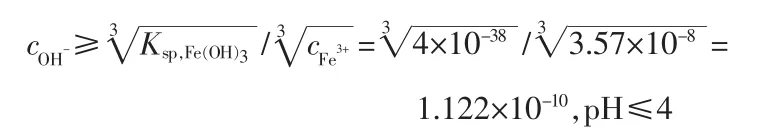
通过调节 pH 在 3~4,Fe3+水解生成Fe(OH)3絮凝物,溶液中Fe3+质量分数可控制在2.0×10-6以内。
2.2 LiMn2O4产品SEM分析
图2为以除杂后的MnSO4为锰源合成的LiMn2O4产品SEM照片。由图2可知,LiMn2O4产品具有规则的球形形貌,直径在8 μm左右。

图2 LiMn2O4产品SEM照片
2.3 LiMn2O4产品XRD分析
图3为以除杂后的MnSO4为锰源合成的LiMn2O4产品XRD谱图。由图3可见,产品衍射峰峰形尖锐,具有很好的Fd3m尖晶石结构。
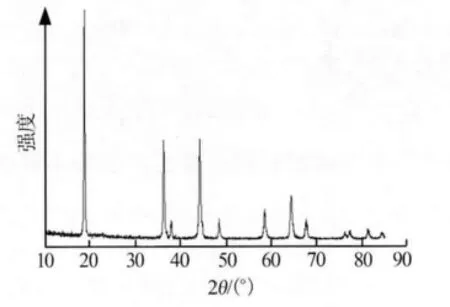
图3 LiMn2O4产品XRD谱图
3 结论
采用独特的工艺去除工业硫酸锰中的杂质:加入氟化锰除钙、镁;加入高锰酸钾,一方面氧化铁转化为Fe3+,另一方面氧化溶液中小部分锰离子,生成具有活性的二氧化锰,吸附CaF2和MgF2沉淀。实验结果表明:1)Ca2+、Mg2+的去除率可分别达到 98.56%和96.06%,除杂效果显著,Ca、Mg质量分数均在5.0×10-5以下,调节pH水解除去Fe3+,铁的质量分数可在2×10-6以下。2﹚以除杂后的硫酸锰为锰源,采用液相共沉淀方法先合成MnO2,再锂化制备LiMn2O4产品。SEM和XRD结果表明,合成的LiMn2O4产品具有球形形貌,衍射峰峰形尖锐,具有很好的Fd3m尖晶石结构。3)采用高锰酸钾氧化、氟化锰除钙和镁、水解除铁工艺,制备了纯度较高的硫酸锰产品。达到了锂离子电池正极材料用高纯硫酸锰的要求,有较高的应用价值。
[1]谭柱中,梅光贵,李维健.锰冶金学[M].长沙:中南大学出版社,2004.
[2]孟运生,徐晓军,王吉坤.贫锰矿细菌浸出试验研究[J].湿法冶金,2002,21(4) :184-187.
[3]袁清静.菱锰矿制高纯碳酸锰的研究[J].无机盐工业,1998,30(4):11-12.
[4]周登凤,李军旗,杨志彬,等.硫酸锰深度净化的研究[J].贵州工业大学学报:自然科学版,2006,35(1):4-6.
[5]杜军,刘晓波,刘作华,等.菱锰矿浸取及除杂工艺的研究进展[J].中国锰业,2008,26 (2):15-19.
[6]李军旗,张国才,毛小浩,等.氯化锰溶液的净化工艺[J].有色金属,2011,63(2):172-174.
[7]Wang Hong′en,Qian Dong.Synthesis and electrochemical properties of α-MnO2microspheres[J].Mater.Chem.Phys.,2008,109(3):399-403.

