肝硬化患者胃动素受体表达与胃排空的研究
潘丽丽,殷积彬,高善玲,张文华,黄 淇,李 直,刘 超,胡丽红,刘冰熔
哈尔滨医科大学1.附属第二医院消化内科;2.形态学中心;3.附属第二医院放射线科;4.附属第二医院研究生科,黑龙江 哈尔滨 150086
腹胀是肝硬化患者主要腹部不适症状之一,直接影响患者的生活质量,是临床顽症之一。肝硬化性腹胀一直被认为是肝功能不全和门静脉高压所致,但由于其具体发生机制并不清楚,因此导致临床治疗效果不佳。胃动素受体(motilin receptor,MTL-R)表达异常是否参与了肝硬化患者胃排空功能紊乱,目前国内外未见相关报道。本文主要研究肝硬化时胃动素受体在胃窦黏膜的表达及胃排空情况,进一步深入了解肝硬化时胃排空功能紊乱的形成原因,寻找能够改善肝硬化患者生活质量的治疗措施。
1 资料与方法
1.1 病例选择及分组 选取2010年8月-2011年12月我院肝硬化住院患者32例,肝硬化诊断标准符合2000年中华医学会传染病与寄生虫病学分会、肝病学分会联合修订的病毒肝炎防治方案,均有早饱、上腹胀等症状,男20 例,女12 例,平均年龄(53.56 ±8.66)岁,乙型肝炎型肝硬化22例,丙型肝炎型肝硬化3例,自身免疫型肝炎肝硬化3例,戊型肝炎型肝硬化2例,不明原因型肝硬化2例。排除其他影响胃排空的疾病:消化性溃疡、胃癌、幽门梗阻、心脏病、糖尿病、神经系统疾病、甲状腺疾病以及严重全身性疾病;有腹部手术史,食管胃底静脉曲张治疗史者。根据胃黏膜病变分为有PHG组(17例)和无PHG组(15例)。根据第7版《内科学》肝硬化Child-Pugh分级标准将患者分为3组:Child A组11例,Child B组11例,Child C组10例。选取18例健康对照者,男10例,女8例,平均年龄(48.77±14.39)岁。所有受试者受检前7 d停用影响胃肠运动的药物,12 h前禁烟,签订知情同意书。
1.2 试剂与方法
1.2.1 试剂:兔抗人 MTL-R抗体购自 Abgent公司。非生物素化山羊抗兔IgG抗体和DAB酶底物显色试剂盒购自中杉金桥公司。一次性活检钳购自南京微创医学科技有限公司,型号为MTN-BF-23。电子胃镜为Olympus-GIF-Q240。
1.2.2 取材:受试者均空腹12 h行电子胃镜检查。在电子胃镜下观察胃黏膜的病变及有无PHG改变。按Maccormack分类标准将PHG分为轻型和重型。轻型为细微粉红色样斑点或猩红热样疹,黏膜皱襞表浅,红斑呈剥脱样或镶嵌图案样外观。重型为弥漫性樱桃红样斑点或弥漫融合性出血性胃炎。用一次性活检钳尽可能大地钳取2块胃窦部黏膜,立即放入10%甲醛液中固定。
1.2.3 操作流程:DAB显色,PBS代替第一抗体作为阴性对照,苏木精-伊红染色和免疫组化操作步骤参照说明书,一抗滴度1∶10。
1.2.4 免疫组化判断标准:显微镜观察,MTL-R阳性染色主要定位于腺体上皮细胞浆,胞浆有黄色或棕黄颗粒即为阳性细胞。在高倍视野下每张切片随机选择10个视野,以腺体为单位,用Image-Pro Plus图像分析软件进行半定量分析得出MTL-R表达的阳性值。
1.3 胃标记物排空时间测定
1.3.1 不透X线标记物及标准试餐:本研究采用自制胶囊型不透X线标记物,其成分由两部分构成,外壳为双歧三联活菌肠溶胶囊的胶囊外壳(晋城海斯制药有限公司),内容物为常规硫酸钡干混悬剂(X线双重造影用,购自青岛东风化工有限公司)。每个标记物重量约为220 mg,安全无毒性,在胃内不裂解、不吸收,进入肠道内完全崩解。因重量较轻,可与半固体食物混在一起,易于在食糜被携带推进,顺利通过幽门,要求受试者在进食标准餐时吞服2枚。胃完全排空标记物的时间反映胃排空情况。标准餐:鸡蛋羹100 g+香肠75 g,为避免食物及标记物在食管的滞留,饮纯净水200 mL。本试餐为固体与半固体之间的试餐,所有食物的温度均为37℃(排除试餐温度[1]对胃排空的影响)。
1.3.2 胃标记物完全排空时间测定:所有受试者均空腹立位于数字成像X线机腹部摄片下,先口服常规上消化道造影用硫酸钡剂20 mL,观察食管及胃的轮廓。待硫酸钡完全胃排空后,进食标准餐,进餐同时服用2枚不透X线标记物。所有受试者5 min内进食完毕。餐后立即面对探头站立,全腹部曝光一次,记录标记物在胃中的位置。后患者保持安静仰卧位态[2]。每0.5 h起立摄腹部平片一次,连续观察直至标记物完全排出胃进入十二指肠。胃标记物完全排空时间是指从受试者吞服2枚标记物起的时间点至2枚标记物完全排出胃的时间点,以标记物完全排出幽门为准。记录各个受试者胃标记物完全排空时间。
1.4 统计学处理 用SPSS 17.0统计软件,计量数据以表示,计量资料采用方差分析,计数资料采用卡方检验及U检验,相关性检验采用pearson相关检验,分析胃动素受体表达与胃排空之间是否存在相关性。P<0.05为差异有统计学意义。
2 结果
2.1 肝硬化患者胃黏膜形态学变化
2.1.1 PHG 病变:镜下53.1%(17/32)肝硬化患者呈现 PHG,PHG 轻型占 9.4%(3/32),PHG 重型占43.8%(14/32),其中PHG重型肝硬化A级占6.3%(2/32),B 级占 12.5%(4/32),C 级占 25.0%(8/32)。
2.1.2 HE染色:HE染色标本显示肝硬化组胃窦黏膜水肿明显,腺体上皮细胞变性坏死,黏膜层炎症细胞浸润。
2.2 MTL-R的表达情况 免疫组化示在人胃窦黏膜腺体上皮细胞中可检测出MTL-R的表达,呈棕黄色颗粒(见图1、2)。
肝硬化组MTL-R表达阳性值(22.9±13.0)%明显低于正常组(44.8±9.2)%,差异有统计学意义(P<0.05)。有PHG组 MTL-R表达阳性值(17.3±10.3)%较无 PHG 组(29.3±13.0)%低,差异有统计学意义(P<0.05,见表1)。肝硬化Child-Pugh分级越高,MTL-R表达阳性值越低,Child A组为(35.4±7.8)%,Child B 组为(23.3 ± 7.9)%,Child C 组为(8.8±5.2)%,各组间比较差异有统计学意义(P<0.05,见表 2)。
2.3 胃标记物排空情况 胃标记物完全排空时间肝硬化组(223.28±90.31)min明显延迟于正常组(166.77 ±62.54)min,差异有统计学意义(P <0.05)。有 PHG 组(272.35±63.16)min较无 PHG 组(167.67±85.21)min标记物排空时间明显延长,差异有统计学意义(P<0.05,见表1)。Child-Pugh分级越高,标记物排空时间延长越明显,Child B组(230.45±85.42)min和Child C 组(261.80 ±86.64)min均较正常组排空时间延长明显,差异有统计学意义(P<0.05,见表2)。Child A 组(181.09 ±87.92)min 较正常组标记物排空时间延长不明显,差异无统计学意义(P >0.05,见图3、4)。
表1 正常组和肝硬化各组的MTL-R表达阳性值及胃标记物完全排空时间情况()Tab1 Motilin receptors and gastric emptying times of radiopaque markers in patients with liver cirrhosis and normal subjects()
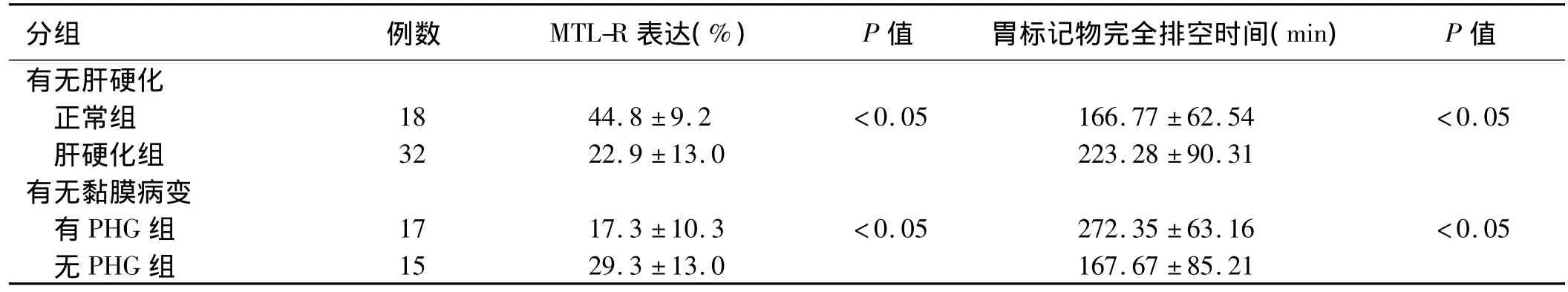
表1 正常组和肝硬化各组的MTL-R表达阳性值及胃标记物完全排空时间情况()Tab1 Motilin receptors and gastric emptying times of radiopaque markers in patients with liver cirrhosis and normal subjects()
分组 例数 MTL-R表达(%) P值 胃标记物完全排空时间(min) P值15 29.3 ±13.0 167.67 ±85.21有无肝硬化正常组 18 44.8 ±9.2 <0.05 166.77±62.54 <0.05肝硬化组 32 22.9 ±13.0 223.28 ±90.31有无黏膜病变有 PHG 组 17 17.3±10.3 <0.05 272.35±63.16 <0.05无PHG组
表2 正常组和肝硬化各组MTL-R表达及胃标记物排空情况()Tab2 Motilin receptors and gastric emptying times of radiopaque markers in patients with liver cirrhosis and normal subjects()

表2 正常组和肝硬化各组MTL-R表达及胃标记物排空情况()Tab2 Motilin receptors and gastric emptying times of radiopaque markers in patients with liver cirrhosis and normal subjects()
与正常组比较,*P <0.05
组别 例数 MTL-R表达阳性值(%) 胃标记物排空时间(min)18 44.8 ±9.2 166.77 ±62.54 Child A 组 11 35.4 ±7.8 181.09 ±87.92 Child B 组 11 23.3 ±7.9 230.45 ±85.42*Child C 组 10 8.8 ±5.2 261.80 ±86.64*P正常组<0.05值
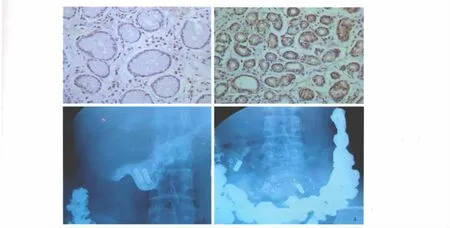
图1 肝硬化组胃窦MTL-R表达(免疫组化100×);图2 正常组胃窦MTL-R表达(免疫组化40×);图3 2枚标记物在胃中;图4 2枚标记物完全胃排空Fig1 MTL-R positive cells in antrum mucosa of patients with liver cirrhosis(immunohistochemistry 100×);Fig2 MTL-R positive cells in antrum mucosa of normal subjects(immunohistochemistry 40×);Fig3 The two radiopaque markers were in stomach;Fig4 The two radiopaque markers were out of stomach completely
2.4 MTL-R表达与胃排空的关系 MTL-R表达阳性值X与胃标记物完全排空时间Y具有负相关,相关系数是 -0.675,P <0.05,相关方程是 Y= -365.5X+315.4。
3 讨论
1997年有学者[3]从人类基因组DNA文库中克隆出与下丘脑和垂体促生长激素分泌激素(GHS)相关的G蛋白偶联受体(GPCR),将其中的一个成员命名为 GPR38,称为“孤儿受体”。1999年 Feighner等[4]克隆并鉴定了“孤儿受体”为MTL-R。MTL-R[5]是一种G蛋白偶联受体,分布于人的胃肠道[6-7],可能在胃肠道的运动中起到了调节作用。Ter Beek等[8]证实了MTL-R分布于正常人和炎症性肠病患者的胃、十二指肠、回肠、结肠的肌层和黏膜层中,其表达程度与炎症程度无关。但还有学者[9]研究示三硝基苯磺酸诱发的兔结肠炎,结肠收缩减弱与MTL-R表达下调有关。有学者[10]研究了胰十二指肠切除术后患者MTL-R表达与胃排空情况,发现患者术后胃排空延迟发生率降低,其原因是该术式保留了MTL-R分布密度较高的空肠段。本组发现胃窦黏膜腺体上皮细胞[8]中可检测出MTL-R的表达,肝硬化组MTL-R表达降低,有PHG组表达降低,Child C组MTL-R表达明显降低,可能由于胃黏膜充血水肿明显,胃腺体上皮细胞出现变性坏死加重,使得腺体上皮分泌 MTL-R减少而影响胃排空。
胃标记物完全排空时间反映了受试者胃排空情况。学者[11-12]研究肝硬化患者胃排空延迟可能机制是与肝功能减退及门脉高压相关。本组肝硬化组胃标记物完全排空时间延长,有PHG组胃标记物排空时间明显延长,肝硬化Child-Pugh分级越高,胃排空障碍越明显,可能机制为PHG胃黏膜水肿明显,导致胃壁增厚,使得胃壁弹性下降,胃壁的顺应性下降,导致餐后的近端胃容受性扩张[13-15],导致胃排空延迟;同时本组胃动素受体表达阳性值与胃标记物完全排空时间呈负相关,胃动素受体表达阳性值越低,胃排空延迟越明显,说明肝硬化患者存在明显的胃排空障碍,可能与MTL-R表达降低有关。除上述因素外,胃排空可能还受很多因素的影响,如年龄、性别、身体健康状况、自主神经功能障碍[16]及胃轻瘫[2]等。
综上所述,本研究表明,肝硬化组存在胃排空功能障碍,其原因可能与肝脏Child-Pugh分级、PHG、胃窦黏膜胃动素受体表达异常等多种因素相关。启示在治疗肝硬化腹胀时,从提高胃动素受体的敏感性出发,给予胃动素受体激动剂治疗期望有效。
[1]Mishima Y ,Amano Y,Takahashi Y,et al.Gastric emptying of liquid and solid meals at various temperatures[J].J Gastroenterol,2009,44(5):412-418.
[2]Verne GN,Soldevia-Pico C,Robinson ME,et al.Autonomic dysfunction and gastroparesis in cirrhosis[J].J Clin Gastroenterol,2004,38(1):72-76.
[3]McKeea KK,Tan CP,Palyha OC,et al.Cloning and characterization of two human G protein-coupled receptor genes(GPR38 and GPR39)related to the growth hormone secretagogue and neurotensin receptors[J].Genomics,1997,46(3):426-434.
[4]Feighner SD,Tan CP,McKee KK,et al.Receptor for motilin identified in the human gastrointestinal system[J].Science,1999,284(5423):2184-2188.
[5]Carreras CW,Siani MA,Santi DV,et al.Stable expression of a synthetic gene for the human motilin receptor:use in an aequorin-based receptor activation assay[J].Anal Biochem,2002,300(2):146-151.
[6]Takeshita E,Matsuura B,Dong M.Molecular characterization and distribution of motilin family receptors in the human gastrointestinal tract[J].J Gastroenterol,2006,41(3):223-230.
[7]Miller P,Roy A,St-Pierre S,et al.Motilin receptors in the human antrum[J].Am J Physiol Gastrointest Liver Physiol,2000,278(1):G18-G23.
[8]Ter Beek WP,Muller ES,van den Berg M,et al.Motilin receptor expression in smooth muscle,myenteric plexus,and mucosa of human inflamed and noninflamed intestine[J].Inflamm Bowel Dis,2008,14(5):612-619.
[9]Depoortere I,Van Assche G,Peeters TL,et al.Motilin receptor density in inflamed and noninflamed tissue in rabbit TNBS-induced colitis[J].Neurogastroenterol Mot,2001,13(1):55-63.
[10]Kollmar O,Sperling J,Moussavian MR,et al.Delayed gastric emptying after pancreaticoduodenectomy:influence of the orthotopic technique of reconstruction and intestinal motilin receptor expression[J].J Gastrointest Surg,2011,15(7):1158-1167.
[11]Ishizu H,Shiomi S,Kawamura E,et al.Gastric emptying in patients with chronic liver diseases[J].Annals of Nuclear Medicine,2002,16(3):177-182.
[12]Kalaitzakis E,Simren M ,Abrahamsson H,et al.Role of gastric sensorimotor dysfunction in gastrointestinal symptoms and energy intake in liver cirrhosis[J].Scandinavian Journal of Gastroenterology,2007,42(2):237-246.
[13]Fahmy ME,Osman MA,Mahmoud RA,et al.Measuring of gastric emptying in egyptian pediatric paeients with portal hypertension by using real-time ultrasound [J].Saudi J Gastroenterol,2012,18(1):40-43.
[14]Izbéki F,Kiss I,Wittmann T,et al.Impaired accommodation of proximal stomach in patients with alcoholic liver cirrhosis[J].Scand J Gastroenterol,2002,37(12):1403-1410.
[15]Aprile LR,Meneghelli UG,Martinelli AL,et al.Gastric motility in patients with presinusoidal portal hypertension[J].Am J Gastroenterol,2002,7(12):3083-3044.
[16]Gumurdulu Y,Yapar Z,Serin E,et al.Gastric emptying time and the effect of cisapride in Cirrhotic patients with autonomic neuropathy[J].J Clin Gastroenterol,2003,36(2):175-178.

