蜜环菌提取物抗氧化及抑菌活性研究
翟凤艳,张方鹏,崔明洋,刘英杰
(河南科技学院,河南新乡453003)
蜜环菌[Armillariella melle a(Vahl.ex Fr.)Karst]是我国一种珍贵的药食兼用真菌,隶属于担子菌门,担子菌纲,伞菌目,口蘑科,其子实体又称榛蘑,广泛分布于温带地区[1].蜜环菌美味可口,含有人体必需的多种氨基酸、微量元素及维生素[2].经常食用可增强机体免疫力,具有镇静、抗惊厥、抗衰老、增强耐缺氧能力等作用[3-4].
国内外对蜜环菌多糖进行的药理学研究表明,其具有抗辐射、促进造血、抑制肿瘤生长、调节免疫等多种药理作用[5],因此迄今为止蜜环菌多糖的提取及生物活性得到了广泛的研究,但对蜜环菌其他成分及其功能的研究鲜见详细报道.本研究从清除DPPH·、清除羟基自由基·OH和清除超氧阴离子自由基·三方面研究了蜜环菌子实体、液体发酵菌丝体及菌索乙醇提取物的体外抗氧化效果及抑菌活性,为蜜环菌生物活性的深入研究及开发应用奠定基础.
1 材料与方法
1.1 试验材料
1.1.1 供试菌种 蜜环菌干子实体,购于昆明食用菌研究所;蜜环菌菌种,购于吉林农业大学菌物研究所;供试菌种为4种细菌,分别是金黄色葡萄球菌Staphyloccocus aureus Rosenbach,产气杆菌Bacillas perfringens Veillon et Zuber,变形杆菌 Bacterium proteus Weil et Felix,枯草芽孢杆菌 Bacillus subtilis(Ehrenberg)Cohn,用以测定蜜环菌提取液抑菌活性.供试菌种由河南科技学院资源与环境学院植物病理实验室提供.
1.1.2 试剂与仪器 DPPH(1,1-二苯基-2-三硝基苯肼)为美国Sigma公司产品,邻苯三酚、三羟甲基胺基甲烷(Tris)、抗坏血酸、水杨酸、硫酸亚铁、H2O2、无水乙醇、盐酸等,均为国产分析纯.TU-1 201紫外-可见分光光度计,北京普析通用仪器有限责任公司.
1.2 试验方法
1.2.1 蜜环菌提取物的制备
子实体提取物制备:将蜜环菌子实体在40℃烘箱中烘干至恒重,粉碎,称取100 g干粉,加入200 mL体积分数为90%的乙醇浸泡24 h,过滤,收集滤液.用相同方法重复提取3次,合并提取液,置于55℃的恒温水浴锅中,直至提取液完全挥发,再用体积分数为90%的乙醇将剩余提取物重新溶解,定容至100 mL,得到质量浓度为1 g/mL的子实体提取液,于磨口瓶中储存备用.
液体发酵菌丝体提取物制备:将蜜环菌菌种用PDA培养基于25℃条件下活化,无菌条件下将幼嫩菌索接种入装有150 mL PD培养液的锥形瓶中,置于25℃的恒温摇床中,120 r/min条件下振荡培养2周,过滤得液体发酵菌丝体,置于40℃烘箱中烘干至恒重,得3.5 g干品,用200 mL体积分数为90%的乙醇浸泡24 h,过滤,收集滤液.用相同的方法重复提取3次,合并提取液,置于55℃的恒温水浴锅中,直至提取液完全挥发,再用3.5 mL体积分数为90%的乙醇将剩余提取物重新溶解,得到质量浓度为1 g/mL的菌球提取液,于磨口瓶中储存备用.
菌索提取物制备:将蜜环菌菌种用PDA培养基于25℃条件下扩繁,剔除培养基,用清水冲洗,收集得蜜环菌菌索,置于40℃烘箱中烘干至恒重,得7.0 g干品,用200 mL体积分数为90%的乙醇浸泡24 h,过滤,收集滤液.用相同的方法重复提取3次,合并提取液,置于55℃的恒温水浴锅中,直至提取液完全挥发,再用7.0 mL体积分数为90%的乙醇将剩余提取物重新溶解,得到质量浓度为1 g/mL的菌索提取液,于磨口瓶中储存备用.
1.2.2 抗氧化活性测定
清除DPPH·活性测定:根据Astrid von Gadow等的方法[6],分别取质量浓度为1.0、0.5、0.2 g/mL的乙醇提取物溶液2 mL,加入0.2 mmol/L的DPPH乙醇溶液2 mL,摇匀后,于室温下在黑暗处反应30 min.以无水乙醇调零,测定517 nm处的吸光值A样品.同时,测定2.0 mL乙醇提取物溶液与2.0 mL乙醇混合液在517 nm处的吸光值A空白,再测定2.0 mL DPPH乙醇溶液与2.0 mL乙醇在517 nm处的吸光值A对照.每个浓度重复测定3次,取其吸光度的平均值.用相同的方法测定与乙醇提取物样品相同浓度的抗坏血酸对DPPH·的清除能力.清除率计算公式为:

清除·OH活性测定:参照陈留勇等修改后的Smirnoff水杨酸法[7-8].反应体系中分别含8.8 mmol/L的H2O2溶液1 mL,9 mmol/L的FeSO4溶液1 mL,9 mmol/L的水杨酸-乙醇溶液1 mL和1 mL质量浓度梯度为1.0、0.5、0.2 g/mL的乙醇提取物溶液.其中,H2O2最后加入并启动整个体系,37℃水浴中反应30 min.以蒸馏水作空白对照,每个质量浓度重复测定3次,取其吸光度的平均值.用相同的方法测定与乙醇提取物样品相同质量浓度的抗坏血酸对·OH的清除能力.清除率计算公式为:
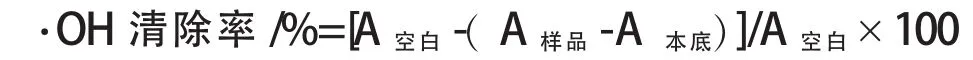
式中:A本底为样品溶液的本底吸光值(即加入FeSO4、水杨酸、乙醇提取物溶液,不加H2O2的吸光度值).

式中:A本底为用水代替邻苯三酚时不同乙醇提取物质量浓度下测得的吸光值.
1.2.3 抑菌活性测定
菌种活化:将保存的细菌菌种在无菌条件下接种于灭菌的牛肉膏蛋白胨培养基上,置于32℃培养箱中培养.
菌悬液的制备:用比浊法[10]制备菌悬液,麦法兰云度计可作为混浊度的比较标准.取洁净试管加入质量分数为1%的BaCl2溶液0.1 mL,体积分数为1%的H2SO4溶液9.9 mL,以此混浊度相当于3×108细菌数,分别制备以上供试菌种的菌悬液.
抑菌试验:在无菌条件下用移液枪移取1 mL制备好的菌悬液与熔化后的培养基在培养皿中混合均匀.待凝固后取灭过菌的直径为6 mm的滤纸片,将滤纸片在制备好的质量浓度为1 g/mL的蜜环菌子实体、液体发酵菌丝体和菌索乙醇提取液中充分浸泡后放置培养皿中,每皿3个滤纸片均匀放置.对照组滤纸片用体积分数为90%的乙醇浸泡.每种病原细菌设置1个对照,3个重复.放置25℃培养箱中培养,48 h后观察,用十字交叉法测量菌落直径,以其平均值表示菌落生长直径,计算抑菌率.
菌落平均直径/mm=培养皿直径-抑菌圈平均直径-滤纸片直径
抑菌率/%=(对照组菌落直径-处理组菌落直径)/对照组菌落直径×100
2 结果与分析
2.1 抗氧化活性
蜜环菌子实体、液体发酵菌丝体、菌索乙醇提取物及相同浓度抗坏血酸抗氧化活性测定结果见表1.

表1 蜜环菌提取物及抗坏血酸抗氧化活性Fig.1 Antioxidantactivity of Armillariella mellea extracts and Vc
由表1可知,蜜环菌子实体、液体发酵菌丝体及菌索乙醇提取物对3种自由基均具有一定的清除能力,且浓度越高,清除效果越好,但清除能力均低于对照天然抗氧化剂抗坏血酸.3种提取物对DPPH·的清除率最高,对·OH的清除率次之,对·的清除率最低.子实体和液体发酵菌丝体提取物对DPPH·清除率高于菌索提取物,子实体提取物对·OH清除效果明显优于液体发酵菌丝体及菌索提取物,液体发酵菌丝体对·清除能力最差.
2.2 抑菌活性
蜜环菌子实体、液体发酵菌丝体、菌索乙醇提取物对4种供试细菌的抑制作用结果见表2.

表2 蜜环菌提取物抑菌活性Fig.2 Antibacterial activity of Armillariella mellea extracts
由表2可知,在1 g/mL质量浓度下,蜜环菌不同乙醇提取物对4种供试细菌的抑菌效果都不高,且对不同供试细菌作用效果不一致.子实体乙醇提取物对金黄色葡萄球菌、枯草芽孢杆菌的抑制效果好于产气杆菌、变形杆菌;液体发酵菌丝体提取物对变形杆菌的抑制效果稍好,对金黄色葡萄球菌、枯草芽孢杆菌次之,对产气杆菌的抑制效果最差;菌索提取物对枯草芽孢杆菌、产气杆菌的抑制作用好于变形杆菌,对金黄色葡萄球菌的抑制效果最差.
3 结论与讨论
本试验采用天然抗氧化剂抗坏血酸作为阳性对照,通过蜜环菌子实体、液体发酵菌丝体、菌索乙醇提取物和抗坏血酸几者之间抗氧化作用的比较,研究了蜜环菌不同材料乙醇提取物对DPPH·、·OH和3种自由基的清除能力,以及其对4种供试细菌的抑制作用.结果表明,蜜环菌提取物在质量浓度为1 g/mL的条件下,对金黄色葡萄球菌、产气杆菌、变形杆菌和枯草芽孢杆菌4种供试细菌的抑菌活性都不高,最大抑菌率仅达到15.77%.这可能与提取物浓度偏低有关,在高浓度条件下蜜环菌提取物对几种供试细菌及其他病原细菌的抑菌活性有待进一步研究.在不同浓度条件下,蜜环菌3种醇提物对DPPH·、·OH、和3种自由基都表现出较强的清除能力,且清除效果与浓度呈显著的正相关,但都低于相同浓度的阳性对照抗坏血酸.3种提取物对DPPH·的清除率最高,对O2-·的清除率最低,另外不同提取物对不同的自由基清除作用存在差异,可能是因为子实体、液体发酵菌丝体及菌索培养条件差异导致抗氧化活性成分不同.综上所述,蜜环菌多糖具有一定的抗氧化能力,可用于制备具有抗氧化活性的天然活性物质和开发蜜环菌多糖类药物及功能性食品,但在较高浓度下蜜环菌提取物的抗氧化活性、抗坏血酸的清除能力差异以及不同材料抗氧化活性物质仍需进行深入研究.
[1]卯晓岚.中国经济真菌[M].北京:科学出版社,1998.
[2]藏金平,袁生,连宾.蜜环菌的研究进展[J].微量元素与健康研究,2004,21(3):47-50.
[3]郑建仙.功能性食品[M].北京:中国轻工业出版社,1999.
[4]邹容,康冀川.蜜环菌研究进展[J].山地农业生物学报,2005,24(3):260-264.
[5]余晨晨.蜜环菌发酵产物有效成分的分离鉴定与活性研究[D].开封:河南大学,2011.
[6]Gadow A V,Joubert E,Hansmann C F.Comparison of the antioxidant activity of aspalathin w ith that of other plant phenols of rooibos tea(Aspalathus linearis) A-Tocopherol,BHT,and BHA[J].Journal of Agricultural and Food Chemistry,1997,45(3) :632-638.
[8]陈留勇,孟宪军,贾薇,等.黄桃水溶性多糖的抗肿瘤作用及清除自由基、提高免疫活性研究[J].食品科学,2004,25(2):167-170.
[9]SmironffN,Cumbes Q J.Hydroxyl radical scavenging activity ofcompatible solutes[J].Phytochemistry,1989,28(4) :1057-1060.
[10]吴慧平,孔令东,吴美娟,等.当归不同炮制品清除自由基和抗脂质过氧化作用[J].中国中药杂志,1996,21(10):599-601.

