京尼平及其衍生物的研究进展
陈河如, 罗 军, 黄 照, 杨 健
(暨南大学1.药学院中药及天然药物研究所;2.广东省中药药效物质基础及创新药物研究重点实验室,广东广州510632)
京尼平(genipin)是一种环烯醚萜化合物,是京尼平苷(geniposide)的苷元(见图1).京尼平及京尼平苷是栀子、杜仲和管花肉苁蓉[1]的主要药效成份.杜仲是杜仲科植物的干燥树皮,是一种名贵中药材,具有滋肝补肾、强筋骨、降血压和安胎等诸多功效,临床应用已有2 000年的历史;栀子属于茜草科植物.是我国盛产的一种中药材,具有利胆、保肝等功效,在我国应用于临床治疗也有1 600多年历史;栀子分为山栀子和水栀子,主要集中分布在江西、湖南、四川等地方.目前对京尼平苷的研究主要以杜仲为材料,对栀子中京尼平苷的研究和应用较少.
现代药理研究表明,京尼平及其糖苷具有保肝、利胆、镇痛、抗癌、降血糖、增强和改善学习等作用.此外,京尼平还被广泛用作生物交联剂.欧阳冬生等[2]已经对京尼平及其糖苷在保肝利胆、抗炎、抗肿瘤方面进行了综述,本研究拟进一步综述京尼平及其衍生物在抗老年痴呆、生物交联剂、抗血栓、降血糖和抗肿瘤作用方面的最新进展.

图1 京尼平及其糖苷的化学结构式Fig.1 Chemical structures of genipin and geniposide
1 抗老年痴呆
在传统中药中,栀子很早就应用于益智开窍,缓解老年痴呆,比如黄连解毒汤,其主要处方为黄连、黄柏、黄芩、栀子.2004年,丁永芳等[3]申请了该处方应用于治疗老年痴呆的作用;2008年,陈勇毅等[4]申请了一项专利:公布了一种治疗血管性痴呆的中药颗粒制剂及其制备方法,该颗粒剂处方为柴胡、白芍药、丹参、栀子、黄芪和三七;王昀等[5]报道,栀子辅以黄芪、丹参等药材,组成解毒通络方,药理学实验结果显示该方能显著提高脑缺血损伤后大鼠学习记忆能力.李澎涛等[6]申请的专利称:以栀子和三七总皂苷组成的一种中药组合物可有效阻抑Aβ40和Aβ42的过度产生,阻断淀粉样蛋白沉积,保持钙离子稳态调节,阻抑淀粉样斑块引起的氧化损伤、非特异性炎症反应和代谢毒性物质对神经细胞的继发性损害,从而解除病变的发生和发展,减轻迟发性神经细胞死亡和皮层萎缩,对阿尔茨海默症具有显著的治疗效果.
随后的研究发现,栀子中抗老年痴呆的有效成分为京尼平和京尼平苷.2009年,姚新生等[7]利用转基因痴呆果蝇模型筛选栀子中的有效部位,证实了京尼平和京尼平苷对改善转基因痴呆果蝇的学习记忆能力有显著的作用.
目前认为,Alzheimer病的β类淀粉样肽(Aβ)在大脑易感区域尤其是海马及皮质区沉积,是导致Alzheimer病的主要原因.Yamazaki等[8]对体外培养的海马神经元细胞研究证实,20~40 μmol/L浓度的京尼平能明显抑制Aβ引起的细胞毒性反应,且呈量效关系.由于京尼平可透过靶细胞膜,直接保护海马神经元免受Aβ的危害,将有可能研发成为治疗Alzheimer病的临床药物.Yamazaki研究组的研究表明,京尼平可拮抗创伤和东莨菪碱所引起的小鼠记忆障碍.5 mg/L的京尼平可诱导细胞轴突生长,其对PC12h细胞的神经营养作用机制可能是通过提高神经元型NO合成酶活性,使NO生成增加从而激发有丝分裂原蛋白激酶(MAPK)级联反应的发生[9].近来研究表明,京尼平可能通过 NO-cGMPPKG信号通路传导使细胞外信号调节激酶磷酸化从而激发MAPK级联反应起作用[10].
Masayuki等[11]认为,展开的或折叠的蛋白质在内质网腔中的积累会导致内质网压力,而持续的内质网压力将导致细胞死亡.正是这两种原因,才使GRP78(葡萄糖调节蛋白)、CCAAT增强子结合蛋白、GADD153同源蛋白被激活.研究已经证明内质网压力将导致神经退行性疾病,例如老年痴呆症,帕金森综合症和聚谷氨酸疾病.Masayuki等已经证明,京尼平对β类淀粉诱导细胞毒素具有保护作用.Masayuki通过利用衣毒素产生的细胞毒素来证明京尼平对神经细胞具有保护作用.此外,京尼平能够抑制CHOP和GRP78导致的内质网压力的上调.这些都表明,京尼平对神经性退行病具有一定的治疗作用.
不过,京尼平在生理溶液中很不稳定,影响了其实际应用.因此,SUZUKI等[12]将京尼平 1-位的半缩醛结构改造为缩醛结构,并且发现1-位为R-构型,基团为异丙氧基时(1-isopropyloxygenipin,图2)对PC12细胞的神经毒性保护作用最佳.陈河如等[13]进一步将京尼平改造为更加稳定的环烯内酰胺(gardenamide A,图2),并且揭示,在多个PC12细胞毒化模型中,其神经毒性保护作用比京尼平要强,而且能够同时作用于一氧化氮合成酶(NOS)中的nNOS和 iNOS.

图2 稳定的京尼平衍生物Fig.2 Stable genipin derivatives
2 生物交联剂
随着现代医学技术和生物技术的不断发展,异体、异种生物组织的应用变得越来越广泛.许多异种生物组织,如心脏瓣膜、血管以及韧带等,已经被普遍的应用于各种移植手术中.根据以往的研究表明,京尼平能自发地与氨基酸或蛋白质发生反应并形成蓝色色素,这种蓝色素中最简单的复合物是一个1∶1的化合物.据此推测,京尼平首先与氨基酸反应生成一个环烯醚萜的氮化物,随后经过一个脱水作用形成一个芳香族的单体,之后这一芳香族的单体可能由于基于自由基反应的二聚作用而形成环状的分子间和分子内交联结构[14-15].京尼平交联物对动物和人细胞没有细胞素性,因此它被应用于很多方面,例如,糖尿病,牙周炎,白内障,肝功能缺陷,神经的修复再生等[16].
在一系列的体外测试中,与使用戊二醛进行交联处理的生物制品相比,京尼平交联处理后制品的变性温度略低一些[17].细胞毒性通常包括交联剂本身的细胞毒性及其交联制品的细胞毒性.细胞毒性的高低,对于植入性交联制品与宿主组织之间的相容性有着很大的影响.显而易见,细胞毒性越低的交联剂和它所交联的生物组织,它们的组织相容性就越好.在植入宿主体内后,它们所引发的炎性反应程度就越轻;从另一方面讲,减轻了炎性反应程度等于加速了宿主组织的生长和愈合.与目前使用的各种交联剂相比较,京尼平作为交联剂的最大优点就是低细胞毒性,各项试验的结果也说明了这一点.通过MTT试验测定的交联剂的细胞毒性显示,京尼平的细胞毒性比戊二醛要小10 000倍.而通过细胞集落形成试验测定的细胞毒性显示,暴露于京尼平的细胞的增殖能力大约是同样暴露于戊二醛的细胞的5 000倍.在对交联制品的试验中,无论所使用的戊二醛的浓度为多少,戊二醛交联制品上所接种的细胞无一存活;然而,在培养3 d后,京尼平交联制品上就布满了3T3细胞,而且还观察到了由这些细胞所产生的新生胶原纤维[18].显而易见,以京尼平作为生物交联剂具有更好的生物相容性和更低的细胞毒性.
因此,在生物医药材料领域,京尼平作为生物交联剂正得到越来越多的应用.比如,利用京尼平的开环聚合反应固定胶原蛋白水凝胶[19];通过京尼平的交联改进海藻酸钠胶囊的生物相容性[20];在软骨缺陷的修复方面,以京尼平交联制备的软骨基质作为骨架诱导干细胞生长能够减少其他材料所引起的收缩问题[21];而以京尼平交联的含羟基磷灰石壳聚糖纳米纤维被证实为性能优越的生物复合材料,成骨细胞可以在这些材料上增殖、分化和成熟化[22].
京尼平发挥交联作用的机制都与1-位半缩醛的反应活泼性有关.比如,京尼平可以开环形成醛,然后经由羟醛缩合反应聚合,并与胶原蛋白交联(图 3)[19].
3 抗血栓
SUZUKI Y等[23]用光化学反应诱导ICR雄性小鼠股动脉4.6 min,可使小鼠股动脉被富集的血小板阻塞.静脉注射20~40 mg/(kg·min)京尼平苷可剂量相关地推迟阻塞时间.京尼平10~20 mg/(kg·min)也以剂量相关方式推迟阻塞时间,与阿司匹林10和30 mg/(kg·min)的作用强度相似.体外研究显示,京尼平和京尼平苷均能抑制胶原诱导的血小板凝集并呈剂量相关,其作用强于阿司匹林.但它们不能抑制花生四烯酸诱导的血小板凝集,而阿司匹林则具有此类抑制作用.京尼平苷不能抑制ADP诱导的血小板凝集,而京尼平和阿司匹林显示弱的抑制作用.当京尼平苷和马兜铃酸(对照药)的剂量分别为77和0.3 mmol/L时,其对磷脂酶A2(PLA2)的抑制率分别为43.5%和32.3%,京尼平对PLA2的作用未测定.京尼平是京尼平苷的苷元,结构上的区别是在1位上是否结合一个单糖(见图1),但在抗血栓的药理作用上存在差别.它们两者之间是否存在协同作用是一个值得进一步研究的问题.
京尼平及其糖苷在抗血栓方面的作用得到ZHANG等[24]的证实,他们利用多个血栓模型揭示了京尼平及其糖苷具有显著的抗血栓活性,而且安全性也比较高,可用于血栓疾病的治疗.
另外,利用京尼平固定的无细胞异种血管嫁接可以排除血栓的形成[25].在许多利用京尼平交联而成的其他生物功能材料也发现可以防止血栓形成的效果[26-28].
4 降血糖
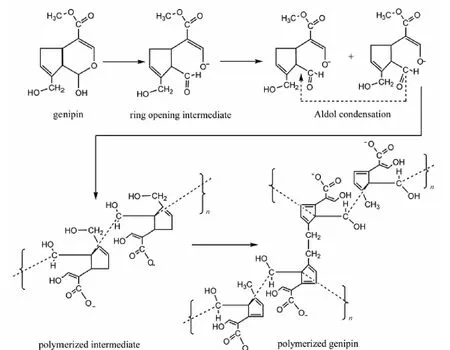
图3 京尼平的开环聚合交联.摘自文献[19].Fig.3 Ring-opening polxmerization cross-linkage of genipin.copied from literature[19]
据《本草纲目》记载,栀子具有解5种黄病、利五淋、通小便、解消渴和明目的功效,其中消渴即为现代中医理论的糖尿病[29].KIMURA 等[30]报道,京尼平苷具有拟胆囊收缩素样作用,表明京尼平苷可能跟拟胆囊收缩素一样具有降血糖作用.谢文利等[31]采用京尼平苷对链脲菌素诱导的糖尿病模型大鼠的糖耐量、血糖、血脂的影响进行了研究,发现连续给药1周后,高、中、低3个剂量(分别为100、50、20 μg/mL)的京尼平苷在负荷蔗糖后 0.5 h,均可显著提高大鼠蔗糖耐糖量,降低负荷蔗糖后机体的血糖值;同时,京尼平苷还可以显著降低链脲佐菌素诱发的糖尿病模型大鼠的血糖值,且呈剂量依赖性;WU等[32]的研究发现,栀子苷(200和400 mg/kg)可以以剂量依赖的方式显著的使糖尿病小鼠的血糖含量、胰岛素浓度及总胆固醇和甘油酸三酯下降.GP和G6Pase在mRNA和免疫反应蛋白水平上降低表达,GP和G6Pase的酶活力也得到了降低.因此,它可能是通过多水平抑制 GP和 G6Pase的活性来实现降血糖的效应.
WANG等[33]采用荧光标记单核细胞法检测黏附细胞,结果表明,栀子苷(10~20 μmol/L)以剂量依赖的方式阻止高血糖(33 mmol/L)引起的白细胞黏附在血管内皮上.RT-PCR(实时 PCR)和 ELI SA(酶联免疫吸附剂测定)法检测发现,栀子苷(5~40 μmol/L)也在基因和蛋白水平上阻止高血糖感应的VCAM-1和E-selectin的表达.另外,栀子苷(5~20 μmol/L)处理细胞后,检测到 NF-κB 和 NI-κB 抑制因子数量的变化,显示栀子苷的作用不仅可以降低活性氧的产生,还可以阻止NI-κB在胞浆中的下降和NF-κB从HUVECs(人脐静脉内皮细胞)胞浆中迁移到细胞核中,从而抑制了CAMs基因的表达.有研究[34]揭示,与健康小鼠相比,糖尿病模型小鼠的海马解偶联蛋白2(UCP2)的mRNA高表达,而口服不同剂量的京尼平进行干预,下丘脑和海马的UCP2水平呈非线性下降,这也是京尼平具有降糖作用的机制之一;另一份研究表明,京尼平能够抑制线粒体中UCP2的表达并减缓糖尿病小鼠的足损伤[35].
另外,已经证实,京尼平苷是胰高血糖素样肽1受体(GLP-1 receptor)的激动剂[36],而 GLP-1受体与糖尿病和老年痴呆病的发病机制相关,可以作为研发治疗此类疾病新药的靶标.可见,京尼平苷具有一定的降糖作用,有可能以其作为先导化合物,研发降糖新药.
5 抗肿瘤作用
癌细胞是由正常细胞变异而来,具有无限生长、转化和转移的特点.如何使癌细胞凋亡或抑制其转移是癌症治疗的重点.CAO等[37]发现,平以剂量依赖性的方式通过细胞凋亡通路感应希拉细胞的死亡.京尼平可以显著的诱发希拉细胞的细胞毒性,并且阻止它的增殖.通过对DNA碎片的分析和对G1期细胞的血细胞法计数,结果显示,京尼平可以使希拉细胞停滞在G1期.Western-blot分析也表明,在京尼平以剂量给药的方式24 h后,磷酸化的c-Jun氨基端激酶(J NK)、Jun磷酸蛋白、p53蛋白、bax蛋白显著升高.JNK的活化可能导致p53蛋白水平的升高,p53蛋白水平的升高又导致bax蛋白的积累,bax蛋白最终感应细胞的凋亡.所以京尼平有望研究成为一种新型的抗癌药.
基质金属蛋白酶(MMPs)几乎能降解细胞外基质中的各种蛋白成分,破坏肿瘤细胞侵袭的组织学屏障,在肿瘤侵袭转移中起关键性作用,从而在肿瘤浸润转移中的作用日益受到重视,被认为是该过程中主要的蛋白水解酶.戊乙酰去羟栀子苷[(Ac)5GP]是栀子苷乙酰化的产物,HUANG及同事报道[38]了(Ac)5GP对大鼠母神经细胞系(C6胶质细胞瘤系)的侵袭效应的影响.结果显示,首先,(Ac)5GP表现出对细胞黏附和运动能力的抑制;其次,经(Ac)5GP作用后,基质金属蛋白酶-2(MMP-2)的活性下降.进一步的分析显示,MMP-2在mRNA水平上和膜I型基质金属蛋白酶显著降低,而金属蛋白酶组织抑制因子(TIMP-2)由于(Ac)5GP的作用升高了.另外,过去的一些研究证明,PI3K(磷酸肌醇3激酶蛋白),NF-κB在MMPs的活化中扮演重要角色.(A c)5GP对PI3K的表达,胞外信号调节激酶1和2,转录因子核因子kb(NF-B),转录因子c-Jun都起抑制作用.这些发现证明(Ac)5GP在将来极有可能成为抑制癌症细胞转移的抑制剂.
有研究表明[39],京尼平在非毒性剂量能够抑制肝癌细胞HepG2和MHCC97L的移动性和入侵性,这可能与京尼平能够抑制MMP-2在细胞的活性有关,因为京尼平能够特异性地上调TIMP-1的表达,而TIMP-1是MMP-2的内源性抑制剂.
除了肝癌细胞,京尼平对乳腺癌细胞MDA-MB-231同样具有显著的增殖抑制作用[40].其作用机制是通过下调Bcl-2、上调Bax和Caspase-3,诱导肿瘤细胞的凋亡,京尼平同时提升JNK和p38 MAPK的活性.更为重要的是,京尼平能够显著抑制原代MDA-MB-231细胞的入侵与迁移.
多个研究表明,京尼平能够抑制 UCP2的表达[34-35].而根据 Donadelli等[41]的实验结果,线粒体中的UCP2对吉西他滨(gemcitabine)的肿瘤耐药性起关键作用.从这个方面讲,京尼平能够消除肿瘤细胞对一些药物的耐药作用,可以作为增效药物(图4).

图4 京尼平可以增加抗癌药物吉西他滨的抗肿瘤效果.摘自文献[41]Fig.4 Genipin enhances antitumor effects of Gemcitabine.copied from lit.[41].
6 结束语
京尼平及其衍生物具有广泛的药理作用,除了本研究及文献[2]所述及的药理作用外,京尼平苷的衍生物京尼平苷酸可能有一定的催眠作用[42].不过,京尼平和京尼平苷发挥药理作用的药效结构还没有得到阐明.为此,本文作者已在这方面展开研究[13,43],并将进一步利用计算机辅助药物设计技术对其进行合理的药物设计和改造,以研发出具有自主知识产权的临床先导药物.鉴于我国栀子的种植面积很大,杜仲是我国独有的名贵药材,对其药效成分的深度开发将带来可观的社会效益和经济效益.
[1]雷 丽,宋志宏,屠鹏飞.肉苁蓉属植物的化学成分研究进展[J].中草药,2003,34(5):473-476.
[2]史卉研,何 鑫,欧阳冬生,等.京尼平苷及其衍生物的药效学研究进展[J].中国药学杂志,2006,41(1):4-6.
[3]丁永芳,李建英.一种用于治疗老年性痴呆和血管性痴呆的新的药用组合物及其制法[P].中国专利,200410014360.3.
[4]陈勇毅,黄飞华,高家鉴.一种治疗血管性痴呆的中药颗粒制剂及其制备方法[P].中国专利,200810062443.
[5]王 昀,索 林,刘新民,等.解毒通络方对脑缺血损伤后大鼠学习记忆能力的影响[J].中临床康复,2006,10(23):36-39.
[6]李澎涛,申 勇,华 茜.一种治疗阿尔茨海默症的中药组合物及其制备方法[P].中国专利,200710062879.2.
[7]YU Y,XIE Z L,GAO H,et al.Bioactive Iriodoid Glucosides from the Fruit of Gardenia jasminoides[J].J Nat Prod,2009,8(72):1459 -1464.
[8]YAMAZAKI M,SAKULA N,CHIBA K,et al.Prevention of the neurotoxicity of the amyloid β protein by genipin[J].Biol Pharm Bull,2001,24(12):1454 -1455.
[9]YAMAZAKI M,CHIBA K,MOHRI T,et al.Activation of the mitogen-activated protein kinase cascade through nitric oxide synthesis as a mechanism of neuritogenic effect of genipin in PC12h cells[J].Neurochem,2001,79(1):45-54.
[10]YAMAZAKI M,CHIBA K,MOHRI T,et al.Cyclic GMP-dependent neurite outgrowth by genipin and nerve growth factor in PC12h cells[J].Eur J Pharmacol,2004,488:35-43.
[11]TANAKA M,YAMAZAKI M,CHIBA K.Neuroprotective action of genipin on tunicamycin-induced cytotoxicity in Neuro2a cells[J].Biol Pharm Bull,2009,32(7):1220-1223.
[12]SUZUKI H,YAMAZAKI M,CHIBA K,et al.Neuritogenic activities of 1-Alkyloxygenipins[J].Chem Pharm Bull,2010,58(2):168 -171.
[13]LUO J,WANG R,HUANG Z,et al.Synthesis of stable genipin derivatives and studies of their neuroprotective activity in PC12 cells[J].ChemMedChem,2012,7:1661-1668.
[14]SUNG H W,CHANG Y,CHIU C T,et al.Mechanical properties of a porcine aortic valve fixed with a naturally occurring crosslinking agent[J].Biomaterials,1999,20(19):1759-1772.
[15]HUANG L L H,SUNG H W,TSAI C C,et al.Biocompatibility study of a biological tissue fixed with a naturally occurring crosslinking reagent[J].Biomed Mater Res,1998,42(4):568-576.
[16]RICCARDO A,MUZZARELLI A.Genipin-crosslinked chitosan hydrogels as biomedical and pharmaceutical aids[J].Carbohydrate Polymers,2009,77:1 -9.
[17]CHANG Y,TSAI C C,LIANG H C,et al.In vivo evaluation of cellular and acellular bovine pericardia fixed with a naturally occurring crosslinking agent(genipin)[J].Biomaterials,2002(12),23:2447-2457.
[18]SUNG H W,HUANG R N,HUANG L L H.In vitro evaluation of cytotoxicity of a naturally occurring crosslinking reagent for biological tissue fixation[J].Biomater Sci Polymer Edn,1999,10(1):63-78.
[19]MU C,ZHANG K,LIN W,et al.Ring-opening polymerization of genipin and its long-range crosslinking effect on collagen hydrogel[J].J Biomed Mat Res A,2013,101A(2):385-393.
[20]HILLBERG A L,KATHIRGAMANATHAN K,LAM J B B,et al.Improving alginate-poly-L-ornithine-alginate capsule biocompatibility through genipin crosslinking[J].J Biomed Mat Res B,2013,101(2):258-268.
[21]CHENG NS-C,ESTES B,YOUNG T-H,et al.Genipincrosslinked cartilage-derived matrix as a scaffold for human adipose-derived stem cell chondrogenesis[J].Tissue Eng A,2013,19(3/4):484-496.
[22]FROHBERGH M E,KATSMAN A,BOTTA G P,et al.Electrospun hydroxyapatite-containing chitosan nanofibers crosslinked with genipin for bone tissue engineering[J].Biomaterials,2012,33(36):9167 -9178.
[23]SUZUKI Y,KONDO K,IKEDA Y.Antithrombotic effect of geniposide and genipin in the mouse thrombosis model[J].Planta Med,2001,67(9):807 -810.
[24]ZHANG H Y,LIU H,YANG M,et al.Antithrombotic activities of aqueous extract from Gardenia jasminoides and its main constituent[J].Pharm Biol,2013,51(2):221-225.
[25]CHANG Y,HSU C K,WEI H L,et al.Cell-free xenogenic vascular grafts fixed with glutaraldehyde or genipin:In vitro and in vivo studies[J].J Biotech,2005,120(2):207-219.
[26]WEI H,CHEN S,CHANG Y,et al.Porous acellular bovine pericardia seeded with mesenchymal stem cells as a patch to repair a myocardial defect in a syngeneic rat model[J].Biomaterials,2006,27(31):5409 -5419.
[27]CHANG Y,CHEN S C,WEI H J,et al.Tissue regeneration observed in a porous acellular bovine pericardium used to repair a myocardial defect in the right ventricle of a rat model[J].J Thor & Card Surg,2005,130(3):705-711.
[28]CHANG Y,TSAI C C,LIANG H C,et al.Reconstruction of the right ventricular outflow tract with a bovine jugularvein graftfixed with a naturally occurring crosslinking agent(Genipin)in a canine model[J].J Thor& Card Surg,2001,122(6):1208-1218.
[29]那 莎,郭国田,王宗殿.栀子及其有效成分药理研究进展[J].中国中医药信息杂志,2005,12(1):90-92.
[30]KIMURA Y,OKUDA H,ARICHI S.Effect of geniposide isolated from gardenia jasminoides on metabolic alterations in high sugar diet-fed rats[J].Chem Pharm Bull,1982,30:4444-4447.
[31]谢文利,李宏捷,晋玉章.京尼平苷的降血糖作用研究[J].武警医学院学报,2008,17(7):580-581.
[32]WU S Y,WANG G F,LIU Z Q.Effect of geniposide,a hypoglycemic glucoside,on hepatic regulating enzymes in diabetic mice induced by a high-fat diet and streptozotocin[J].Acta Phar Macol Sin,2009,30(12):202 -208.
[33]WANG G F,WU S Y,WU W.Genipoxide inhibits high glucose-induced cell adhesion through the NF-κB signaling pathway in human umbilical vein endothelial cells[J].Acta Pharmacologica Sinica,2010,31:953 -962.
[34]姚志文,张 鹏,孙高慧,等.UCP2在糖尿病小鼠下丘脑和海马中表达的差异[J].江苏医药,2012,38(6):638-640.
[35]QIU W,ZHOU Y,JIANG L,et al.Genipin inhibits mitochondrial uncoupling protein 2 expression and ameliorates podocyte injury in diabetic mice[J].PLOS ONE,2012,7(7):1-9.
[36]LIU J,YIN F,ZHENG X,et al.Geniposide,a novel agonist for GLP-1 receptor,prevent PC12 cells from oxidative damage via MAP kinase pathway[J].Neurochem Int,2007,51:361 -369.
[37]CAO H L,FENG Q,XU W.Genipin induced apoptosis associated with activation of the c-IUN NH2-terminal kinase and p53 protein in HeLa cells[J].Biol Pharm Bull,2010,33(8):1343 -1348.
[38]HUANG H P,SHIH Y W,WU C H.Inhibitory effect of penta-acetylgeniposide on C6 glioma cells metastasis by inhibiting matrix metalloproteinase-2 expression involved in both the PI3K and ERK signaling pathway[J].Chemicobiol Interactions,2009,181:8-14.
[39]WANG N,ZHU M,TSAO S W,et al.Up-Regulation of TIMP-1 by genipin inhibits MMP-2 activities and suppresses the metastatic potential of human hepatocellular carcinoma[J].PLOS ONE,2012,7(9):1 -11.
[40]KIM E S,JEONG C S,MOON A.Genipin,a constituent of Gardenia jasminoides Ellis,induces apoptosis and inhibits invasion in MDA-MB-231 breast cancer cells[J].Oncol Reports,2012,27(2):567 -572.
[41]POZZA E D,FIORINI C,DANDO I,et al.Role of mitochondrial uncoupling protein 2 in cancer cell resistance to gemcitabine[J].Biochimica et Biophysica Acta,2012,1823(10):1856-1863.
[42]廉小梅,朱文学,白喜婷.杜仲雄花茶中活性成分的测定及催眠作用的药理研究[J].食品科技,2007,3:203-206.
[43]黄 照,罗 军,陈河如,等.栀子药效成分京尼平的结构改造[J].中国药物化学杂志,2011,21(3):204-207.

