组蛋白去乙酰化酶6介导血清饥饿条件下LC3B-II的去乙酰化作用
刘坤鹏, 王 遥, 徐丽慧, 潘 浩, 欧阳东云, 何贤辉
(暨南大学生命科学技术学院1.免疫生物学系;2.细胞生物学系,广东广州510632)
在真核生物中,自噬是一种进化上保守的胞内蛋白降解机制.在营养缺乏或应激条件下,细胞通过启动自噬来清除胞质内错误折叠的蛋白质、脂类、入侵的病原体以及受损的细胞器,达到回收代谢物质以重新利用、降低活性氧(reactive oxygen species,ROS)的伤害、修复DNA损伤的目的.通过自噬途径的降解,蛋白质和受损的细胞器被运送至溶酶体,最终消化为氨基酸和葡萄糖等营养物质,被细胞再利用以度过营养缺乏时期[1].Boland 和 Nixon 等[2]报道在阿尔茨海默病患者脑组织细胞中,有大量的、不正常、非成熟的自噬体堆积,并据此推测患者脑细胞内自噬降解通路可能受到抑制.由于其清理受损细胞器和失活蛋白的能力,通过诱导细胞发生自噬已经成为治疗帕金森症和阿尔兹海默症的有效策略.此外,对于肿瘤细胞来说,自噬是其对抗营养缺乏和药物的重要手段,细胞自噬依赖的抗药性也是癌症复发的重要原因[3].
近年来,对于细胞自噬的调控及其通路蛋白的研究越来越多,但是对于翻译后修饰调控自噬的研究较少.蛋白质乙酰化是一种重要的蛋白活性调控手段,近期也有一些研究关注这一领域.乙酰基转移酶P300能修饰Atg5、Atg7、Atg8和Atg12等自噬通路蛋白,这些蛋白的乙酰化会抑制自噬的进行[4].在血清饥饿环境中,细胞内的糖原合成激酶-3通过磷酸化修饰乙酰基转移酶TIP60的86位丝氨酸而激活 TIP60;活化的 TIP60激活 UNC51样激酶(ULK1),从而诱导自噬的发生[5].由此可见,乙酰化修饰是调控细胞自噬的重要机制.
组蛋白去乙酰化酶(HDAC)可分为Ⅰ类(HDACs 1-3和8)、Ⅱ类(HDACs 4-7,9,和10)、Ⅲ类(Sirts 1 -7)、Ⅳ类(HDAC11)[6].HDAC6 是一种胞浆内去乙酰化酶,能够调控微管蛋白第40位赖氨酸的去乙酰化.本研究重点探讨自噬相关蛋白微管相关蛋白1轻链3(microtubule-associated protein 1 light chain 3,LC3)在血清饥饿环境中的乙酰化变化及其与HDAC6的关系,并初步探讨了LC3的乙酰化对自噬降解能力的影响.
1 材料和方法
1.1 试剂和材料
氯喹(CQ)、雷帕霉素、Tubacin和Hoechst33342购自Sigma-Aldrich.DMEM培养基、抗生素和胎牛血清均购自Invitrogen.PVDF膜和琼脂糖凝胶A蛋白联接珠子购自GE Healthcare Life Sciences.ECL试剂、细胞裂解缓冲液购自碧云天.泛乙酰化抗体、抗乙酰化 α-tubulin、α-tubulin、LC3B、p62/SQSTM1 等兔源单克隆抗体购自Cell Signaling Technology,HRP标记的山羊抗兔IgG二抗购自中杉金桥.其余试剂均为进口分装或国产分析纯.HeLa细胞购自中国科学院上海细胞库,使用含有体积分数为10%的胎牛血清、100 U/mL青霉素和 100 μg/mL链霉素的DMEM培养基培养,置于细胞培养箱(体积分数5%CO2、37 ℃).
1.2 方法
(1)血清饥饿诱导自噬 按文献[5]使用加入双抗的无血清DMEM培养基处理HeLa细胞8 h诱导自噬.为验证HeLa细胞的自噬流量是否发生了变化,使用含CQ(25 μmol/L)的DMEM培养基培养细胞8 h.HeLa细胞使用六孔板培养,每孔接种细胞数量为5×105,培养24 h后用于实验.乙酰化抑制组使用含Tubacin(2 μmol/L)的DMEM培养基培养细胞8 h.HeLa细胞使用六孔板培养,每孔接种细胞数量为5×105,培养24 h后用于实验.
(2)蛋白提取 在检测血清饥饿诱导自噬的效率的实验中,按照文献[7]的方法,使用含有DTT的上样缓冲液提取细胞蛋白,以检测LC3B的总体水平变化.其余蛋白提取方法根据文献[8],使用RIPA裂解液裂解细胞,离心后收集上清,用于免疫印迹和免疫沉淀的检测.
(3)免疫印迹分析 收获处理过的HeLa细胞,用PBS清洗2次,加入细胞裂解液,超声破碎,得到蛋白样品、经十二烷基硫酸钠-聚丙烯酰胺凝胶(SDS-PAGE)电泳,将分离胶上的蛋白质转移至PVDF膜上,5%质量分数的脱脂牛奶封闭1 h,加入抗体于4℃孵育过夜,再加HRP标记的山羊抗兔IgG孵育1 h,加入ECL底物,暗室中X光片曝光.所有实验图片都是基于3次独立的实验获得,并使用AlphaEaseFC软件分析灰度,分析结果以相对比率的形式表示.
(4)免疫荧光显微术 按文献[9]中的方法,将HeLa细胞接种于直径15 mm玻璃底细胞培养皿,每皿接种3×104个细胞,经24 h完全培养基培养后进行血清饥饿或药物处理,然后以体积分数4%的多聚甲醛固定细胞,并以体积分数100%甲醇通透细胞.使用相应单克隆抗体和CF568/CF488标记的羊抗兔 IgG孵育通透后的细胞,以 Hoechst33342染核.利用Leica DMIRB荧光显微镜观察并记录细胞内的荧光图像.所有实验图片都是基于3次独立的实验获得.
(5)免疫沉淀 按文献[10]中的方法,将200 μg的HeLa细胞蛋白提取物与LC3B抗体混匀,4℃孵育过夜.加入30 μL、体积分数为50%的蛋白A联接琼脂糖珠,4℃孵育2 h.免疫复合体用裂解缓冲液冲洗5次,加入2×上样缓冲液,沸水浴5 min,使用免疫印迹(WB)方法,以泛乙酰化抗体检测LC3B的乙酰化修饰程度.所有实验图片都是基于3次独立的实验获得.
(6)统计学方法 采用SPSS 13.0统计软件处理数据,计量资料以(均数±标准差)表示,P<0.05有统计学意义.
2 结果
2.1 血清饥饿诱导HeLa细胞发生自噬
自噬发生后,LC3B-I定位于自噬小体膜上形成与磷脂酰乙醇胺(PE)结合的LC3B-II和LC3斑点,因此LC3B-I和LC3B-II量的变化和LC3斑点的形成是自噬发生的重要标志[11].通过免疫印迹(WB)和免疫荧光法分别检测LC3B-II的变化和LC3B斑点的形成,可以检测血清饥饿是否诱导自噬发生.WB结果显示,与对照组(0 h)相比,在无血清DMEM处理细胞8 h后,LC3B-II的水平达到最大(图1A).使用溶酶体抑制剂CQ处理后,8 h无血清培养的细胞内LC3B-II含量更高(图 1B),说明确实发生了自噬[12].免疫荧光结果显示,8 h无血清培养基处理后,HeLa细胞内形成了大量LC3斑点(图 1C).因此,8 h血清饥饿能够诱导HeLa细胞发生自噬.

图1 血清饥饿诱导HeLa细胞发生自噬Fig.1 Serum-starvation induced autophagy in HeLa cells
2.2 血清饥饿诱导的自噬伴随LC3B-II乙酰化修饰程度的降低
血清饥饿诱导的自噬发生时,LC3B的乙酰化修饰程度是否发生变化尚不清楚.利用LC3B抗体沉淀样品中的LC3B,然后用泛乙酰化抗体检测LC3B的乙酰化修饰程度.如图2A所示,在血清饥饿处理后,细胞内LC3B-II的乙酰化修饰程度大幅下降,而LC3B-I的乙酰化修饰程度却并未发生明显变化.血清饥饿条件下,以Tubacin处理细胞,以抑制细胞内的HDAC6催化活性[13].如图2A所示,使用Tubacin处理细胞后,细胞内LC3B-II的乙酰化修饰程度回升.这表明血清饥饿条件下,抑制HDAC6的活性可以阻止LC3B-II乙酰化基团的去除,即HDAC6是LC3B-II去乙酰化的调控蛋白之一.同时,由于α-Tubulin的乙酰化修饰能够被HDAC6去除[14],因此检测其乙酰化修饰程度可验证 Tubacin的抑制效果.如图2B,Tubacin对于HeLa细胞内的HDAC6的抑制作用非常明显.
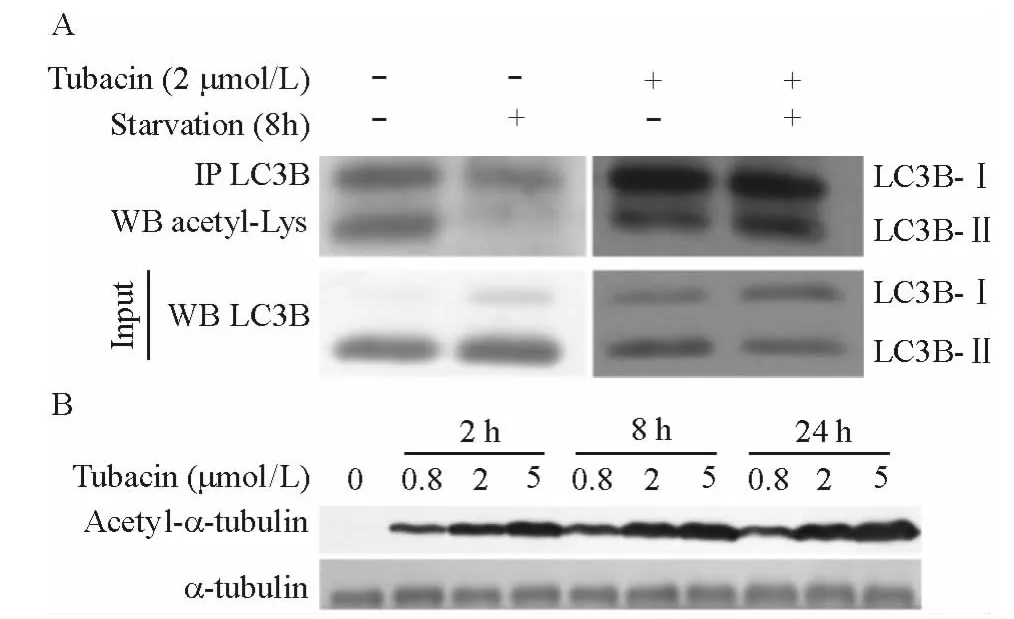
图2 血清饥饿条件下LC3B的乙酰化修饰程度分析Fig.2 Analysis of acetylated LC3B in serum-starvation conditions
2.3 抑制HDAC6去乙酰化阻止p62/SQSTM1的降解
根据文献报道,饥饿诱导的自噬发生后,p62/SQSTM1的水平下降[8].为了检测LC3B-II的高乙酰化修饰程度是否影响细胞自噬,我们以 p62/SQSTM1为标志,检测了Tubacin处理的HeLa细胞在自噬条件下降解蛋白质的能力.如图3A和B所示,血清饥饿诱导的自噬发生后,p62/SQSTM1的水平发生下降.使用Tubacin抑制HDAC6去乙酰化酶活性后,p62/SQSTM1的水平回升.这说明血清饥饿条件下抑制HDAC6会减弱细胞自噬对蛋白质的降解.即使使用Tubacin抑制HDAC6的去乙酰酶活性,也不能阻止细胞内自噬小体的形成(图3C).这表明血清饥饿条件下,HDAC6被抑制后,自噬通路降解蛋白能力的下降可能是由于自噬小体未能与溶酶体融合所致.
3 讨论
自噬是调节细胞内自稳的一个重要途径,也是细胞应对外界压力的主要存活机制[1].血清内的多种细胞因子对于细胞生长来说是必不可少的,缺少细胞因子的刺激,会激活细胞内的自噬途径.近年来,自噬的调节受到了越来越多的关注,而乙酰化是调节自噬机制的重要调控方式[15].本研究以无血清培养基处理的HeLa细胞为对象,成功地建立了血清饥饿诱导的HeLa细胞自噬模型.此外,我们还利用泛乙酰化抗体检测LC3B的乙酰化修饰程度,发现在自噬发生后,细胞内的LC3B-II的乙酰化修饰程度显著下调.通过Tubacin抑制HDAC6的去乙酰化酶活性,我们发现LC3B-II的乙酰化修饰程度迅速回升.抑制HDAC6的活性,增加LC3B-II的乙酰化修饰程度能降低自噬途径的蛋白降解能力.此外,当使用血清饥饿和Tubacin同时处理HeLa细胞时,如图3A所示,p62/SQSTM1的水平下降,表明自噬途径的蛋白降解能力得到回升,这说明抑制HDAC6并不能完全限制自噬途径的蛋白质降解.因此,本研究为理解HDAC6在自噬诱导中的作用提供了一个新的方向.

图3 Tubacin对于自噬途径降解蛋白能力的影响Fig.3 Influence of Tubacin in autophagic degradation of proteins
在近年来的研究中,有以下两种可能的机制解释HDAC6对于自噬诱导的作用.第一种是HDAC6可能降低HSP90的乙酰化修饰程度来激活它,从而促进HSP90结合的配体蛋白释放,进而促进这些配体蛋白的降解[16].第二种是HDAC6作为接头蛋白,识别结合待降解的蛋白质,并将其运送至自噬小体形成的部位[17].然而,对于HDAC6去乙酰化酶活性在自噬中的作用,研究不多.本研究的结果表明,HDAC6的去乙酰化酶活性作用于LC3B-II,从而参与调控细胞自噬.
总之,本研究验证了在血清饥饿诱导的自噬发生时,LC3B-II的乙酰化修饰程度降低,抑制其乙酰基团的修饰将导致自噬途径蛋白降解能力的下调.近来的研究表明,乙酰化和去乙酰化修饰可能是调控细胞信号网络的一个重要方式,同时也是一个新兴的研究领域.HDAC6介导的自噬通路蛋白乙酰化修饰的变化可能是调节自噬降解蛋白的重要途径,同时也为诱导或抑制自噬治疗疾病的策略提供潜在的靶点.
[1]MIZUSHIMA N,LEVINE B.Autophagy in mammalian development and differentiation[J].Nat Cell Biol,2010,12(9):823-830.
[2]BOLAND B,KUMAR A,LEE S,et al.Autophagy induction and autophagosome clearance in neurons:relationship to autophagic pathology in Alzheimer's disease[J].J Neurosci,2008,28(27):6926 -6937.
[3]何贤辉,欧阳东云.细胞自噬与高迁移率族蛋白B-1(HMGB1)介导肿瘤耐药的研究进展[J].暨南大学学报:医学版,2011,32(2):126-130.
[4]LEE I H,FINKEL T.Regulation of autophagy by the p300 acetyltransferase[J].J Biol Chem,2009,284(10):6322-6328.
[5]LIN S Y,LI T Y,LIU Q,et al.GSK3-TIP60-ULK1 signaling pathway links growth factor deprivation to autophagy[J].Science,2012,336(6080):477 -481.
[6]YANG X J,SETO E.The Rpd3/Hda1 family of lysine deacetylases:from bacteria and yeast to mice and men[J].Nat Rev Mol Cell Biol,2008,9(3):206 -218.
[7]OUYANG D Y,XU L H,HE X H,et al.Autophagy is differentially induced in prostate cancer LNCaP,DU145 and PC-3 cells via distinct splicing profiles of ATG5[J].Autophagy,2013,9(1):20-32.
[8]WANG R C,WEI Y,AN Z,et al.Akt-mediated regulation of autophagy and tumorigenesis through Beclin 1 phosphorylation[J].Science,2012,338(6109):956 -959.
[9]REN S,OUYANG D Y,SALTIS M,et al.Anti-proliferative effect of 23,24-dihydrocucurbitacin F on human prostate cancer cells through induction of actin aggregation and cofilin-actin rod formation[J].Cancer Chemother Pharmacol,2012,70(3):415 -424.
[10]LEE I H,CAO L,MOSTOSLAVSKY R,et al.A role for the NAD-dependent deacetylase Sirt1 in the regulation of autophagy[J].Proc Natl Acad Sci U S A,2008,105(9):3374-3379.
[11]KABEYA Y,MIZUSHIMA N,UENO T,et al.LC3,a mammalian homologue of yeast Apg8p,is localized in autophagosome membranes after processing[J].EMBO J,2000,19(21):5720-5728.
[12]KLIONSKY D J,ABDALLA F C,ABELIOVICH H,et al.Guidelines for the use and interpretation of assays for monitoring autophagy[J].Autophagy,2012,8(4):445-544.
[13]HAGGARTY S J,KOELLER K M,WONG J C,et al.Domain-selective small-molecule inhibitor ofhistone deacetylase 6(HDAC6)-mediated tubulin deacetylation[J].Proc Natl Acad Sci U S A,2003,100(8):4389-4394.
[14]ZHANG Y,LI N,CARON C,et al.HDAC-6 interacts with and deacetylates tubulin and microtubules in vivo[J].EMBO J,2003,22(5):1168 -1179.
[15]MCEWAN D G,DIKIC I.The three musketeers of autophagy:phosphorylation,ubiquitylation and acetylation[J].Trends Cell Biol,2011,21(4):195 -201.
[16]RIEDEL M,GOLDBAUM O,SCHWARZ L,et al.17-AAG induces cytoplasmic alpha-synuclein aggregate clearance by induction of autophagy[J].PLoS One,2010,5(1):e8753.
[17]KAWAGUCHI Y,KOVACS J J,MCLAURIN A,et al.The deacetylase HDAC6 regulates aggresome formation and cell viability in response to misfolded protein stress[J].Cell,2003,115(6):727 -738.

