壳寡糖的抑瘤作用及其作用机制研究*
徐文华,韩宝芹,孔晓颖,刘万顺
**
(1.中国海洋大学海洋生命学院,山东 青岛266003;2.青岛大学医学院,山东 青岛266021)
肾细胞癌(Renal cell carcinoma,RCC)简称为肾癌,是起源于肾实质层泌尿小管上皮系统的恶性肿瘤,占肾恶性肿瘤的80%~90%,是泌尿系统中常见的恶性肿瘤之一,几乎占成人恶性肿瘤发病率的2%~3%[1-2]。全球每年死于肾癌的人数约有100 000人次。大约1/3的肾癌患者在初次就诊时就已发现有转移[3],即使局限性肾癌患者行根治性手术后,仍有大约20%~30%的复发和转移率[4]。肾癌对传统的放化疗均不敏感。
壳寡糖是由3~10个氨基葡萄糖或N-乙酰氨基葡萄糖经β-1,4糖苷键连接而成的线性寡聚体[5-6]。壳寡糖能很好地经肠道被人体吸收[7],展现出优越的生物学特性,具有调节血脂、血糖和血压,吸附胆固醇和强化肝脏功能等。壳寡糖对部分肿瘤有抑制作用[8-9],但其对肾癌的作用却鲜有报道。本文旨在探讨其对肾癌细胞OS-RC-2的作用及作用机制,从而为其临床应用提供理论依据。
1 材料与方法
1.1 主要材料与仪器
1.1.1 细胞和实验动物 OS-RC-2人肾癌细胞购于购自中国科学院上海生命科学研究所。裸鼠,雌雄兼用,体质量约(20±3)g,由上海斯莱克实验动物有限责任公司提供。
1.1.2 主要试剂 COS(相对分子质量为1 000)由青岛博益特生物有限公司提供。新生牛血清由美国GIBCO公司提供。PR-PCR试剂盒由Promega公司提供。DMEM培养基和胎牛血清购自Hyclone公司。四甲基偶氮唑盐(MTT)和吖啶橙-溴乙锭(AO-EB)购自Sigma公司。血管内皮细胞生长因子(VEGF)引物由上海生物工程有限公司合成,抗体由北京中山制剂公司提供。其他试剂均为分析纯级。
1.1.3 主要仪器 CO2培养箱购自日本SANYO公司;Nikon Eclipse Ti-E全自动倒置显微镜购自日本尼康公司;Rayto2100C酶标仪购自美国雷杜公司;FACSCalibur TM BD型流式细胞仪购自美国BD公司;Enppendorf 5415D离心机购自德国艾本德股份公司;9700型PCR扩增仪购自美国ABI公司;DYCP-44P凝胶电泳仪购自北京六一公司;H-500透射电镜购自日本日立公司。
1.2 体外实验方法
1.2.1 OS-RC-2肾癌细胞的体外培养 肾癌细胞OS-RC-2在含有体积分数0.10新生牛血清的DMEM培养基中,置于37℃、体积分数0.05CO2的培养箱中培养,隔天换液,4d传代,用含0.2g/L EDTA 的2.5 g/L胰酶消化细胞,待细胞回缩变圆时,加入新鲜培养液终止消化,离心,弃上清,用新鲜培养液调细胞密度至109/L进行传代培养,采用胎盘蓝拒染法观察细胞存活率(存活率在95%以上后进行以下实验)。
1.2.2 COS对OS-RC-2肾癌细胞增殖的影响 消化OS-RC-2肾癌细胞并调细胞密度为5×104/L,96孔板每孔接种200μL,置培养箱中培养24h。实验组分别加入500、300、100、50mg/L的 COS(含体积分数0.10新生牛血清的DMEM培养基配制)各200μL,对照组加入200μL含体积分数0.10新生牛血清的DMEM培养基。37℃、体积分数0.05CO2培养箱中恒温培养,分别于培养2、4d观察细胞状态,每孔加入5g/L的 MTT20μL,37℃孵育4h。加入二甲基亚砜150μL,37℃保温10min,用酶标仪(490nm波长处)测各孔的A值。
1.2.3 COS对 OS-RC-2肾癌细胞凋亡的影响 96孔板中接种细胞,方法同1.2.2。在细胞培养3d时,向200μL细胞悬液中加入8μL AO-EB染色液,并用荧光显微镜对细胞拍照。每组分别计数200个细胞并观察细胞形态。活细胞(VN)为绿色且含有正常染色质结构的细胞,早期凋亡细胞(VA)为绿色但含有固缩状染色质的细胞,晚期凋亡细胞(NVA)为橙色且含有固缩状染色质的细胞,坏死细胞(NVN)为橙色但含有正常染色质结构的已死但未凋亡的细胞。
细胞凋亡率=(NVN+NVA)/(VN+VA+NVN+NVA)×100%。
1.2.4 流式细胞仪观察COS用药前后细胞周期的变化
消化收集OS-RC-2并调细胞密度为5×107/L,接种于25cm2培养瓶中,每瓶3mL,常规培养24h后,对照组加入含体积分数0.10和0.005胎牛血清的培养基,实验组同时加入不同浓度的COS,继续培养24 h,收集细胞,离心得细胞沉淀,100μL PBS重悬,置体积分数0.70的乙醇中4℃固定2h,然后用100μL PBS重悬,加入Rnase 100μL和25mg/L的PI单染溶液200μL,4℃避光30min,流式细胞仪检测。
1.3 体内实验方法
1.3.1 小鼠OS-RC-2肾癌肿瘤模型的建立和实验培养肾癌细胞OS-RC-2,制成1mL细胞悬液(细胞数约为107/L),注入2只小鼠腹腔。待腹水后,抽出腹水稀释1倍,再次注入健康小鼠腹腔进行传代一次。再抽取腹水离心,生理盐水洗后于小鼠右前肢腋窝皮下接种(109/L,每只0.2mL)。小鼠接种24h后,随机分为模型对照组、阳性对照组(环磷酰胺)和COS各用药组,每组6只小鼠。COS各组分别用50、100、300、500mg/kg COS灌胃,阳性对照组灌胃环磷酰胺(300mg/kg),模型对照组灌胃生理盐水,连续给药15d[10]。
1.3.2 肿瘤抑制率测定 给药15d后,次日剥离瘤块,称其重量并计算抑瘤率。
肿瘤抑制率(%)=(模型对照组的瘤质量-治疗组的瘤质量)/模型对照组瘤质量×100%。
1.3.3 RT-PCR检测VEGF基因的表达 每组取瘤组织50mg,用Trizol提取总RNA。取1μg总RNA进行PT-PCR扩增实验。VEGF引物序列:上游5′-CCTTGCTGCTCTACCTCC-3′,下游5′-AAATGCTTT CTCCGCTCT-3′;(扩增产物500bp)内参照(GADPH)引物序列:上 游 5′-ACTGCCACCCAGAAGACT-3′,下 游 5′-GCTCAGTGTAGCCCAGGAT-3′。严格按照试剂盒方法进行操作。反应条件为:94℃5min,94℃变性30 s,53℃退火1min,72℃延伸1min,30次循环后,72℃再延伸5min。电泳产物在15g/L琼脂糖凝胶上电泳,用Quantity-one对条带进行吸光度扫描,检测各组mRNA产物A值,以AVEGF/AGADPH表示其相对表达水平。
1.3.4 VEGF免疫组化检测 瘤组织经石蜡包埋切片、抗原修复,浸入体积分数0.003过氧化氢溶液,滴加一抗工作液(兔抗鼠VEGF抗体,1:250),4℃冰箱过夜后,滴加相应二抗工作液,37℃孵育30min,DAB显色,苏木精复染核,梯度乙醇脱水,二甲苯透明,中性树胶封片,镜下观察结果。
1.3.5 透射电镜观察肿瘤细胞的凋亡 将肿瘤切块(1.5mm×2.0mm),迅速经40g/L戊二醛前固定,清洗后用10g/L锇酸后固定,常规脱水、浸透、环氧树脂包埋、醋酸双氧铀-枸橼酸铅双重染色,透射电镜观察结果。
1.4 数据统计分析
采用SPSS17.0软件进行统计学分析,计量资料以mean±SD表示,组间比较采用方差分析,计数资料比较采用x2检验,以P<0.05为差异有统计学意义。
2 结果
2.1 体外实验结果
2.1.1 COS对OS-RC-2肾癌细胞体外生长抑制作用
OS-RC-2肾癌细胞在100和300mg/L COS培养条件下,与对照相比,细胞生长受到明显抑制(F=69.21,q=11.32、19.35,P<0.05),其他组抑制效果不明显(见表1)。
2.1.2 COS对 OS-RC-2肾癌细胞体外凋亡作用100和300mg/L的COS剂量组肾癌细胞OS-RC-2的凋亡率要明显高于对照组(F=205.72,q=31.52、23.21,P<0.01),即中等剂量组的 COS可明显促进OS-RC-2肾癌细胞的凋亡(见表1)。
2.1.3 COS对OS-RC-2肾癌细胞的细胞周期影响与对照组相比,100mg/L的COS可使滞留在G0/G1期的癌细胞比例显著增高,而使S期和G2/M期的癌细胞比例显著降低,300mg/L COS对肾癌细胞的生长也有一定的阻滞作用(x2=22.54,P<0.05),其他组作用效果不显著(见表2)。
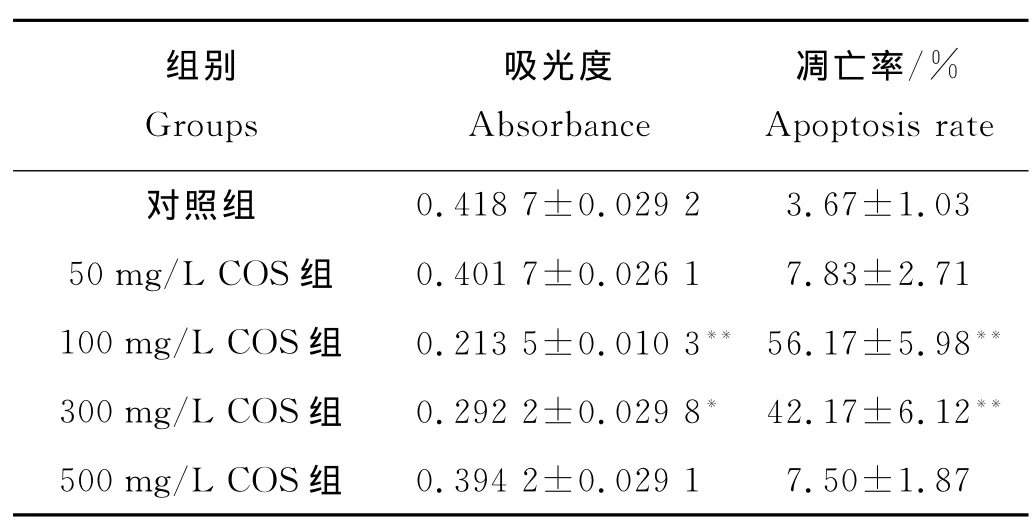
表1 COS对OS-RC-2肾癌细胞体外增殖和凋亡的影响(mean±SD,n=6)Table 1 The proliferation and apoptosis of kidney cancer cell OS-RC-2with COS in vitro(mean±SD ,n=6)
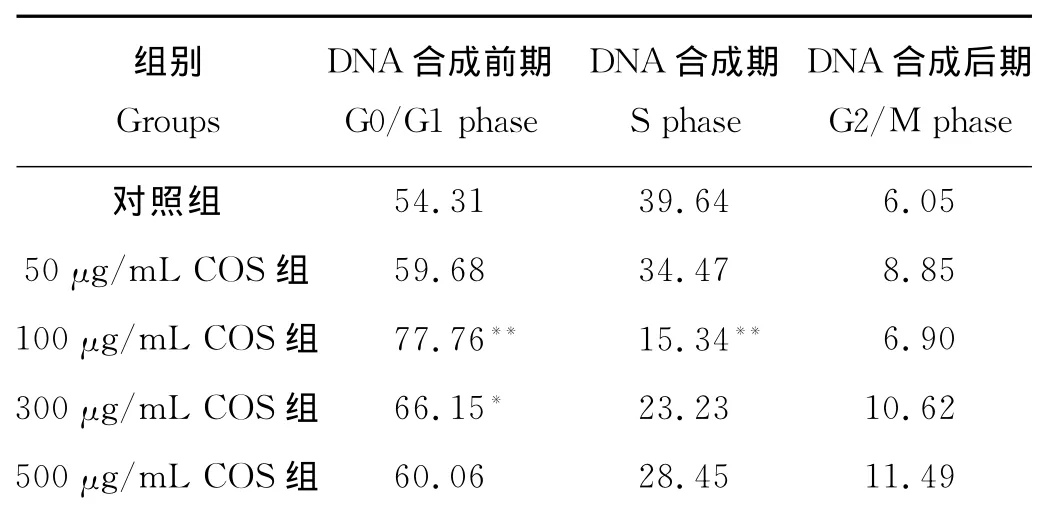
表2 流式细胞术检测COS对OS-RC-2细胞周期影响Table 2 The infiuence of OS-RC-2cell circle with COS by flow cytometry /%
2.2 体内实验结果
2.2.1 不同浓度COS对OS-RC-2肿瘤生长抑制率的影响 环磷酰胺组和不同剂量COS组肿瘤质量都明显低于模型对照组(F=345.72,q=43.19~54.56,P<0.05)。100、300mg/kg COS剂量组的抑癌效果显著(F=148.39,q=25.05、15.10,P<0.05),其他剂量组与模型对照组相比差异无显著性(见表3)。
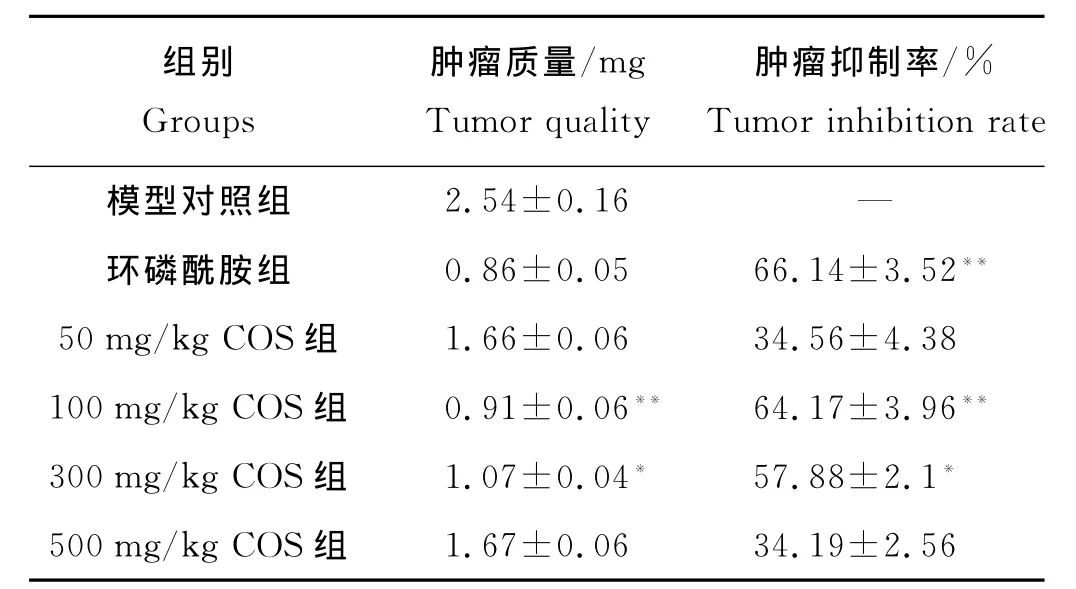
表3 不同浓度COS对OS-RC-2肾肿瘤抑制结果(mean±SD,n=6)Table 3 The inhibitory of renal carcinoma OS-RC-2with different concentration of COS.(mean±SD,n=6)
2.2.2 不同剂量的COS对移植瘤VEGFmRNA表达水平的影响 环磷酰胺组、100和300mg/kg COS组VEGF mRNA表达水平明显低于模型对照组(F=172.05,q=25.27~35.50,P<0.01),其他组差异无显著性(见图1和表4)。
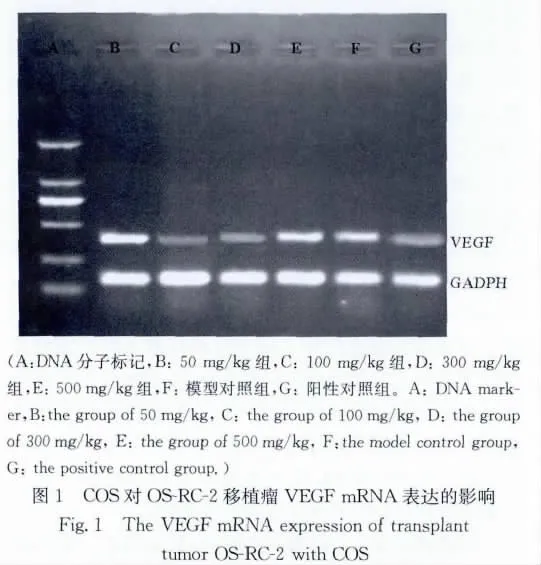
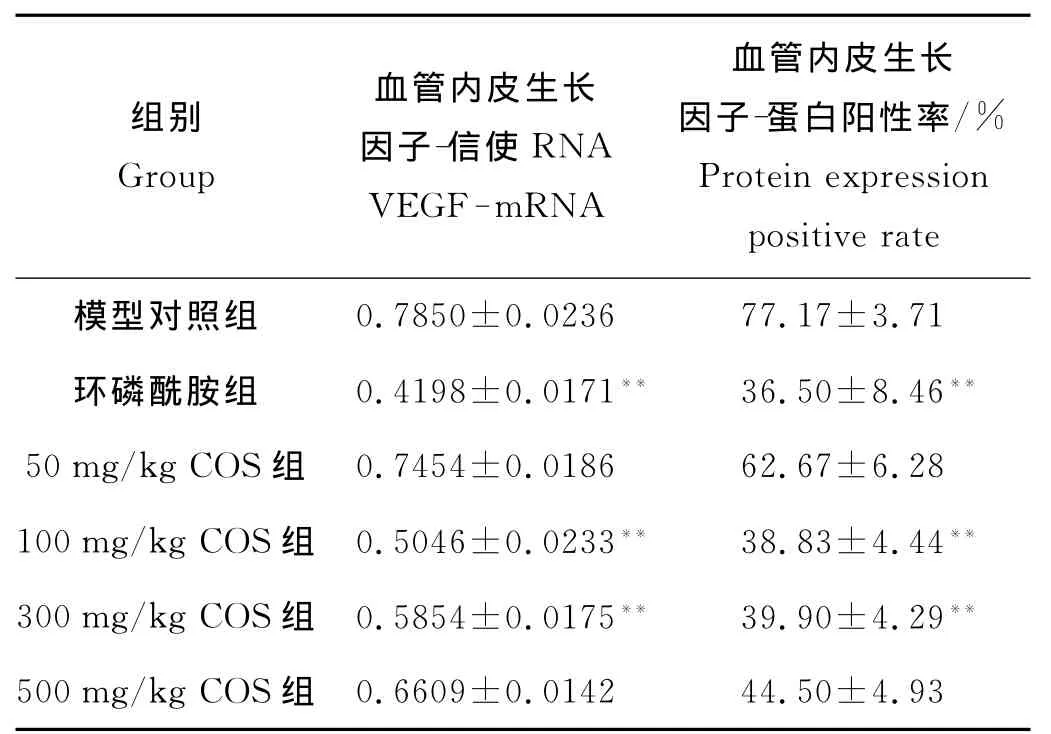
表4 COS对OS-RC-2移植瘤VEGF mRNA及其蛋白阳性率的影响(mean±SD,n=6)Table 4The VEGF mRNA and protein expression of transplant tumor OS-RC-2with COS(mean±SD,n=6)
2.2.3 COS对 OS-RC-2肿瘤组织 VEGF蛋白表达的影响 COS灌胃15d后,模型对照组OS-RC-2转移瘤细胞胞质中有大量VEGF蛋白免疫阳性黄褐色染色颗粒。与模型对照组相比,阳性对照组、100和300 mg/kg COS组仅有少量阳性染色颗粒(F=88.48,q=25.58、20.25,P<0.01),其他剂量组 VEGF蛋白免疫阳性染色较强(见图2和表4)。
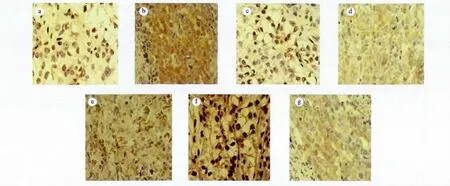
图2 VEGF样品免疫组化染色图片(400×)Fig.2 The immunohistochemical staining for VEGF of the samples(400×)
2.2.4 透射电镜观察OS-RC-2肾癌细胞的凋亡 模型对照组可见肿瘤细胞体积较大,细胞核呈椭圆形,线粒体较多,核染色质无边聚现象,电子密度较低;100和300mg/kg COS组可见肿瘤细胞体积缩小,细胞核异型性大,周围有大量的胶质纤维形成,核染色质固缩,边聚,线粒体部分呈空泡状,电子密度较高(见图3)。
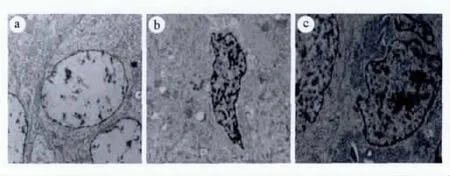
图3 透射电镜观察肾癌细胞OS-RC-2的凋亡(7000x)Fig 3 The apoptosis of renal carcinoma OS-RC-2by TEM(7000x)
3 讨论
肿瘤的生长和转移依赖丰富的血液供应,因此需要大量的新生血管的生成。大量研究证实,VEGF及其受体是介导新生血管生成的关键因素,它促使血管内皮细胞有丝分裂并最终形成大量的新生血管,是刺激肿瘤血管的生成中最强的细胞因子[11]。血管内皮生长因子-血管内皮生长因子受体((VEGF-VEGFR)、血管生成素(Ang)-Tie2及 Delta-like ligan4(Dll)-Nortch信号通路作为血管生成中的3条主要的信号传导通路,它们各自作用并互相影响、共同协调,促进血管的生成。VEGF-VEGFR信号通路是血管生成中主要的信号通路,阻断VEGF-VEGFR通路是肿瘤治疗中首个治疗策略。VEGF不仅可激活Ang受体从而发挥其作用,还可以诱导Dll-Nortch信号,同时还受到Dll-Nortch信号的调节。生理性或者病理性的血管生成正是在多条血管通路的共同作用下完成的[12-14]。
VEGF由7个内含子及8个外显子交替构成,其mRNA的不同的剪切方式形成分为5种单体,VEGF121、VEGF145、VEGF165、VEGF189、VEGF 206[15,17]。其中 VEGF165是 VEGF最重要的同源单体,其含量最多,分裂原性也最强[13]。有研究证实,Ad-VEGFl65转染BGC-823细胞后可上调 Bcl-2mRNA蛋白的表达,因而认为VEGFl65可通过上调Bcl-2的表达而抑制癌细胞的凋亡[18-19]。因此抑制 VEGF mRNA的表达,可阻断肿瘤新生血管的形成,从而抑制肿瘤的生长。
本研究以VEGF165作为检测对象,通过RT-PCR和免疫组化检测COS小鼠灌胃15d后,肾肿瘤组织中VEGF mRNA及其蛋白的表达。结果表明,中剂量的COS可显著降低肿瘤中VEGF mRNA及其蛋白的表达,从而抑制肿瘤血管的形成及促进肿瘤细胞的凋亡,达到抑制肿瘤生长的目的,使肿瘤饥饿致死;透射电镜可见肿瘤细胞体积缩小和异型性改变,周围有大量的胶质纤维形成,核染色质固缩,边聚,线粒体部分呈空泡状,电子密度高等凋亡细胞的特征,与MTT实验和AO/EB实验结果相符。
综上所述,COS可明显抑制肿瘤细胞的增殖,且抑瘤作用有一定的浓度范围,中剂量的COS抑瘤效果最佳。
[1] Jemal A,Siegel R,Xu J,et al.Cancer statistics[J].CA Cancer J Clin,2010,60:277-300.
[2] Campbell S C,Novick A C,Bukowski R M.Renal tumors[M].Philadelphia:Campell’s Urology,2007:1651-1725.
[3] Herrmann E,Bierer S,Wülfing C.Update on systemic therapies of metastatic renal cell carcinoma[J].World J Urol,2010,28:303-309.
[4] Kirchner H,Strumberg D,Bahl A,et al.Patient-based strategy for systemictreatment of metastatic renal cell carcinoma[J].Expert Rev Anticancer Thera.2010,10:585-596.
[5] Fu D W,Han B Q,Dong W,et al.Effects of carboxymethyl chitosan on the blood system of rats[J].Biochemical and Biophysical Research Communications,2011,408:110-114.
[6] Zheng M L,Han B Q,Yang Y,et al.Synthesis,charcterization and biological safety of O-carboxymethyl chitosan used to treat Sarcoma 180tumor[J].Carbohydrate Polymers,2011,86:231-238.
[7] Xu Q S,Bai X F,Du Y G.Progress on Anti-tumor Activity of Oligochitosan and Its Derivates[J].Food and Drug,2008,10(5):60-62.
[8] 刘清华,孔庆兖,柳红.壳寡糖对S180肉瘤细胞凋亡、细胞周期以及凋亡相关蛋白Bcl-2、Bax的影响[J].徐州医学院学报,2006,26(4):290-293.
[9] Pae H O,Seo W G,Kim N Y,et al.Induction of granulocytic differentiation in acute promyelocytic leukemia cells(HL-60)by wa-ter-soluble chitosan oligomer[J].Leuk Res,2001,25(4):339-346.
[10] Wang X B,Liu Q H,Wang P,et al.Study of cell killing effect on RENAL CARCINOMA OS-RC-2by ultrasound activating protoporphyrin IX[J].Ultrasonics,2008,48:135-140.
[11] 徐文华,葛银林.siRNA对胃腺癌细胞株SGC-7901血管内皮生长因子基因表达的作用[J].青岛大学医学院学报,2006,42(3):222-224.
[12] Gaur P,Bose D,Samuel S,et al.Targeting tumor angiogenesis[J].Semin Oncol,2009,36(Sup):12-19.
[13] Li J L,Harris A L.Croestalk of VEGF and North pathways in tumor angiogenesis;therapeutic implications[J].Front Bioeci,2009,14:3094-3110.
[14] Wang J F,Zhang X,Groopman J E,et al.Activation of vascular endothelial growth factor receptor-3and its downstream signaling promote cell survival under oxidative stress[J].J Biol Chem,2004,279(26):27088-27097.
[15] Timmons L,Fire A.specific interference by ingested dsRNA[J].Nature,1998,395:854.
[16] Brantl S.Antisense-RNA regulation and RNA interference[J].Biochim Biophys Acta,2002,1575:15-25.
[17] Agami R.RNAi and related mechanisms and their potential use for therapy[J].Curr Opin Chem Biol,2002,6:829-834.
[18] Shi Y.Mammalian RNAi for the masses[J].Trends Genet,2003,19:9-12.
[19] 欧希龙,关云燕,颜芳,等.血管内皮生长因子1 65基因对人胃癌细胞凋亡的影响及机制[J].世界华人消化杂志,2008,16(3):307-310.

