基因foxl2的结构及表达调控*
刘晓玲,刘建国,张志峰**
(1.中国海洋大学海洋生物遗传育种教育部重点实验室,山东 青岛266003;2.烟台大学生命科学学院,山东 烟台264005)
FOX(Forkhead box)是叉头框转录因子家族,该家族成员参与脊椎动物的胚胎发育、细胞周期调控、糖类和脂类代谢、生物老化、免疫调节等多种生物学过程[1]。FOXL2 (Forkhead box L2)是 FOX 家族成员之一,该基因最早由Crisponi作为睑裂狭小综合症(Blepharophimosis-ptosis-epicanthus inversus syndrome,BPES)及卵巢早衰的候选基因被克隆[2],迄今,已在多种脊椎动物及数种无脊椎动物中获得了foxl2基因[3-8],然而,较深入和系统的研究仅在高等哺乳动物中进行,并确定其具有参与哺乳动物卵巢早期发育和分化、维持成体卵巢的功能等作用[1]。各种研究发现该基因在生物体中作用的发挥受到其自身表达调控的影响,对其表达调控的研究和探索将为其作用的分子机制查明奠定基础。而作为一个发现相对较晚的性别相关基因,foxl2在无脊椎动物中的相关研究较少,并且不够深入。本文对foxl2基因的表达调控以及在不同动物中的研究进展进行概述,为深入了解该基因的进化路径及探讨其在动物中的功能研究提供基础资料。
1 Foxl2的结构特点
FOX家族成员都具有1个叉头样的DNA结合区,由此而得名。该叉头结构由约100个氨基酸组成,其核心部分有3个α螺旋,在两侧包含有2个β链而成的翼状结构(见图1),故又称为翼状螺旋蛋白[1,7,9]。作为反式作用因子,FOX通过其α螺旋与靶基因DNA双螺旋大沟结合,其β折叠则与小沟结合。根据氨基酸的同源性可以将它们划分为不同的亚家族[1],近期研究已发现FOX家族包含了从FOXA到FOXS以及FOXAB共20个亚族,亚族中又有不同的成员,其中小鼠Mus musculus基因组中已发现46个fox基因[10]。
FOXL2是叉头框(FOX)转录因子家族成员之一,该亚家族通过6个位点的特殊氨基酸得以与其它亚家族成员区别开(见图2)。2011年Fan等报道了人的FOXL2第114位赖氨酸一旦被谷氨酸替代将会影响FOXL2功能,导致BPES发生[9],因此认为该位点是其结构中的一个重要功能位点(见图1A)。Cocquet通过序列分析发现,FOXL2通常在N端的氨基酸序列相对不保守,并提出这与生物进化相关[3]。在哺乳动物中,FOXL2的氨基酸序列通常含有多聚甘氨酸区以及脯氨酸和丙氨酸重复区,并且叉头框的C端还包含一段精氨酸和赖氨酸区(RRRRRMKR),后者可能是一个细胞核定位信号,参与FOXL2蛋白由细胞质进入细胞核的调控[11]。Moumne等用 FOXL2/GFP (Green fluorescent protein)融合蛋白转染了 COS-7细胞,荧光显微镜观察发现,具有正常丙氨酸重复区的FOXL2蛋白在细胞核中呈弥散分布,但当高度保守的丙氨酸重复区发生变化(如长度改变)时,将引发FOXL2蛋白在细胞核和细胞质内形成聚集,导致活性改变[12]。进一步还发现,由该基因polyA区域的延长而造成的突变会导致产生的FOXL2蛋白大部分被限制在细胞质中而不能进入细胞核发挥正常的功能[13]。在非哺乳动物中,迄今没有发现多聚甘氨酸区以及脯氨酸和丙氨酸重复区的存在[3-8]。除此外,张晶晶等报道该基因的终止密码子常表现为多态性,几乎所有哺乳动物该基因的终止密码子都是TGA,而其他物种的终止密码子则为 TAA 或者 TAG[7]。按蚊Anopheles gambiae[16]、玻璃海鞘Ciona intestinalis[16]、海 葵 Nematostella vectensis[17]、皮 海 绵Suberites domuncula[5]、太 平 洋 牡 蛎 Crassostrea gigas[6]、海 胆 Strongylocentrotus purpuratus[8]和 栉孔扇 贝Chlamys farreri 的foxl2 基 因[18]。研 究 发现,这些序列均具有与脊椎动物一致的保守叉头框序列,也有细胞核定位信号,但不具有哺乳动物FOXL2

图1 FOXL2叉头保守区序列推测的三维结构Fig.1 Schematic structure of FOXL2forkhead domain

图2 FOXL2亚家族蛋白的叉头框Fig.2 Forkhead box of FOXL2protein from different species
在鱼类中发现foxl2存在基因重复现象,基因重复指某些基因会存在旁系同源(Paralogous)的异构形式[14]。Jiang等利用数据库比对发现斑马鱼Danio rerio、青鳉Oryzias latipes等鱼类中,foxl2基因可能存在2种不同序列,其中趋异进化的命名为foxl2b[15]。
无脊椎foxl2序列及结构的研究较少。目前为止,通过已知基因组序列比对或克隆的方法,仅获得了所含的多聚甘氨酸区以及脯氨酸和丙氨酸重复区[16-17]。在进化上,无脊椎动物的FOXL2蛋白C端的氨基酸序列相对保守,而N端相对不保守,Cocquet认为FOXL2蛋白C端的氨基酸序列的相对保守可能与其保守的功能有关[3]
2 Foxl2基因的表达调控
在细胞分化或某种生理活动中,基因的表达可在多个水平被调控。目前关于foxl2基因自身表达调控的研究主要集中在转录水平的调控。
2.1 Foxl2基因转录水平的调控
2.1.1 基因上游的调控元件 Foxl2基因上游调控元件的研究,目前仅限于哺乳动物中的几个报道。Pailhoux在研究山羊(Capra hircus)的无角间性综合征(Polled intersex syndrome,PIS)的发生时提出,山羊foxl2基因转录起始位点上游约200kb处的部分序列为该基因的顺式作用元件,该序列的缺失会导致山羊foxl2基因转录活动的停止[19]。该序列在山羊、老鼠和人(Homo sapiens)的对应基因座位中是保守的,当人的该同源序列缺失或断裂时将造成BPES的发生[20],已知人的FOXL2是BPES的候选基因,故推测这一同源序列也是人FOXL2基因的顺式作用元件。
进一步研究发现,人FOXL2还参与了该基因转录水平的自我激活,但这种调节会被体内NAD(Nicotinamide adenine dinucleotide)依赖的去乙酰化酶所阻止[21]。
2.1.2 雌激素对foxl2基因的转录调节 芳香化酶(Aromatase enzyme,P450arom)是雌激素生成的重要酶类,已证明在很多物种中广泛存在。研究发现foxl2与P450arom基因的表达在时空上高度相关,foxl2能激活P450arom表达,被认为是芳香化酶的上游基因,二者共同参与调节雌激素的合成[4,22]。
最近的研究发现,当用雌激素处理虹鳟Oncorhynchus mykiss、南方鲇Silurus meridionnalis、稀有鮈鲫Gobiocypris rarus时,其体内foxl2 mRNA呈上调表达,而用芳香化酶抑制剂(能降低体内雌激素合成)或雄激素处理虹鳟、南方鲇发现,foxl2 mRNA表达出现下调[15,23-24]。Guiguen等对鱼类的这种雌激素与foxl2之间的相互调节进行了总结(见图3)[25]。同样在鸡Gallus gallus胚中,用芳香化酶抑制剂处理后,鸡胚卵巢组织的foxl2表达被抑制,由此研究者提出这种雌激素对foxl2表达的调控是一种反馈调节[22]。
2.2 Foxl2基因转录后水平的调控
在山羊、鸡和小鼠的睾丸中可以检测到foxl2 mRNA的表达,但在同样的组织中却没有检测到相应的蛋白产物,类似的现象也在小鼠和鸡的卵母细胞中发生[3,26-27],推测在这些组织细胞中foxl2 存在着转录后水平的调控,但这一调控的机制尚不清楚。
2.2.1 3′末端存在不同的polyA位点 大部分真核生物mRNA的加工涉及到mRNA前体的分裂/多聚腺苷化,即在mRNA 3′末端有一个特异性酶识别切点上游13~20bp的加尾识别信号AAUAAA以及切点下游的保守序列GUGUGUG,把切点下游的一段切除,然后再由ploy A聚合酶催化,加上多聚腺苷酸(poly A)尾巴,以此增强mRNA的稳定性并有助于mRNA从细胞核到细胞质的转运,从而调控蛋白质的产生。某些基因的转录产物中存在2个以上poly A聚合酶识别位点,如降钙素和降钙素基因相关肽便是同一个基因产生的不同产物,在甲状腺C细胞中产生降钙素、在神经组织产生降钙素基因相关肽,其中造成这一现象的一个原因就是由于转录产物在不同细胞中poly A位点不同,从而影响mRNA的剪切加工,致使成熟的mRNA产生差异而生成2种不同功能的产物[28]。Cocquet等报道小鼠的Foxl2基因存在着2种截然不同的polyA位点,一种polyA在转录本的第2433bp处起始,具有典型的多聚A信号(AAUAAA),另一种在2864bp处起始,具有非典型的多聚A信号(UAUAAA)[29]。但小鼠Foxl2 polyA 位点的不同是否也会参与基因调控,目前尚缺乏实验依据,有待进一步研究验证。
2.2.2 反义RNA的存在 内源性的反义RNA在很多物种(动物、植物和真菌)中已有报道,它们通过影响RNA的编辑或直接通过转录碰撞等方式对正义RNA的表达水平产生调控作用[30]。Cocquet等采用荧光原位杂交技术首次在小鼠卵巢粒层细胞系中检测到了反义和正义的Foxl2 RNA[29]。进一步发现该反义转录本与正义转录本序列有部分互补,但前者不具有阅读框,推测其可能对Foxl2的表达产生调控作用[29]。在太平洋牡蛎[6]及栉孔扇贝[18]成体性腺中也检测到这种foxl2反义RNA,但其是否以及怎样发挥调控作用还有待于进一步的研究。
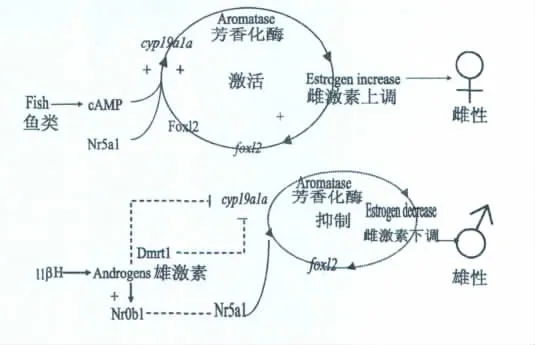
图3 鱼类foxl2与芳香化酶基因之间的互相调节关系[25]Fig.3 Feedback loop between foxl2 gene and P450arom gene in fish[25]
2.3 翻译后调控
双向电泳和免疫印迹技术发现,FOXL2在人的KGN细胞(粒层细胞样肿瘤细胞系)和小鼠的卵巢内存在几种不同等电点的蛋白亚型[31];生物信息学分析(http://www.cbs.dtu.dk/services/NetPhosk/和http://www.cbs.dtu.dk/services/NetPhos/)发现,这种不同等电点的蛋白形式主要是由于不同的翻译后修饰造成的,如小鼠、红原鸡、非洲爪蟾Xenopus tropicalis、斑马鱼等物种中的FOXL2中存在大量的乙酰化和磷酸化保守位点;进一步发现(http://medgen.ugent.belfoxI2/)这些位点的部分氨基酸残基发生变化,将影响FOXL2蛋白活化或者细胞定位[11,31]。由此认为,翻译后的调控对FOXL2功能的实施和细胞定位具有重要的意义。
3 Foxl2的空间表达特征及其功能研究
迄今已报道了多个物种的foxl2基因空间表达特征,这些研究主要集中在脊椎动物中[3-4],在无脊椎动物中报道较少,且其表达特征与高等动物之间存在差异[5-6,8]。有关该蛋白的功能研究则主要来自哺乳动物,其他物种尚未见报道。
3.1 脊椎动物
对于哺乳动物的foxl2研究相对深入。在大多数的哺乳动物中,该基因呈性腺性别二态性表达特征,但在mRNA和蛋白水平的表达存在空间差异。其中mRNA主要在卵巢的颗粒细胞中表达[32],但在小鼠卵母细胞中也定位到该基因的mRNA[27],并在山羊和小鼠的睾丸中检测到了该mRNA的弱表达[3,26]。比较而言,哺乳动物的FOXL2蛋白在性腺中的表达相对受限,其仅在卵巢颗粒细胞中表达,而在卵母细胞和精巢中均未检测到该蛋白的存在[27]。除此之外,研究者还发现该基因在哺乳动物的脑垂体及眼睑中均存在mRNA和蛋白水平的表达[32]。
哺乳动物中foxl2基因在性别分化时期的卵巢中特异表达,确定其可作为哺乳动物卵巢分化的早期标记分子开展相关的研究[27]。长期以来,对哺乳动物foxl2基因功能的研究主要集中在卵巢发育及功能维持方面,认为该基因可以调节颗粒细胞的增殖分化,是卵泡发育必须的细胞因子[34],并且根据该基因在小鼠胚胎发育中后期及成体脑垂体前叶表达的特征,推测可能与“脑垂体性腺轴”有关[32]。Batista等在研究FOXL2对卵巢生理病理机制时发现,KGN细胞中过表达 FOXL2能激活参与 ROS (Reactive oxygen species)新陈代谢相关基因的表达,表明其参与氧自由基代谢[37]。Uda等研究发现,Foxl2-/-突变体小鼠的卵巢中滤泡细胞闭锁,表明该基因在某种程度上有抗细胞凋亡的作用[38]。Guiguen等认为foxl2参与类固醇雌激素的生成[38]。在哺乳动物中,还有一些foxl2突变造成的功能缺失研究,这些研究大多集中在突变表型分析上,有研究表明小鼠中该基因可能通过与Sox9的相互抑制发挥其性别维持功能[39]。2011年Caburet等概述了已有的研究成果认为,卵巢中FOXL2参与调节胆固醇和类固醇代谢以及细胞凋亡和细胞增殖活性氧解毒,并阻止卵巢颗粒细胞转分化为类支持细胞,这些功能分析显示了该基因是卵巢发育和功能维持的重要因子[40]。
在鸡中foxl2基因在mRNA与蛋白水平的表达规律与小鼠中的类似[26]。
两栖类foxl2基因的研究主要来自皱皮蛙(Rana rugosa),研究发现蛙foxl2 mRNA表达模式与哺乳动物类似;免疫组化结果显示FOXL2蛋白存在于卵母细胞周围的体细胞中,但未见脑和精巢中蛋白水平的研究报道[33]。同其它哺乳动物一样,蛙foxl2基因为常染色体基因,在卵巢分化早期起关键作用[33-34]。
鱼类该基因研究多集中在mRNA表达水平,且发现其主要在卵巢中表达[15,35-36],Wang等对罗非鱼的研究发现:50dah(days after hatching)发育时期的罗非鱼处于卵巢的分化期,此时用原位杂交技术检测到了foxl2的表达,并将其定位在卵母细胞周围的颗粒细胞中,研究者认为foxl2在罗非鱼卵巢分化早期的表达暗示了该基因参与罗非鱼的卵巢分化[35]。Nakamoto等对青鳉的mRNA表达研究发现:foxl2基因在青鳉性别决定关键时期不表达,表明其不参与性别决定,但推测其在卵巢分化早期发挥作用,可能与该基因在哺乳动物中的作用一样,都与粒层细胞的分化相关[36]。类似于哺乳动物,在虹鳟和罗非鱼的精巢中也检测到该基因mRNA的弱表达[35]。进一步在许多鱼类中发现,该基因mRNA除了在脑和垂体中表达外,还在鱼的鳃中表达,研究者认为这种在水生硬骨鱼类中的独特表达模式尚需更深入的研究[35]。
3.2 无脊椎动物
虽然目前已有几种无脊椎动物的foxl2基因序列已知,但其表达研究却很少,迄今仅在海胆、太平洋牡蛎、栉孔扇贝和皮海绵中有相关研究,且其功能相关研究未见实验性报道。
Tu等采用定量PCR技术,对海胆foxl2基因在胚胎期的mRNA表达进行了研究,根据实验结果仅得出其为合子基因的结论,未见进一步的深入研究[8]。
Naimi等研究发现太平洋牡蛎foxl2 mRNA主要在唇瓣和性腺中表达,其在两性性腺中的表达未见如脊椎动物所表现出的明显性别二态性,即除了在生长期有差别(卵巢是精巢的8倍)外,其他各时期无显著差别[6],由此认为foxl2是牡蛎性腺发育相关基因而不能确定其与性别相关。分析牡蛎与脊椎动物之间这一差别的原因认为,太平洋牡蛎的性别极易受外界环境影响,在自然条件下容易发生性逆转,是一种性别不稳定贝类[41-42],其性别的决定和性腺的发育受体内基因与外界环境的共同影响。在这种性别不稳定的无脊椎贝类中,foxl2的作用强度可能会受到许多外界环境因子的影响。进一步的原位杂交结果显示,太平洋牡蛎foxl2 mRNA在卵巢中仅定位在性细胞中,与脊椎动物性别稳定物种的表达存在差异,这样的差异是否代表了性不稳定物种的表达特征以及其在牡蛎中相关的功能如何,有待于深入研究。
与太平洋牡蛎不同,栉孔扇贝的性别相对稳定,是一种典型的单性别贝类[43]。其foxl2 mRNA在性腺中的表达特征[18]也有别于太平洋牡蛎,但与脊椎动物中的类似,即呈现出显著的性别二态性,是雌性相关基因[18]。栉孔扇贝中的这一表达特点暗示了该基因在性别稳定的无脊椎动物卵巢中的保守作用。
有关FOXL2蛋白水平的表达目前仅在海绵中有报道,免疫组化结果显示海绵的FOXL2蛋白在其各类细胞中都有所表达,被认为是一种发挥基础功能的转录因子[5]。这一结果或许与海绵尚无组织器官的分化有关。
4 结语
对于foxl2基因的研究长期以来主要集中在基因克隆、mRNA或蛋白水平的表达及定位上,其功能方面的研究相对较少,并仅有哺乳动物的相关报道。在哺乳动物以下的低等动物中的功能研究数据有限,而通过对已有的几种无脊椎动物的研究发现,该基因的表达具有多样性,这一特点是否暗示了该基因在功能上的多样性?有待进一步研究。因此探讨该基因在低等动物中的功能及相关进化分析将是下一步的研究重点。此外,为了更好地研究该基因作用的分子机理,其自身各水平的表达调控以及在动物中的组织表达特点的综合研究显得尤为重要。相关结果的积累将为系统理解该基因在动物中的作用提供科学数据。
[1] 曹冬梅,卢建.叉头框 (FOX)转录因子家族的结构与功能 [J].生命科学,2006,5:491-496.
[2] Crisponi L,Deiana M,Loi A,et al.The putative forkhead transcription factor FOXL2is mutated in blepharophimosis/ptosis/epicanthus inversus syndrome[J].Nat Genet,2001,27:159-166.
[3] Cocquet J,Pailhoux E,Jaubert F,et al.Evolution and expression of Foxl2[J].J Med Genet,2002,39:916-921.
[4] Nagahama Y.Molecular mechanisms of sex determination and gonadal sex differentiation in fish [J].Fish Physiol Biochem,2005(31):105-109.
[5] Adell T,Muller W E G.Isolation and characterization of five Fox(Forkhead)genes from the sponge Suberites domuncula [J].Gene,2004,334:35-46.
[6] Naimi A,Martinez A S,Specq M L,et al.Molecular cloning and gene expression of Cg-Foxl2during the development and the adult gametogenetic cycle in the oyster Crassostrea gigas [J].Comp Biochem Physiol B,2009,154:134-142.
[7] 张晶晶,李祥龙,周荣艳,等.不同物种FOXL2基因的生物信息学分析 [J].黑龙江畜牧兽医:科技版,2009,21:7-9.
[8] Tu Q,Brown C T,Davidson E H,et al.Sea urchin Forkhead genefamily:phylogeny and embryonic expression [J].Dev Biol,2006,300(1):49-62.
[9] Fan J Y,Han B,Qiao J,et al.Functional study on a novel missense mutation of the transcription factor FOXL2causes blepharophimosis-ptosis-epicanthus inversus syndrome(BPES)[J].Mutagenesis,2011,26(2):283-289.
[10] Shimeld S M,Degnan B,Luke G N.Evolutionary genomics of the Fox genes:Origin of gene families and the ancestry of gene clusters[J].Genomics,2010,95:256-260.
[11] Beysen D,Moumne L,Veitia R,et al.Missense mutations in the forkhead domain of FOXL2lead to subcellular mislocalisation,protein aggregation and impaired transactivarion [J].Hum Mol Genet,2008,17(13):2030-2038.
[12] Moumne L,Fellous M,Veitia R A.Deletions in the polyAlanine-containing transcription factor FOXL2lead to intranuclear aggregation[J].Hum Mol Genet,2005,14:3557-3564.
[13] Moumne L,Batista F,Benayoun B A,et al.The mutations and potential targets of the forkhead transcription factor FOXL2[J].Mol Cell Endocrinol,2008(282):2-11.
[14] Meyer A,Schartl M.Gene and genome duplications in vertebrates:the one-to-Four(-to-eight in fish)rule and the evolution of novel gene functions[J].Curr Opin Cell Biol,1999,11:699-704.
[15] Jiang W B,Yang Y H,Zhao D M,et al.Effects of sexual steroids on the expression of foxl2 in Gobiocypris rarus [J].Comp Biochem Physiol B,2011,160(4):187-193.
[16] Mazet F,Yu J K,Liberles D A,et al.Phylogenetic relationships of the Fox (Forkhead)gene family in the Bilateria [J].Gene,2003,316:79-89.
[17] Magie C R,Pang K,Martindale M Q.Genomic inventory and expression of Sox and Fox genes in the cnidarian Nematostella vectensis[J].Dev Genes Evol,2005,215:618-630.
[18] Liu X L,Zhang Z F,Shao M Y,et al.Sexually dimorphic expression of foxl2 during gametogenesis in scallop Chlamys farreri,conserved with vertebrates [J].Dev Genes Evol,2012,(222):279-286.
[19] Pailhoux E,Vigier B,Chaffaux S,et al.A 11.7-kb deletion triggers intersexuality and polledness in goats[J].Nat Genet,2001,29(4):453-458.
[20] Beysen D,Raes J,Leroy B P,et al.Deletions involving longrange conserved nongenic sequences upstream and downstream of FOXL2as a novel disease-causing mechanism in blepharophimosis syndrome[J].Am J Hum Genet,2005,77(2):205-218.
[21] Benayoun B A,Batista F,Auer J,et al.Positive and negative feedback regulates the transcription factor FOXL2in response to cell stress:evidence for a regulatory imbalance induced by disease-causing mutations [J].Hum Mol Genet,2009,18 (4):632-644.
[22] Hudson Q J,Smith C A,Sinclair A H.Aromatase inhibition re
duces expression of FOXL2in the embryonic chicken ovary[J].Dev Dynam,2005,3:1052-1055.
[23] Baron D,Cocquet J,Xia X,et al.An evolutionary and functional analysis of FoxL2in rainbow trout gonad differentiation [J].J Mol Endocrinol,2004,33:705-715.
[24] Liu Z,Wu F,Jiao B.Molecular cloning of doublesex and mab-3-related transcription factor 1,forkhead transcription factor gene 2,and two types of cytochrome P450aromatase in Southern catfish and their possible roles in sex differentiation[J].J Endocrinol,2007,194:223-241.
[25] Guiguen Y,Fostier A,Piferrer F,et al.Ovarian aromatase and estrogens:Apivotal role for gonadal sex differentiation and sex change in fish[J].Gen Comp Endocr,2010,165:352-366.
[26] Govoroun M S,Pannetier M,Pailhoux E,et al.Isolation of chicken homolog of the FOXL2gene and comparison of its expression patterns with those of aromatase duing ovarian development[J].Dev Dyn,2004,231:859-870.
[27] Loffler K A,Zarkower D,Koopman P.Etiology of ovarian failure in blepharophimosis ptosis epicanthus inversus syndrome:FOXL2is a conserved,early-acting gene in vertebrate ovarian development[J].Endocrinoloy,2003,144:3237-3243.
[28] 刘深基,陈松森.降钙素、降钙素基因相关肽基因前体RNA的加工 [J].国外医学分析生物学分册,1999,21(4):196-201.
[29] Cocquet J,Pannerier M,Fellous M,et al.Sense and antisense Foxl2transcripts in mouse[J].Genomics,2005,85(5):531-541.
[30] 毕延震,黄捷,姜黎.天然反义RNA(NATs):基因表达的重要调控分子 [J].中国生物化学与分子生物学报,2010,26(9):788-795.
[31] Benayoun B A,Auer J,Caburet S,et al.The posttranslational modification profile of the forkhead transcription factor FOXL2 suggests the existence of parallel processive/concerted modification parhways[J].Proteomics,2008,8(15):3118-3123.
[32] Ellsworth B S,Egashira N,Haller J L,et al.FOXL2in the Pi-tuitary:Molecular,Genetic,and Developmental Analysis[J].Mol Endocrinol,2006,20(11):2796-2805.
[33] Oshima Y,Uno Y,Matsuda Y,et al.Molecular cloning and gene expression of Foxl2in the frog Rana rugosa [J].Gen Comp Endocri,2008(159):170-177.
[34] 曲中玉,陈子江.FOXL2—不孕有关的转录因子 [J].生殖与避孕,2006,1:40-43.
[35] Wang D S,Kobayashi T,Zhou L Y,et al.Molecular cloning and gene expression of Foxl2in the Nile tilapia,Oreochromis niloticus[J].Biochem Bioph Res Co,2004(320):83-89.
[36] Nakamoto M,Mastsuda M,Wang D S,et al.Molecular cloning and analysis of gonadal expression of Foxl2in the medaka,Oryzias latipes[J].Biochem Bioph Res Co,2006,344:353-361.
[37] Batista F,Vaiman D,Dausset J,et al.Potential targets of FOXL2,a transcription factor involved in cranipfacial and follicular development,indentified by transcriptomics [J].Pro Natl Acad Sci USA,2007,104:3330-3335.
[38] Uda M,Ottolenghi C,Crisponi L,et al.Foxl2disruption causes mouse ovarian failure by pervasive blockage of follicle development[J].Hum Mol Genet,2004,13:1171-1181.
[39] Uhlenhaut N H,Jakob S,Anlag K,et al.Somatic Sex Reprogramming of Adult Ovaries to Testes by FOXL2Ablation [J].Cell,2009,139:1130-1142.
[40] Caburet S,Georges A,L′hote D,et al.The transcription factor FOXL2:At the crossroads of ovarian physiology and pathology[J].Mol Cell Endocrinol,2012,356(1-2):55-64.
[41] 姜波,王昭萍,于瑞海,等.多倍体贝类的繁殖生物学研究进展[J].海洋湖沼通报,2004(2):73-79.
[42] 吴仲庆.水产生物遗传育种 [M].第三版.厦门:厦门大学出版社,1991:44-45.
[43] 廖承义,徐应馥,王远隆.栉孔扇贝的生殖周期 [J].水产学报,1983,7(1):1-13.

