接种辫硫杆菌与活性污泥生物滴滤塔去除硫化氢效果对比
张兰河,宋 达 ,杨日光,张德义
(1东北电力大学化学工程学院,吉林 吉林 132012;2哈尔滨工业大学城市水资源与水环境国家重点实验室,黑龙江 哈尔滨 150090)
恶臭是污染环境、危害人体健康的重要公害之一。在某制药公司污水处理厂的水解酸化池中产生大量以硫化氢为主的难闻臭气,危及周围的空气环境和居民身体健康。解决以硫化氢为主的恶臭污染,是制药行业发展中面临的一个难题。恶臭处理技术有很多种,如物理法、化学法和生物法等[1-3]。生物脱臭法因其运行费用低、性能可靠、易于管理、处理效果好、二次污染小等特点,而成为近年来脱臭的主要方法。
生物滴滤法是废气处理技术之一,微生物附着在多孔载体表面形成具有较大比表面积的活性填料层,恶臭气体经过滴滤塔的填料层,污染物由气相经液相转移到填料层中被微生物利用,生物滴滤塔的处理效果主要取决于降解微生物的活性和数量。选择合适的接种微生物可以提高滴滤塔的去除能力、缩短启动周期和提高抗冲击负荷能力。用于接种的微生物可以是单一菌种也可以是复合菌种,国内外在这方面做了大量的工作[4-11],但是对单一菌种与混合菌种的对比研究较少。
本文作者采用两个相同的生物滴滤塔,一个接种制药废水处理厂活性污泥,另一个接种从制药废水中筛选得到的辫硫杆菌。在相同实验条件下,进行了为期4个多月的连续脱臭试验,特别对接种辫硫杆菌及接种活性污泥生物滴滤塔的去除效率、启动时间、压力损失、抗冲击负荷能力及氮利用率等进行了详细考察,为生物反应器的工程应用提供了科学依据。
1 实验方法与装置
1.1 脱硫菌的筛选与纯化
菌种来源于处理含有硫化氢气体的制药废水,将取得的样品加入生理盐水(0.9%NaCl)中,震荡摇匀,得到含有辫硫杆菌ZG11的悬浊液。用倍比稀释法将菌悬液稀释,选取适宜稀释度的菌悬液涂布无机盐培养基 C(Na2S2O3·5H2O,8 g;KH2PO4,2 g;MgCl2·6H2O,0.2 g;K2HPO4,2 g;NH4Cl,0.4 g;FeSO4·7H2O,0.01 g;H2O,1000 mL;琼脂,18g)[7]制得的平皿上,使菌落数介于30~300之间。随机挑取单菌落划线纯化,得到的单菌落再进行多次划线纯化,并通过革兰氏染色与显微镜观察判断是否为纯菌株,微生物的培养温度均为30 ℃。
1.2 生物滴滤塔的挂膜
从制药废水厂采集活性污泥放置于反应槽内,在其悬浮液中添加基本营养盐,为加速微生物的繁殖,加入一定量的葡萄糖控制COD在1500~2000 mg/L,以便使微生物得到充分的养料而处于对数增长期,适当加大曝气量,控制溶解氧在5~6 mg/L左右,经过静态曝气4天后,发现混合液中有许多细小絮体,经0.5 h静止,SV%=15。在显微镜的观察下,可看到许多游离细菌和细小菌胶团颗粒,对生物反应器B进行循环挂膜。同时,将从制药废水中筛选得到的辫硫杆菌ZG11扩大培养,接种生物反应器A。
在生物反应器的挂膜启动阶段及稳定运行阶段所采用的营养液成分相同,见表1。

表1 营养液的成分
1.3 生物滴滤塔的运行方法
实验装置由有机玻璃组成,直径 25 cm,高1.52 m。每个生物滴滤塔由3层填料组成,实验用的载体由软性填料及硬质填料组成。软性填料的直径均为 35 mm且被硬质填料所间隔,其体积比为4∶1,填充率为0.75。实验装置见图1。
实验采用逆流操作,硫化氢气体经气体流量计由塔底部进入生物滴滤塔,由上部出口排放。硫化氢气体采用动态法配制,即硫化钠液体由计量泵滴入硫酸储液罐中,硫化钠与硫酸反应制得。喷淋液由离心水泵经滴滤塔内填料层上方设置的喷水装置,定期向填料层喷洒经过配制的生物脱臭处理所需成分的喷淋液,为微生物提供养料和液相环境,喷淋出水由塔底部排出。运行参数见表2。
1.4 主要分析项目及方法
H2S采用检知管法,检知管由北京劳动保护研究所科技发展公司提供。检测范围:低浓度 0~50 mg/m3,3~75 mg/m3,30~300 mg/m3;中浓度 75~1500 mg/m3;高浓度 150~3000 mg/m3,300~7500 mg/m3。其它项目,如pH值、温度等,均按有关的环境监测标准定时采样分析。
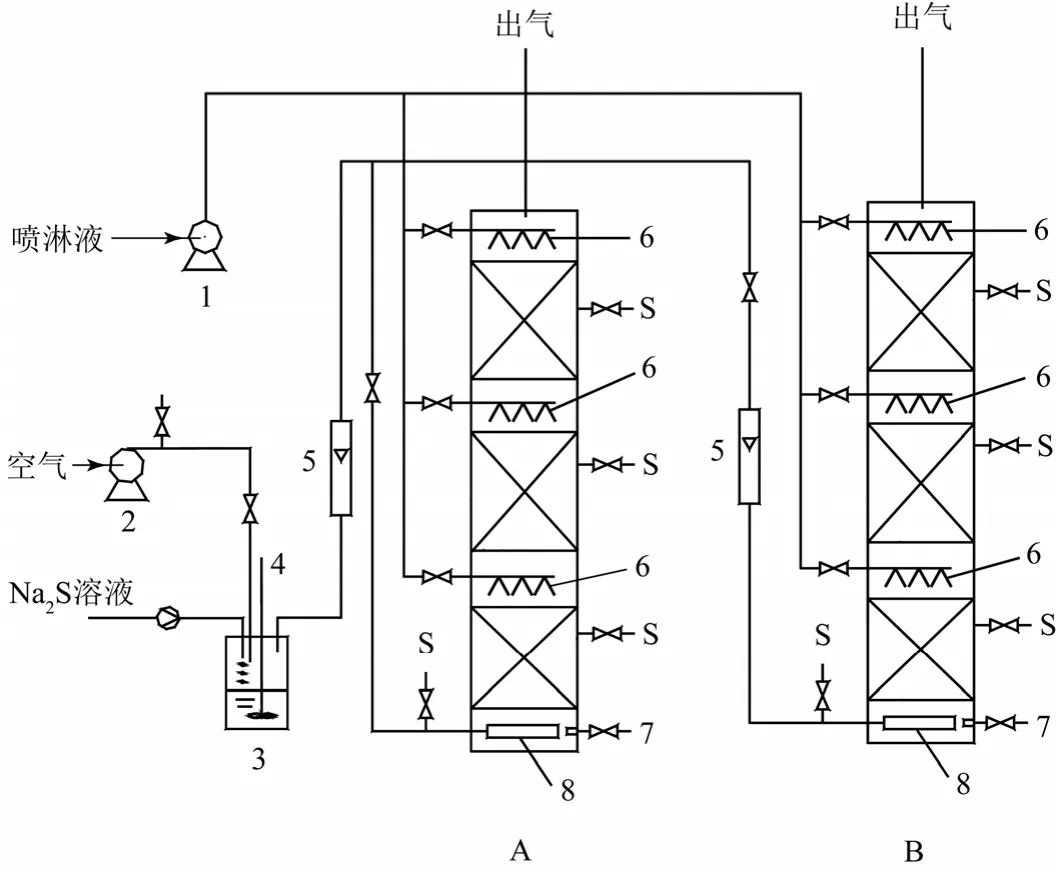
图1 生物脱臭试验工艺流程图
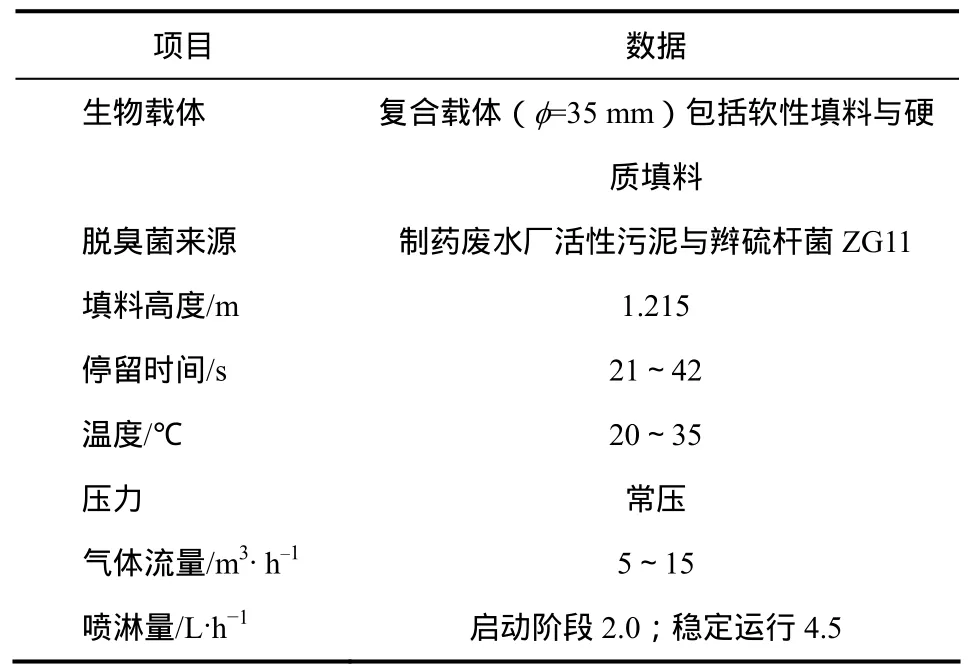
表2 实验运行的工艺参数
2 结果与讨论
2.1 生物反应器的启动
生物滴滤塔生物膜的固定化启动工艺是影响脱臭效果的重要技术,同时其挂膜启动周期也是重要的经济技术指标。

图2 ZG 11的光学显微照片
将筛选分离得到的ZG11进行生理生化实验,通过菌株的理化特征可以了解微生物的基本特性,对底物的利用情况。ZG11为短杆菌,直径约0.75 μm,长约1.5 μm,具有圆钝的末端,单生、对生,或者呈短链状排列,ZG11的光学显微照片如图2所示。菌株ZG11的生理生化指标如表3所示,根据《伯杰细菌鉴定手册》,将ZG11归类为辫硫杆菌属。在2 L/h的喷淋量下,将分离筛选得到的辫硫杆菌ZG11接种反应器A,反应器A与反应器B 曝气48 h后,同时通入低浓度的H2S气体,对接种不同来源菌种的生物滴滤塔进行驯化。从图3可以看出,反应器 B 接种活性污泥后,H2S进气浓度由5 mg/m3上升到接近120 mg/m3,大约15天后,出气浓度均低于2 mg/m3,去除率保持在99%左右。反应器A 接种辫硫杆菌ZG11后,H2S进气浓度由5 mg/m3上升到接近120 mg/m3,H2S出气浓度与去除率波动较大。经过持续29天的驯化,H2S出气浓度开始保持在2 mg/m3以下,H2S去除率稳定在98%以上。表明接种活性污泥的生物反应器具有较短的启动期、较好的微生物栖息性和抗负荷冲击性。通过镜检观察,生物滴滤塔B中微生物种类较多,有大量的丝状菌、杆菌,繁殖较快。生物滴滤塔A生物菌落单一,为自养菌,繁殖较慢。
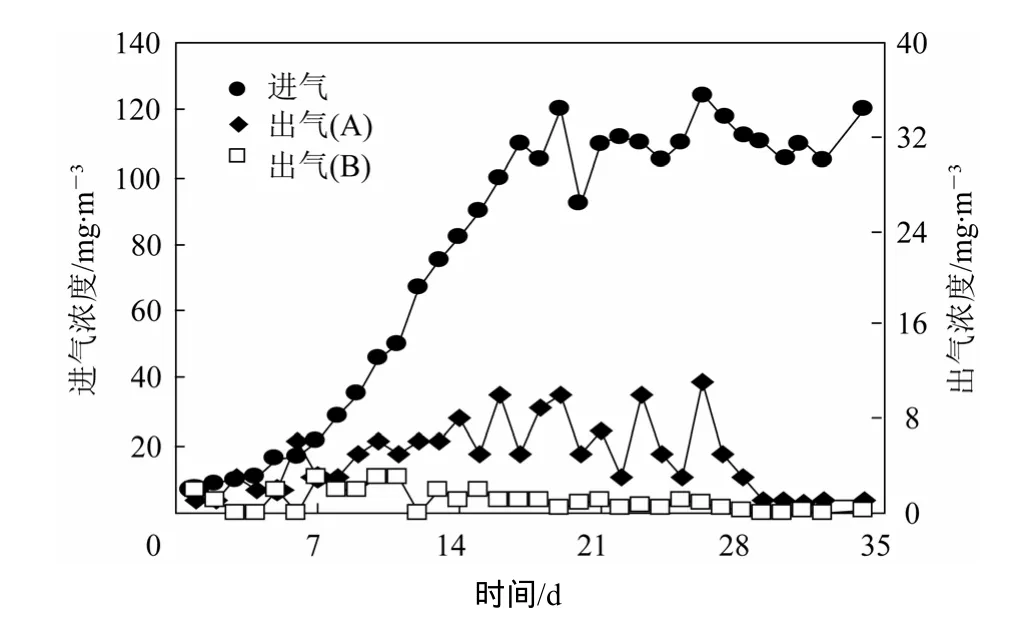
图3 生物反应器启动期的运行结果
这是因为混合菌来自污水处理厂,其菌种液中含有不同类群的微生物,食物链较长,故氧化效率高,降解速率快。而纯菌是在驯化培养的基础上,进一步进行了分离纯化,为单一菌种,易被硫化物达到饱和,故氧化速率较低。废气的生化处理有别于其它工业微生物学,并非菌种越纯越好,而应选择含有多种微生物相的菌液作为研究的菌种[12]。
2.2 进气浓度对去除率的影响
生物滴滤塔在 25~35 ℃的条件下连续运行,在进气流量为8 m3/h、喷淋水量为4.5 L/h的条件下,考察进气浓度对去除率的影响。
由图3可知,接种纯菌的生物反应器A,当进气浓度低于600 mg/m3时,随着进气浓度的增加,硫化氢的去除率接近 100%。当进气浓度超过 600 mg/m3时,硫化氢的去除率随着进气浓度的增加而下降。接种活性污泥的生物反应器B,当进气浓度低于750 mg/m3时,随着进气浓度的增加,硫化氢的去除率接近 100%。当进气浓度超过 750 mg/m3时,硫化氢的去除率随着进气浓度的增加而下降。图4结果表明,A塔对硫化氢的去除率在高负荷状态时低于B塔,图5所表示的去除速率NR随进气负荷Nv变化的结果也体现了与图4相同的倾向。

表3 ZG11生理生化指标
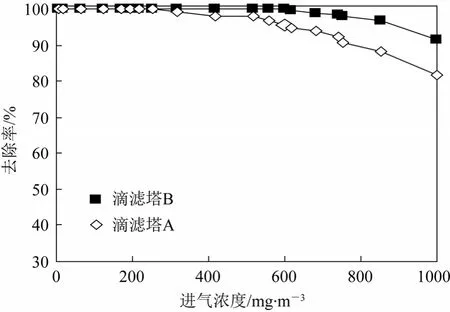
图4 进气浓度对去除率的影响
进气负荷对生物滴滤塔硫化氢去除速率的影响如图5所示。生物滴滤塔A和B的容积负荷变化范围为0.53~226.67 g/(m3·h)。运行结果表明,两种反应器的去除速率NR都是随着进气负荷Nv的增大而提高。在Nv分别低于 113.33 g/(m3·h)与 133.33 g/(m3·h)时,滴滤塔 A与B的去除速率NR随Nv的增加接近线性变化。当Nv分别高于以上值时,生物滴滤塔A与B的NR随Nv的增加呈非线性变化,进气负荷对生物滴滤塔造成了冲击。因此,与生物滴滤塔A相比,生物滴滤塔B具有较强的硫化氢去除能力,能够承受更高的进气负荷。在分析生物量时发现,生物滴滤塔A每克载体的平均生物量为7.01 mg,而生物滴滤塔 B每克载体的平均生物量是16.14 mg。因而,生物滴滤塔B较高的生物量可能是获得较高降解速率的重要因素之一。同时,微生物之间的协同效应可能是滴滤塔B获得较高降解速率的另一个重要因素。

图5 硫化氢进气负荷对去除速率的影响
2.3 压力损失
生物滴滤塔内的压力损失是重要的运行指标,它关系到能量的消耗,直接影响生物滴滤塔的运行成本。
在相同的液量、气量条件下,考察未挂膜新填料的压降与挂膜后生物填料的压降对比,结果如图6所示。生物滴滤塔的压降随着入口气速的增大而增大,接种后运行稳定的生物滴滤塔总压降明显高于未挂膜的新鲜填料,这是因为未挂膜填料层的孔隙率较大,压力损失主要由多孔填料中的沿程阻力损失构成。然而,挂膜后填料表面覆盖生物膜,其孔隙率减小,有多孔填料缩放结构造成的局部阻力损失增大,同时生物膜吸附较多的水分,液膜厚度增加,造成填料层压力损失进一步增大。生物滴滤塔B的生物量较大,繁殖较快,造成了较高的压力损失,其压力损失明显高于塔A。
2.4 氮源对H2S去除率的影响
氮是微生物细胞的重要组成部分,约占细胞干重的10%~15%。氮源提供微生物合成自身细胞蛋白质的物质,对污染物的生物降解能够产生重要的作用。在硫化氢进气浓度为600 mg/L及其它营养元素浓度不变的条件下,主要考察氮源对去除率的影响。实验中采用尿素作为微生物的氮源,一方面尿素中的氮元素能够为微生物提供氮源,另一方面尿素中的C和O元素由生物降解后主要生成CO2和H2O,对环境危害较小。

图6 不同流量下压力损失的变化

图7 喷淋液中尿素浓度对去除率的影响
在气相生物滴滤塔的实际运行中,喷淋液不是均匀地流过填料表面,而是以股流、沟流的方式流动。因此,在喷淋液流过的填料表面,氮源的浓度较高,而其它区域氮源的供给则通过填料间隙的液体和生物膜中的扩散来完成。当喷淋液中氮源浓度升高时,填料中氮源的浓度梯度增加,扩散通量也增加,从而能够提高生物滴滤塔的去除效果。
由图7可知,随着喷淋液中尿素的浓度增加,生物反应器A与B的去除率均有一定的提高,系统运行效果的稳定性也得到一定的增强。相比之下,氮源对生物反应器B的影响较大。接种活性污泥的生物反应器B 由微生物菌群组成,包括自养菌与异样菌,对氮源的利用率较高,因此受到氮源的影响较大。然而,生物反应器A主要由自养菌组成,对氮源的利用率较低,受到氮源的影响较小。
3 结 论
两种生物膜反应器处理H2S恶臭气体的实验表明了生物脱臭方法脱臭效率高、安全可靠等特点。经过长期的运行结果,得出如下结论。
(1)在2 L/h的喷淋量下,接种活性污泥的生物反应器启动较快,大约需要15天的驯化期。接种辫硫杆菌的生物反应器启动相对较慢,大约需要29天的驯化期。
(2)与接种辫硫杆菌的生物滴滤塔A相比,接种混合菌种的生物滴滤塔 B具有较强的去除能力,对H2S单位体积基质利用率高,能够承受更高的进气负荷。在去除率接近 100%的条件下,滴滤塔A与B的最大进气负荷分别为113.33 g/(m3·h)和133.33 g/(m3·h),最大进气浓度分别为600 mg/m3和750 mg/m3。
(3)在相同的液量、气量条件下,生物滴滤塔A与B的压力损失随进气流量的增加均提高,接种混合菌种生物滴滤塔B的压力损失明显高于接种纯菌的生物滴滤塔A。
(4)随着喷淋液中尿素的浓度增加,生物反应器的去除率和运行效果的稳定性均得到一定的增强。接种辫硫杆菌的生物反应器A主要由自养菌组成,对氮源的利用率较低,受到氮源的影响较小。接种活性污泥的生物反应器B由微生物菌群组成,对氮源的利用率较高,受氮源的影响较大。
[1] Bouzaza A,Laplanche A,Marsteau S. Adsorption–oxidation of hydrogen sulfide on activated carbon fibers:Effect of the composition and the relative humidity of the gas phase[J].Chemosphere,2004,54(4):481-488.
[2] Prepiorski J,Yoshida S,Oya A. Structure of K2CO3-loaded activated carbon filter and its deodorization ability against H2S gas[J].Carbon,1999,37(12):1881-1890.
[3] Seongyup K,Deshusses M A. Understanding the limits of H2S degrading biotrickling filters using a differential biotrickling filter[J].Chemical Engineering Journal,2005,113(2-3):119-126.
[4] Montebello A M,Fernández M,Almenglo F. Simultaneous methylmercaptan and hydrogen sulfide removal in the desulfurization of biogas in aerobic and anoxic biotrickling filters[J].Chemical Engineering Journal,2012,200–202(15):237-246.
[5] 瞿飞. 污水处理厂的恶臭污染控制技术[J]. 北方环境,2012,24(4):67-68.
[6] 刘波,姜安玺,程养学,等. 两级滴滤去除硫化氢和甲硫醇混合恶臭气体[J]. 中国环境科学,2003,23(6):618-621.
[7] Wan S G,Li G Y,An T C. Co-treatment of single,binary and ternary mixture gas of ethanethiol,dimethyl disulfide and thioanisole in a biotrickling filter seeded with Lysinibacillus sphaericus RG-1[J].Journal of Hazardous Materials,2011,186(2-3):1050-1057.
[8] Chung Y C,Huang C H,Tseng C P. Removal of hydrogen sulphide by immobilizedThiobacillussp. strain CH11 in a biofilter[J].Journal of Chemical Technology and Biotechnology,1997,69(1):58-62.
[9] Shinabe K,Oketani S,Ochi T,et al. Characteristics of hydrogen sulfide removal in a carrier-packed biological deodorization system[J].Biochemical Engineering Journal,2000,5(3):209-217.
[10] Janssen A J H,Lettinga G,Keizer A D. Removal of hydrogen sulphide from wastewater and waste gases by biological conversion to elemental sulphur[J].Colloids and Surfaces,A:Physicochemical and Engineering Aspects,1999,151(1-2):389–397.
[11] Park D H,Cha J M,Ryu H W,et al. Hydrogen sulfide removal utilizing immobilizedThiobacillussp. IW with Ca-alginate bead[J].Biochemical Engineering Journal,2002,11(2-3):167-173
[12] 黄兵,杜永林,孙佩石,等. 生物法净化低浓度硫化氢废气的基础研究[J]. 云南化工,1998(3):17-19.

