一种合成三氯蔗糖-6-乙酯的新方法
冷一欣,刘晓成,苏继光,黄成龙,张 云,万屹东,骆许峰,李建吉
(1常州大学石油化工学院,江苏省绿色催化材料与技术重点实验室,江苏 常州 213164;2常茂生物化学工程股份有限公司,江苏 常州 213034)
三氯蔗糖[1]早在20世纪70年代由著名的甜味剂公司 Tate&Lyle公司[2]研制而成。它具有口味纯正、生理安全性高、高甜度、低热量、不被人体吸收的优点[3],是国际市场上最具竞争力的甜味剂之一。
目前,合成三氯蔗糖的路线主要有全基团保护法[4-5]、单基团保护法[6-8]和酶法[9]。与其它两种方法相比,单基团保护法具有合成步骤少、操作简单、投资少等优点,是目前工业化的首选路线。三氯蔗糖-6-乙酯是合成三氯蔗糖最重要的中间体。采用单基团保护法,在反应过程中进行二次缩醛化能显著提高蔗糖-6-乙酯的收率。蔗糖-6-乙酯在合适的条件下与氯化试剂反应制得三氯蔗糖-6-乙酯。氯化试剂主要有SOCl2/吡啶/氯代烃体系[10-11]和Vilsmeier 试剂体系[12]。Vilsmeier试剂体系具有分子量大、空间位阻大、选择性强、收率较高等优点,适合工业化。Vilsmeier试剂主要由无机酸氯化物(如 SOCl2、COCl2、PCl5、POCl3)与N-酰胺类化合物(如N,N-二甲基甲酰胺、N,N-二甲基乙酰胺、N,N-二乙基甲酰胺等)制备。目前 Vilsmeier 试剂主要用 SOCl2制备,产生大量的高污染气体 SO2,造成严重的环境污染且氯代收率较低。已有文献指出[13],以COCl2替代SOCl2制备Vilsmeier 试剂能够减少环境污染,但是COCl2剧毒,易泄露,危险性比较高,不易实现工业化。而选用固体光气(BTC)代替SOCl2具有不可取代的优点,固体光气是固态物,具备易计量、不易泄露、低毒、不污染环境等优点。因此,以固体光气制备 Vilsmeier试剂合成三氯蔗糖-6-乙酯有广阔的工业化前景。
1 实验部分
1.1 试剂与仪器
DMF,工业级,扬子石化-巴斯夫有限责任公司;固体光气,工业级,山西碧春生物科技有限公司;氨气,工业级,泰兴泰昌化工原料有限公司;原乙酸三甲酯,工业级,常州方正化工有限公司;甲苯、氢氧化钠、乙酸乙酯、36%盐酸、吡啶,AR,国药集团化学试剂有限公司;蔗糖-6-乙酯,自制。
JA2003电子天平,上海良平仪器仪表有限公司;RE2000旋转蒸发仪,上海亚荣生化仪器厂;SLPC-3030 低温恒温循环器,南京顺流仪器有限公司;Waters-717高效液相色谱仪,美国Waters公司;Avance 300MHz核磁共振波谱仪,德国Bruker公司;PROTÉGÉ460型傅里叶红外光谱仪,美国 Nicolet公司;PHS-3C 微机型 pH计,上海康仪仪器有限公司。
1.2 仪器与设备
本研究的合成路线如图1所示。
1.3 实验方法
1.3.1 蔗糖-6-乙酯的合成
将装有机械搅拌、回流冷凝管和温度计的500 mL四口烧瓶中投入25 g(0.0730 mol)蔗糖,后投150 g(2.0520 mol)DMF,升温溶解。投17.5 g(0.1456 mol)原乙酸三甲酯和 0.1 g(0.5814 nmol)催化剂对甲苯磺酸,反应4 h进行乙酰化。加水10.0 g(0.5555 mol)开环,加3.5 g(0.0291 mol)原乙酸三甲酯和0.04 g(0.2325 nmol)对甲苯磺酸,反应1 h,加3.0 g(0.0410 mol)叔丁胺迁移,反应1 h。浓缩,得蔗糖-6-乙酯糖浆 24.93 g,后加 10 g(0.1368 mol)DMF溶解蔗糖-6-乙酯糖浆,以蔗糖计,收率88.8%。
1.3.2 三氯蔗糖-6-乙酯的合成
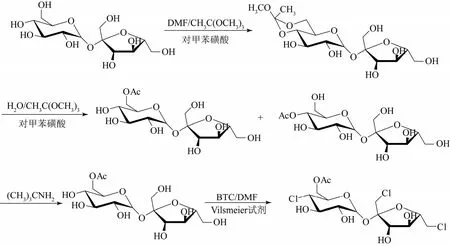
图1 三氯蔗糖-6-乙酯的合成路线图
将 96.2 g(0.3241 mol)固体光气预先溶解在120 g(1.3024 mol)甲苯中,在0~5 ℃下缓慢的滴加到80 g(1.0944 mol)DMF中,后加入上述所得蔗糖-6-乙酯溶液,控制体系温度在10~20 ℃。滴加完毕后,在室温下搅拌1 h,再加吡啶调pH=7后,2 h升温到70 ℃,保温2 h,2 h升温到90 ℃,保温2 h,3 h升温到110 ℃,保温2 h,程序升温结束。将反应液控制在 10 ℃左右,加入质量分数32%的NaOH溶液,调pH=7.5,再用质量分数36%的盐酸反调pH=7。减压浓缩至干,加100 g水,用乙酸乙酯萃取4次(4×200 mL),合并有机相,减压除乙酸乙酯,得糖浆。用乙酸乙酯结晶,得到粗品,再用水重结晶得白色固体14.33 g。以蔗糖计,收率为64.5%。二步反应总收率为57.3%。熔点76~78 ℃,纯度(HPLC)98.3%。IR(cm−1): 3409.4(νO—H),1370.7~1445.8 和 2911.4(νC—H),735.8~922.5(νC=Cl),1249.6 和 1732.3(νC=O)。1H NMR(CD3OD,300MHz,δz):3.61(d, H-6);3.64(s,H-1′);3.72~3.74(d, H-6′);3.79~3.80(d, H-2);3.96~3.97(t, H-4′);3.94(m, H-5′);4.03~4.06(d,H-3);4.08~4.30(m, H-3′,5);4.39~4.41(d, H-4);5.36~5.37(d, H-1)。
1.3.3 产品的纯度分析条件
三氯蔗糖-6-乙酯色谱条件:ULtimate C 18柱(250 mm×4.6 mm);流动相为V(甲醇)∶V(水)=1∶1,等度洗脱,流速1.0 mL/min;柱温为40 ℃;进样量20 μL;Waters-2410示差折光检测器。
2 结果与讨论
2.1 二次乙酰化投料对蔗糖-6-乙酯收率的影响
2.1.1 单因素实验结果与分析
原乙酸三甲酯一次乙酰化后蔗糖-6-乙酯的收率最高达到70.2%[14],造成氯化蔗糖-6-乙酯制备三氯蔗糖-6-乙酯收率较低。拟采用二次乙酰化来提高蔗糖-6-乙酯的收率。将装有机械搅拌、回流冷凝管和温度计的四口烧瓶中投入25 g蔗糖,后投150 g DMF,升温溶解。一次乙酰化加17.5 g原乙酸三甲酯和0.1 g催化剂对甲苯磺酸,反应4 h进行乙酰化。加水(6.0~14.0 g)开环,二次乙酰化加原乙酸三甲酯(1.5~5.5 g)和催化剂对甲苯磺酸(0.01~0.08 g),反应1 h,加3.0 g叔丁胺迁移,反应1 h。浓缩,得蔗糖-6-乙酯,蔗糖-6-乙酯收率见图2~图4所示。
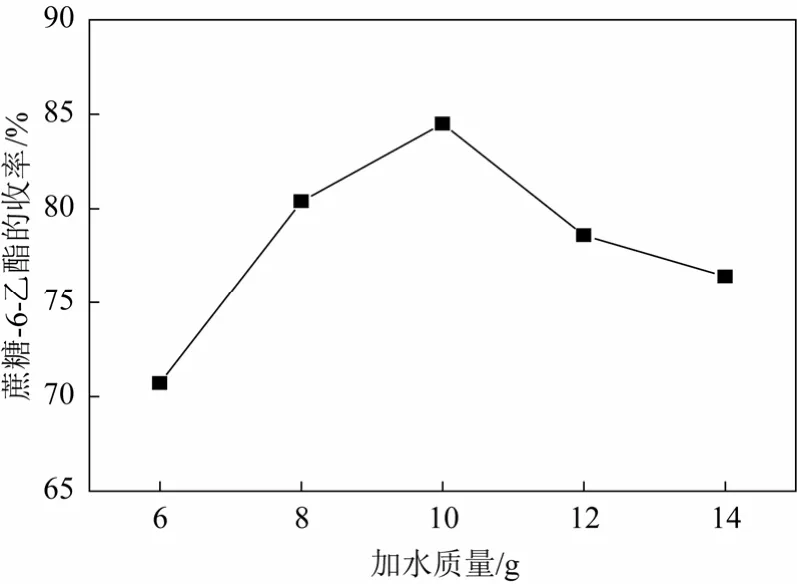
图2 加水质量对合成蔗糖-6-乙酯收率的影响
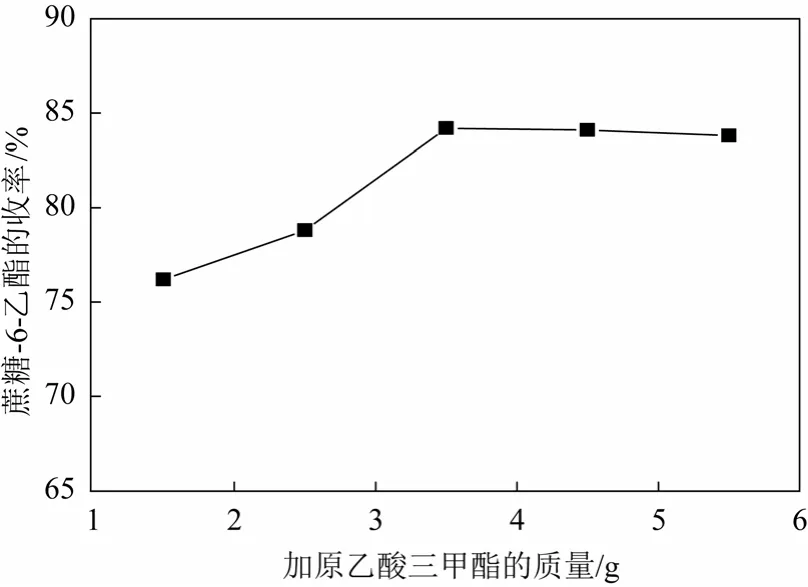
图3 原乙酸三甲酯质量对合成蔗糖-6-乙酯收率的影响
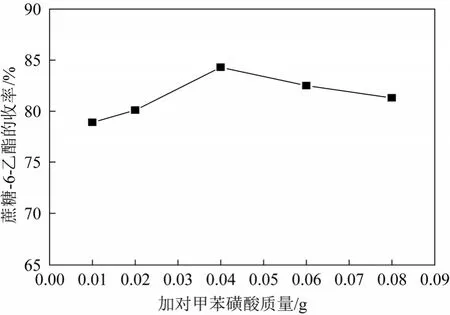
图4 对甲苯磺酸质量对合成蔗糖-6-乙酯收率的影响
图2表明当加水质量小于10 g时,蔗糖-6-乙酯收率随着加水量升高,原因是一次乙酰化形成的环酯开环需要足够的水;当加水质量大于10 g时,蔗糖-6-乙酯收率随着加水量降低,原因是环酯开环后形成的蔗糖-4-乙酯和蔗糖-6-乙酯在过量水的条件下会水解成蔗糖。所以选择加水量10 g较为适宜。图3表明原乙酸三甲酯用量的增加,蔗糖-6-乙酯收率呈增加趋势,当原乙酸三甲酯用量达到3.5 g时,蔗糖-6-乙酯的收率达到最大。水解形成的蔗糖在有原乙酸三甲酯的条件下,二次乙酰化大大提高了蔗糖-6-乙酯的收率。所以原乙酸三甲酯用量选择为3.5 g。图4表明随对甲苯磺酸用量增加,蔗糖-6-乙酯收率呈现先升后降的趋势,当对甲苯磺酸用量小于0.04 g,有利提高蔗糖-6-乙酯的收率;当对甲苯磺酸用量大于0.04 g,蔗糖-6-乙酯收率呈略微下降趋势,原因可能是因为随着对甲苯磺酸用量的增加,溶液体系的pH值下降,在酸性条件下,蔗糖-6-乙酯会水解,最终降低蔗糖-6-乙酯的收率。所以对甲苯磺酸用量选择0.04 g。因此必须二次乙酰化蔗糖来提高蔗糖-6-乙酯的收率。
2.1.2 二次乙酰化投料比正交试验结果与分析
根据上述单因素实验设计 L9(34)正交实验,见表1所示。
从表2可以看出,影响开环水解因数顺序为A1>B1>C1,最佳配比组合A12B12C13,故开环水解二次乙酰化最佳投料为10.0 g H2O,3.5 g原乙酸三甲酯和0.06 g对甲苯磺酸。根据最优条件,多次验证实验得蔗糖-6-乙酯平均收率88.0%。

表1 二次乙酰化正交试验因素位级表
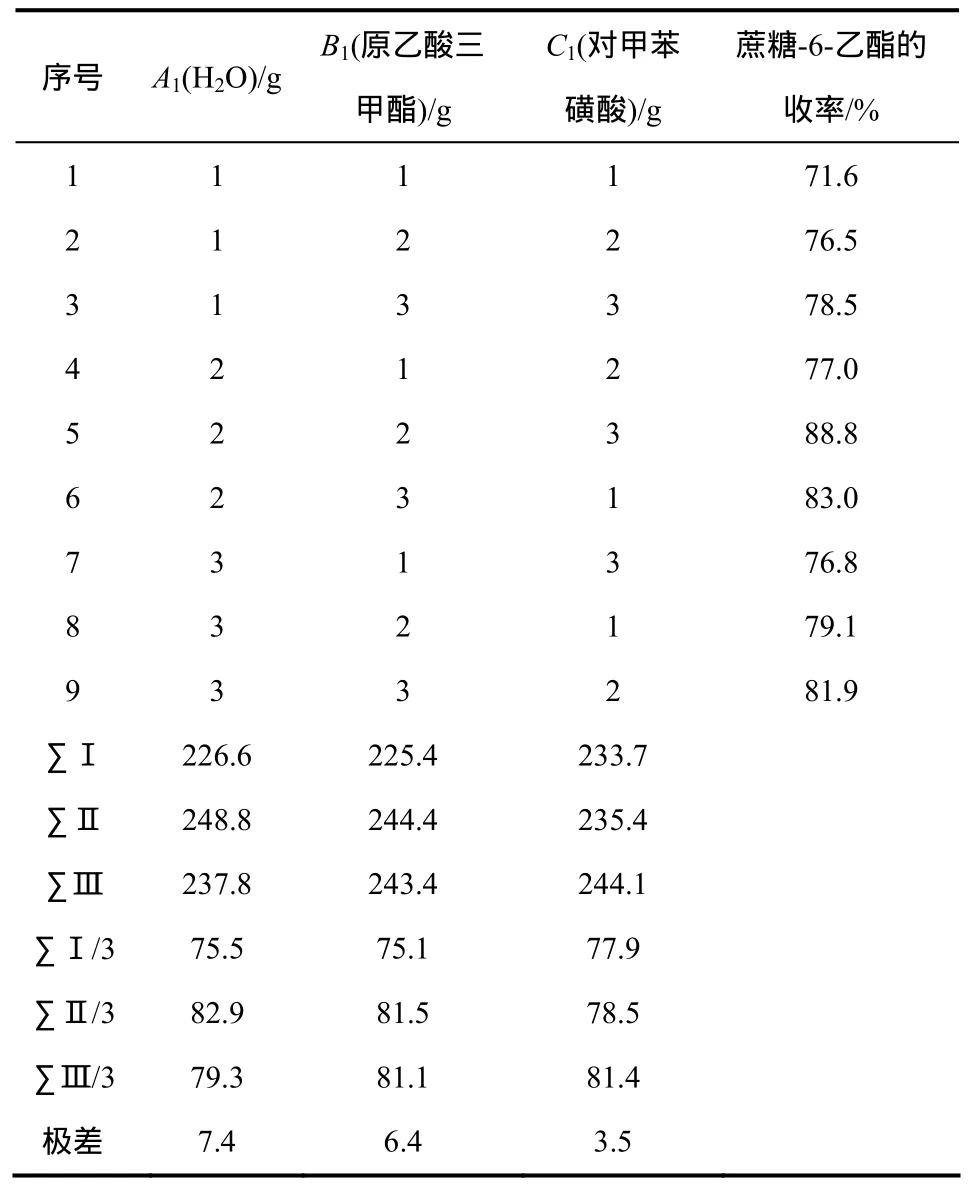
表2 正交实验结果
2.2 投料比对蔗糖-6-乙酯氯代反应的影响及其副产物
1 mol的BTC相当于3 mol的光气。在反应中,1 mol的BTC能合成3 mol的Vilsmeier试剂,所以只有当BTC完全的分解成光气,再与DMF反应形成 Vilsmeier试剂才能进行较好的氯代反应。Vilsmeier试剂在一定条件下可以高选择性的氯代蔗糖-6-乙酯上的6′、4和1′位上的羟基。在蔗糖分子中,8个羟基所处的位置和活性各不相同[15-16],各羟基大致活性分为:6′—OH、6—OH>4—OH>1′—OH>其它位—OH,将6—OH保护起来,剩余3个活性较强的羟基就是需要氯代的位置。确定合成蔗糖-6-乙酯条件相同,氯代升温过程相同(2 h升温到70 ℃,保温2 h;2 h升温到90 ℃,保温2 h;3 h升温到110 ℃,保温2 h),根据实验现象分析,选择蔗糖-6-乙酯与 BTC试剂的摩尔投料比为1∶1~1∶6,考察投料比对氯化反应影响,结果见表3所示。

表3 投料比对氯代反应的影响
蔗糖-6-乙酯与 BTC试剂的摩尔投料比为 1∶1~1∶3时,蔗糖-6-乙酯上的7个羟基不能够完全与Vilsmeier试剂反应形成A,导致剩余的羟基裸露,在高温条件下发生炭化,收率较低。蔗糖-6-乙酯与BTC的摩尔投料比为1∶4时,理论上蔗糖-6-乙酯上的羟基能够与 Vilsmeier 试剂完全反应形成 A,但在实际的反应中,三光气在适宜的条件下分解成光气,有一定量的光气与DMF来不及反应会溢出,使光气得不到充分的利用,导致Vilsmeier试剂会有所下降,最终收率下降;蔗糖-6-乙酯、DMF中含有一定量的水分,Vilsmeier试剂会优先与水反应;蔗糖-6-乙酯中含有一定量的蔗糖,也消耗一定量的Vilsmeier试剂。蔗糖-6-乙酯与BTC的摩尔投料比为1∶6时,在反应中可能会有一定量的三光气直接与蔗糖-6-乙酯发生反应,会引起副产物的增多;过量的 BTC在高温下参与反应,可能形成聚糖类物质,产生焦油(如图5所示)。在蔗糖-6-乙酯与BTC的摩尔投料比为1∶5时反应炭化一般、无焦油,且总收率较高,达到57.3%,所以选用蔗糖-6-乙酯与BTC的摩尔投料比为1︰5最为合适。
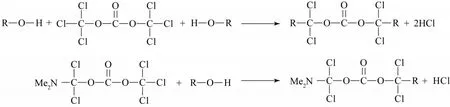
图5 蔗糖-6-乙酯氯代反应的副反应
2.3 氯代升温时间的确定
2.3.1 单因素实验结果与分析
在投料相同的条件下,分别研究一氯代时间(1 h、2 h、3 h、4 h、5 h)、二氯代时间(1 h、2 h、3 h、4 h、5 h)和三氯代时间(1 h、2 h、3 h、4 h、5 h)对合成三氯蔗糖-6-乙酯的影响,三氯蔗糖-6-乙酯收率见图6~图8所示。

图6 一氯代升温时间对三氯蔗糖-6-乙酯总收率的影响

图7 二氯代升温时间对三氯蔗糖-6-乙酯总收率的影响

图8 三氯代升温时间对三氯蔗糖-6-乙酯总收率的影响
根据图6~图8,在整个氯代反应升温过程中,每个阶段的升温时间都在2 h后三氯蔗糖-6-乙酯的收率都趋于稳定。可能原因是在升温2 h后,达到了氯代所需要的能量,继续延长时间并不能提高产物的收率。
2.3.2 氯代升温时间正交试验结果与分析
已有文献[17]报道,升温过程比较简单,可以快速、直接升温到110 ℃。但是在实际反应过程中,蔗糖-6-乙酯上 7个羟基上面的-O-烷基氯盐(图9中A),如果升温过快,会导致炭化严重和过氯化。因此,升温速度的快慢,直接影响产物的收率,根据单因素实验设计L9(34)正交实验,见表4所示。
从表5可以看出,氯代时间阶段影响因素顺序为:A2(一氯代时间) >B2(二氯代时间) >C2(三氯代时间)。最佳配比组合A22B22C23。根据最优条件,经过多次验证实验得三氯蔗糖-6-乙酯总平均收率56.9%。最佳氯代时间阶段为:一氯代升温时间为2 h,二氯代升温时间2 h,三氯代升温时间3 h。升温时间短不容易得到三氯蔗糖-6-乙酯,可能由于在升温过程中,氯代键位所需能量是逐步积累的,达不到所需能量氯代效率就会降低,因此氯代升温时间也是重要的一个条件。
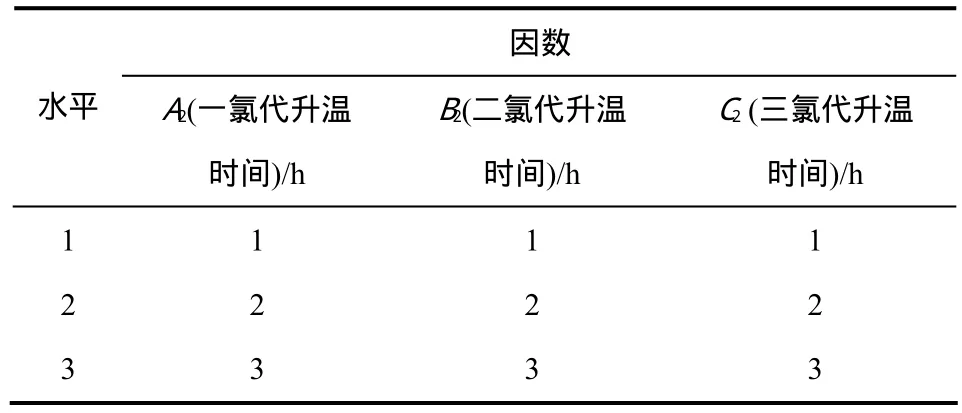
表4 氯代升温时间正交试验因素位级表
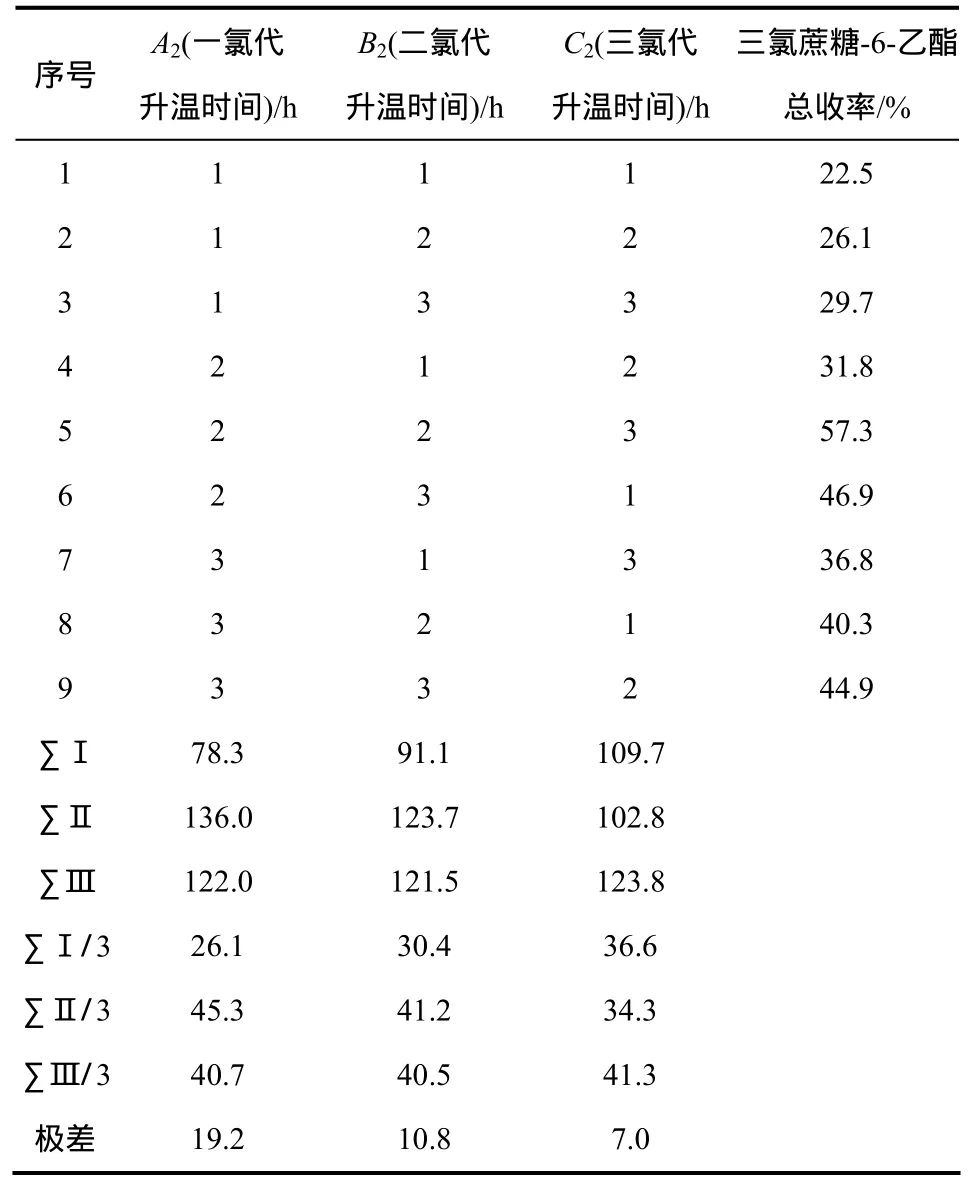
表5 正交实验结果
2.4 氯代缚酸剂的选用
投料条件相同条件下,将蔗糖-6-乙酯滴加到Vilsmeier试剂中,在室温条件下反应1 h,生成蔗糖-6-乙酯-O-烷基氯盐(图9中A,在滴加后,HPLC分析无蔗糖-6-乙酯的出现)和盐酸,氯代升温条件相同。通过实验对比发现,未用缚酸剂的反应中出现了大量的焦油和炭化现象。在强酸性体系下高温进行氯代反应将大大降低三氯蔗糖-6-乙酯的收率。所以需将体系在升温前进行缚酸处理。选用有机碱吡啶、无机碱氨气和固体氢氧化钠作为缚酸剂来考察对反应的影响,结果见表6所示。
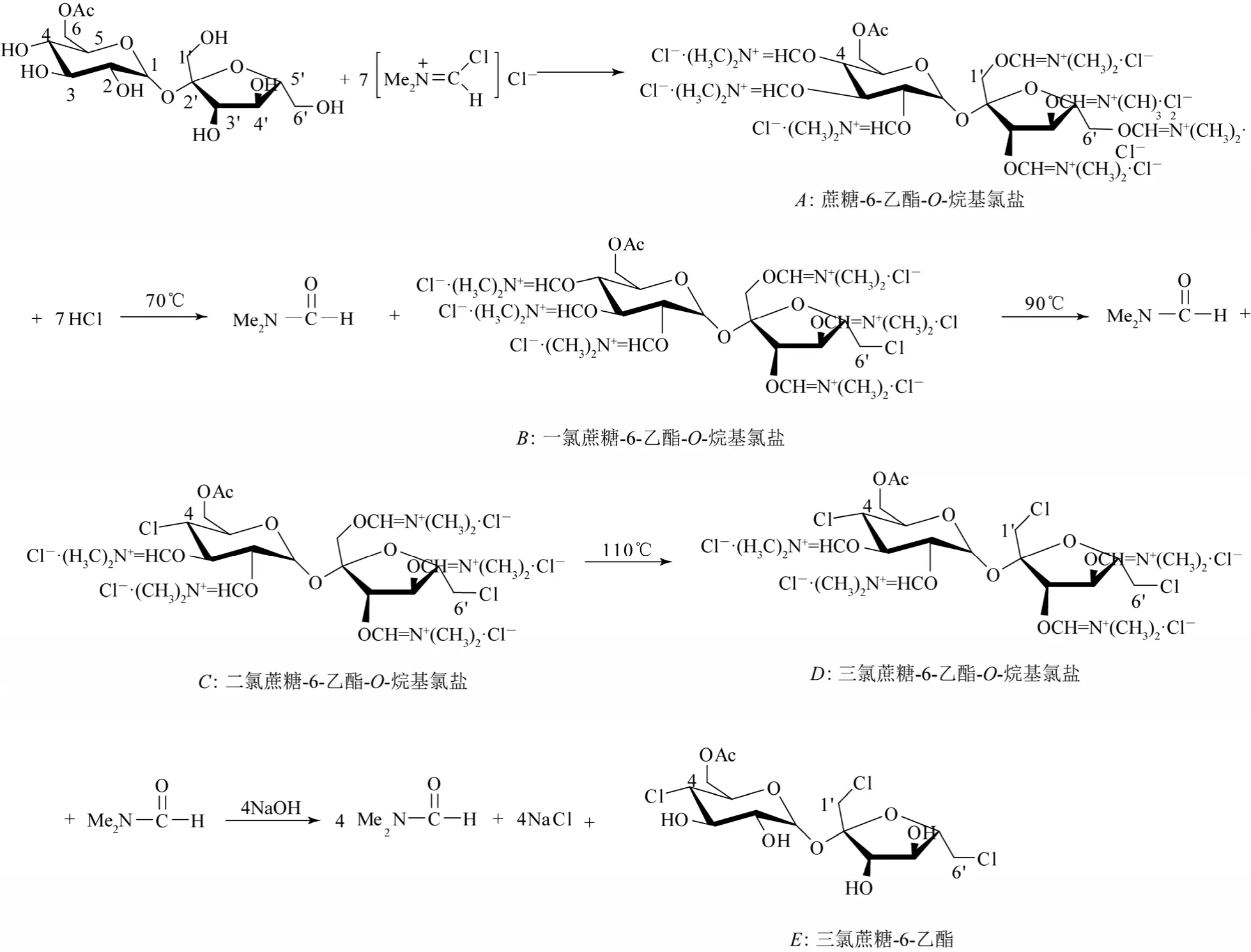
图9 高温氯代反应过程
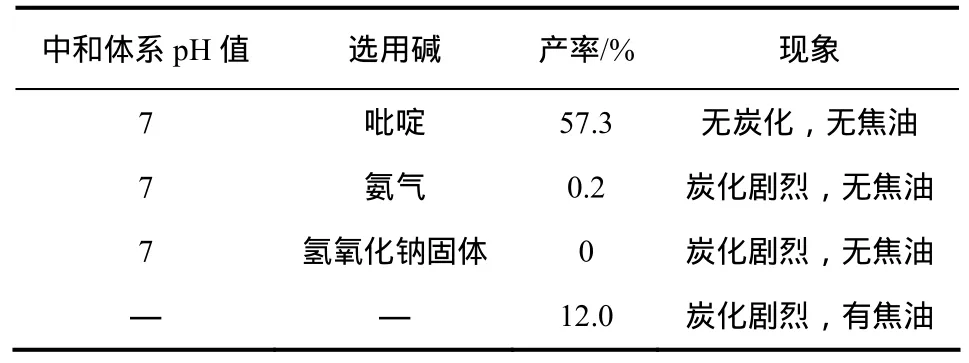
表6 不同氯代缚酸剂对反应的影响
从表6中可以明显发现选用有机碱明显好于无机碱。吡啶在体系中与盐酸形成吡啶盐,能够有效地中和体系中的酸,能避免强酸性体系在高温氯代反应中破坏产物结构,并且吡啶在氯代反应能很好地提高Vilsmeier试剂氯代对蔗糖-6-乙酯的选择性;选用无机碱不仅中和体系中的酸,也参与破坏蔗糖-6-乙酯-O-烷基氯盐的结构(图9中A),还原成蔗糖。因此在高温条件下会将原料体系炭化,故反应后得不到产物。
2.6 氯代过程分析
在实验过程中,直接升温反应后,得不到三氯蔗糖-6-乙酯,所以怀疑氯代反应没有很好地进行,根据诸多数据,阶段升温能使蔗糖-6-乙酯-O-烷基氯盐按阶段反应,反应进程见图9。在反应中,Vilsmeier试剂能与蔗糖-6-乙酯能很好地结合成蔗糖-6-乙酯-O-烷基盐,由于各个羟基活性的不同直接导致了各个氯代位置需要的能量不同,因此分阶段氯代是必然的结果。
在氯代反应中,根据SN2机理来解释,图9中6′、4、1′位上的羟基经氯代后,由于 6′和 1′位上的碳原子是伯碳,能够自由翻转,不存在构型转换现象,而4位上的碳原子则发生“瓦尔登”翻转,使蔗糖中的葡萄糖基转化为半乳糖构型。
3 结 论
(1)以蔗糖为原料,蔗糖经二次乙酰化反应合成蔗糖-6-乙酯最佳合成条件为:m(H2O)∶m(原乙酸三甲酯)∶m(对甲苯磺酸)=10.0∶3.5∶0.06。以蔗糖计,该方法收率达到 88.8%,高于其它文献值,能够满足工业化的需求。
(2)在n(蔗糖-6-乙酯)∶n(BTC)=1∶5时,经吡啶缚酸调pH=7。经三阶段升温:2 h升温到70 ℃;2 h升温到90 ℃;3 h升温到110 ℃,反应收率达64.5%,二步总收率达到57.3%。本研究易于推广,有利于三氯蔗糖的工业化。
[1] 田铁牛,田玉珍. 甜味剂三氯蔗糖的合成技术的研究进展[J]. 河北化工,2006,29(5):3-6.
[2] 李鹏飞,李宗石,乔卫红. 非营养型甜味剂——三氯蔗糖[J]. 化工进展,2005,24(11):1253-1256.
[3] 段胜林. 三氯蔗糖的制备及新的甜受体模型[J]. 食品工业科技,1999,20(3):13-15.
[4] 黄素梅,黎四芳,张海广,等. 甜味剂三氯蔗糖的合成工艺与应用研究进展[J]. 化工进展,2000,19(4):56-57,61.
[5] 郑建仙,李璇,袁尔东. 全基团保护法制备三氯蔗糖的研究[J]. 食品与发酵工业,2002,33(2):1-6.
[6] Navia J L. Process for synthesizing sucrose derivatives by regioselective reaction:US,4950746 [P].1990-08-21.
[7] 马志玲,王延平,彭志英. 单酯法合成高甜度甜味剂——三氯蔗糖的研究[J]. 食品科学,2002,23(5):51-54.
[8] Clark J D,Lemayr Jr R R. Method for the synthesis of sucrose-6-esters:US,6939962 [P].2003-08-21.
[9] 陈金娥. 超级甜味剂三氯蔗糖的开发与研究[J]. 酿酒科技,2007,28(2):29-34.
[10] Jones J D,Hacking A J,Cheetham P S J. Biological method for protection of 6-position of sucrose and its use in synthesis of disaccharide high-intensity sweeter[J].Biotech.&Bioeng.,1992,39(2):203-210.
[11] Bennett C,Dordick J S,Hacking A J,et al. Biocatalytic synthesis of disaccharide high-intensity sweeterner sucraloseviaa tetrachlororaffinose intermediate[J].Biotech.&Bioeng.,1992,39(2):211-217.
[12] Mufti K S,Khan R A. Process for the preparation of 4,1′,6′-trichloro-4,1′,6′-trideoxy galactose sucrose(TGS):US,4380476[P]. 1983-4-19.
[13] Robert E W,Juan L N,Vernon N M. Sucrose-6-ester chlorination:US,4980463 [P]. 1990-11-25.
[14] 冷一欣,张兆,黄春香,等. 甜味剂三氯蔗糖的合成及结构表征[J].化学研究与应用,2011,23(12):1666-1670.
[15] Simpson P J. Suerose alkyl 4,6-orthoacylates:US,4889928 [P].1989-03-13.
[16] Queneau Y,Fitremann J,Trombotto S. The chemistry of unprotected sucrose:The selectivity issue[J].C.R.Chimie,2004,7(2):177-188.
[17] 卢富国. 单酯法合成甜味剂 4,1′,6′-三氯-4,1′,6′-三脱氧半乳型蔗糖的研究[D].南京:南京理工大学,2010.

