热疗对增强阿霉素治疗神经胶质瘤敏感性研究
王向军
郑州大学第二附属医院药剂科 郑州 450014
神经胶质瘤(glioma)又称胶质细胞瘤,是起源于神经外胚层细胞多种肿瘤的总称,其恶性胶质瘤在原发性肿瘤中占35%~45%[1],是中枢神经系统最常见且最难治疗的恶性肿瘤,手术切除、放疗及化疗等传统治疗方法能够对其产生一定的治疗作用,但在过去的很多年中,神经胶质瘤的预后及自然发生、发展过程并未得到明显改善,因此开发治疗神经胶质瘤有效的新方法势在必行。
肿瘤热疗(tumor hyperthermia)是近年来快速发展起来的一类治疗癌症的新方法,基本原理是利用外加的物理能量(如温热水浴、微波或超声波等)加热,使肿瘤组织温度上升到有效治疗温度,破坏肿瘤细胞的代谢和结构,从而杀灭肿瘤细胞。目前,肿瘤热疗成为继手术、放疗、化疗和免疫疗法之后的第五大疗法。阿霉素(adriamycin,ADM)是一种目前临床常用的广谱抗癌药,用于多种肿瘤的治疗,具有热疗增敏性和PH敏感性。将热疗与化疗联合应用可对化疗起到增效作用。本实验旨在探讨U251细胞株对阿霉素的热疗增敏作用。
1 材料和方法
1.1主要试剂和仪器DMEM培养基(Hyclone公司)、胎牛血清(四季青公司)、磺酰罗丹明B(sigma公司)、阿霉素(万乐药业)、FITC标记的P-gp抗体和山羊抗小鼠IgG1(eBioscience公司)、细胞凋亡试剂盒(碧云天生物技术研究所)。酶标仪(DYNEX公司)、流式细胞仪(贝克曼库尔特有限公司)、UHR-2000高能聚束微波热疗机(华源医疗设备有限公司)、高效液相色谱仪(岛津公司)。细胞培养:将U251神经胶质瘤细胞培养在含胎牛血清(FBS)10%、青链霉素混合液1%的DMEM培养基中,培养箱条件为37℃、5%CO2,每2~3d传代一次。药物工作浓度确定:阿霉素设0.125、0.25、0.5、1、2、4、8μg/mL组,每组3个复孔,SRB法测定细胞抑制率,以48h的IC50作为工作浓度。
1.2实验分组及处理实验设空白对照组、热疗组、化疗组、热化+疗组。以上各组分别给予相应的化疗和(或)热疗处理:将U251细胞浓度调整为2.5×105/mL种于6孔板中,化疗组和热化疗组中加入工作浓度的阿霉素,热疗组和热疗+化疗组细胞在UHR-2000微波辐射器下进行加温,温度达42℃时,维持60min。
1.3台盼蓝拒染法检测细胞的存活率分别取各组细胞悬液稀释,使各组细胞数相同,分别吸出0.9mL均匀细胞液加0.1mL 0.4%的台盼蓝染色,计数3次取均值。细胞生存率=活细胞总数/(活细胞总数+死细胞总数)×100%。
1.4 SRB法测定细胞增殖率将U251细胞以每孔5×103个接种到96孔培养板中,每组设5个复孔,将各组细胞分别给予热疗、化疗或热疗+化疗处理。培养48h后加入50%三氯醋酸50μL,4℃固定1h;超纯水洗5遍,风干;加0.4%的SRB 50μL,避光染色30min;1%乙酸洗5遍,风干,加入10mmol/L Tris碱150μL溶解,酶标仪测定吸光度。计算公式:细胞存活率/%=(1-实验组光吸收值)/对照组光吸收值×100%。
1.5流式细胞仪测定细胞凋亡率用PBS洗涤处理48h的细胞2次,每组(1~5)×105细胞;加入500μL的Binding Buffer悬浮细胞;加入5μL Annexin V-FITC混匀后,加入5 μL Propidium Iodide,混匀;室温、避光、反应5~15min;1h内,用流式细胞仪检测分析细胞凋亡率。
1.6高效液相色谱法HPLC测定细胞内阿霉素浓度U251细胞反复冻融离心,取上清为细胞内液,用HPLCA法测定细胞内阿霉素含量。测定条件:色谱柱:Agilent 1200E-clipse XDB-C 18柱(4.6mm×150mm,5μm);检测器:荧光FLD检测器;流动相:甲醇:0.01mol/mL磷酸二氢钾:冰乙酸=68∶32∶0.5;流速:1.0mL/min;柱温30℃;进样量40 μL;检测波长:激发波长480nm,发射波长550nm[2]。
1.7流式细胞仪测定U251细胞内Bcl-2的表达情况取U 251细胞接种于六孔板中,每孔细胞数为2×105个,分组处理后继续培养48h收集细胞,加入100μL破膜剂及5μL Bcl-2/FITC和 Mouse IgG1/FITC,使用流式细胞仪检测。
1.8流式细胞仪测定U251细胞内P-gp的表达情况取U251细胞接种于六孔板中,每孔细胞数2×105个,分组进行处理后继续培养48h收集细胞,用PBS洗涤,加入10μL的P-gp/FITC和 Mouse IgG1/FITC,将反应物置于37℃冰箱内孵育60min,使用流式细胞仪检测。
1.9统计学处理方法应用SPSS 17.0软件进行数据处理,计量资料采用均数±标准差表示,计量资料采用单向方差分析(One-way ANOVA)。P<0.05为差异有统计学意义。
2 结果
2.1阿霉素工作浓度的确定SRB法测得浓度为0.125、0.25、0.5、1、2、4、8μg/mL的阿霉素分别作用于 U251细胞后,各组抑制率分别为3.22±0.31、9.67±0.95、25.47±2.45、33.89±3.33、57.48±4.01、74.51±4.62、92.64±5.63。U251对阿霉素的IC50为1.45μg/mL,并以此药物浓度进行各项试验。
2.2细胞存活率通过以上方法对U251细胞进行处理48 h后,热疗组、化疗组、热疗+化疗组的存活率均比空白对照组细胞存活率低,差异有统计学意义(P<0.01);热疗+化疗组的细胞存活率分别比单纯化疗组和单纯热疗组显著降低(P<0.01)。见表1。
2.3细胞抑制率化疗、热疗及热疗+化疗组均对U251细胞产生抑制作用;同时化疗组、热疗组与热疗+化疗组相比差异均有统计学意义(P<0.01)。数据见表1。
2.4阿霉素联合热疗对U251细胞的凋亡作用化疗组、热疗组及热疗+化疗组细胞凋亡率分别较对照组明显升高(P<0.01);同时,热疗+化疗组的细胞凋亡率较热疗组及化疗组的凋亡率均明显升高(P<0.01)。见表1。
2.5热疗对U251细胞内阿霉素浓度的影响经热疗处理后,细胞内 ADM 浓度由(9.03±0.84)pg/mL上升至(36.52±2.97)pg/mL,差异有统计学意义(P<0.01)。说明热疗能提高U251细胞对ADM蓄积的能力。见表1。
2.6 U251细胞中Bcl-2的表达按照试验操作处理48h后,检测U251细胞内Bcl-2的表达率。结果显示:化疗组、热疗组及热疗+化疗组细胞中的Bcl-2表达率与对照组相比差异均有统计学意义(P<0.01),且热疗+化疗组细胞Bcl-2表达率分别与热疗组、化疗组相比,差异均有统计学意义(P<0.01)。见表2。
2.7 U251细胞中P-gp的表达按照试验操作处理48h后,检测U251细胞内P-gp的表达率。结果显示:化疗组、热疗组及热疗+化疗组细胞中的P-gp表达率与对照组相比差异均有统计学意义(P<0.01),且热疗+化疗组细胞P-gp表达率分别与热疗组、化疗组相比,差异均有统计学意义(P<0.01)。见表2。
3 讨论
由于肿瘤组织及其周围血管对温度的敏感性,利用热疗的方法可有效将其杀灭[3]。近些年,肿瘤热疗受到了人们的广泛关注[4-5]。同时,热疗和化疗联合治疗肿瘤具有明显的增强作用,原因可能是热疗使药物渗入细胞量增加、蛋白质变性及化疗药物的药动学改变等。本研究使用的化疗药物为阿霉素,阿霉素是一种有效的热疗增敏剂,将其与热疗联合可以有效增强治疗效果[6-7]。
有文献报道,热疗杀灭肿瘤细胞的临界温度是42℃,目前临床上所用的热疗温度也大都是41~43℃,因此本研究中热疗的处理温度设定为42℃。细胞存活率、细胞抑制率及细胞凋亡率的考察结果显示,热疗+化疗组与单纯热疗组、单纯化疗组及空白对照组相比差异均有统计学意义(P<0.01);进一步测定细胞内ADM的浓度,发现热疗+化疗组的ADM浓度比其他组明显升高,原因可能是热疗使药物渗入细胞量增加,此外热疗能够降低瘤组织的pH值,ADM在pH值相对较低的情况下会加强释放进入细胞内部[8];热疗+化疗组细胞的P-gp蛋白及Bcl-2蛋白的表达均明显下调节(P<0.01),这说明热疗可能通过降低多药耐药蛋白P-gp的表达,使化疗药物的外排下降,细胞内药物浓度提高,从而增加了U251细胞对ADM化疗的敏感性。同时多数研究也相继表明,热疗可有效降低细胞内P-gp的表达和Bcl-2的表达[9-10]。
本研究结果表明,热疗联合化疗能增强ADM对U251细胞的体外抑制作用,提高肿瘤细胞凋亡率,增强细胞内ADM累积量,联合热疗可有效下调P-gp及Bcl-2蛋白的表达。总体来说,提高了U251细胞对阿霉素化疗的敏感性。这为神经胶体瘤的治疗提供了一种新的手段,但此方法仍需更多的实验支持,为临床应用提供充分的依据。
表1 U251神经胶质瘤细胞存活率、抑制率、凋亡率及热疗对细胞内阿霉素浓度的影响 (s,%)

表1 U251神经胶质瘤细胞存活率、抑制率、凋亡率及热疗对细胞内阿霉素浓度的影响 (s,%)
注:与空白对照组比,*P<0.01;与化疗组比,△P<0.01;与热疗组比,○P<0.01
3 98.72±0.02 - 1.56±0.14 -热疗组 3 50.58±3.54* 45.74±2.36 20.49±1.97* -化疗组 3 43.98±3.27* 52.25±4.91 16.33±1.69* 9.03±0.84*热疗+化疗组 3 25.95±2.21*△○ 71.37±5.42*△ 45.36±3.97*△○ 36.52±2.97空白对照组*△○
表2 U251细胞经过热疗、化疗及热疗+化疗处理后Bcl-2及P-gp表达的情况 (s)
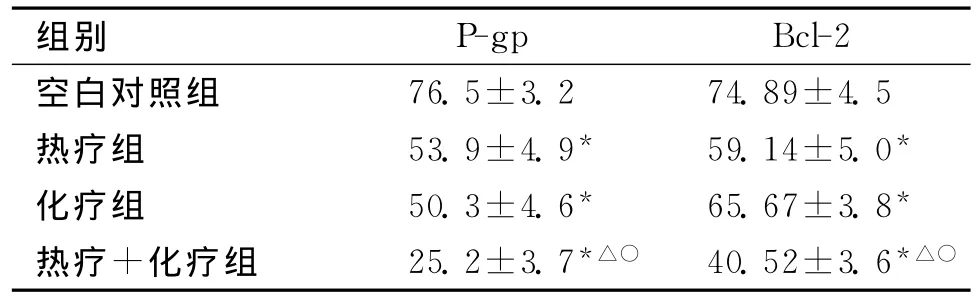
表2 U251细胞经过热疗、化疗及热疗+化疗处理后Bcl-2及P-gp表达的情况 (s)
注:与空白对照组比,*P<0.01;与化疗组比,△P<0.01;与热疗组比,○P<0.01
组别 P-gp Bcl-2空白对照组76.5±3.2 74.89±4.5热疗组 53.9±4.9* 59.14±5.0*化疗组 50.3±4.6* 65.67±3.8*热疗+化疗组 25.2±3.7*△○ 40.52±3.6*△○
[1]李玉俊 .恶性脑胶质瘤组织中NP73的表达与预后的关系[J].中国实用神经疾病杂志,2010,13(4):17-18.
[2]Kim D,Lee ES,Park K,et al.Doxorubicin loaded pH-sensitive micelle:antitumoral efficacy against ovarian A2780/DOXR tumor[J].Pharm Res,2008,25:2 074-2 082.
[3]王洪武 .现代肿瘤靶向治疗技术[M].北京:中国医药出版社,2005:144-145.
[4]Ito A,Yamaguchi M,Okamoto N,et al.T-cell receptor repertoires of tumor-infiltrating lymphocytes after hyperthermia using functionalized magnetite nanoparticles[J].Nanomedicine(Lond),2012.
[5]Hofer KG,Mivechi NF.Tumor cell sensitivity to hyperthermia as a function of extracellular and intracellular pH[J].J Natl Cancer Inst,1980,65:621-625.
[6]Lee H,Kim S,Choi BH,et al.Hyperthermia improves therapeutic efficacy of doxorubicin carried by mesoporous silica nanocontainers in human lung cancer cells[J].Int J Hyperthermia,2011,27:698-707.
[7]Kim YD,Lees DE,Lake CR,et al.Hyperthermia potentiates doxorubicin-related cardiotoxic effects[J].JAMA,1979,241:1 816-1 817.
[8]Liu R,He B,Li D,et al.Effects of pH-sensitive chain length on release of doxorubicin from mPEG-b-PH-b-PLLA nanoparticles[J].Int J Nanomedicine,2012,7:4 433-4 446.
[9]魏红梅,郭坤元,梅家转 .热疗联合化疗对K562/AO2细胞体外作用的实验研究[J].中国实验血液学杂志,2007,15:724-728.
[10]韩露周,宋永平 .热疗提高RPM I8226细胞对阿霉素敏感性的实验研究[J].中国实验血液学杂志,2011,19:680-683.

