探索应用于膜片钳研究的脑片制备方法
刘志洋,王会芳,何海斌,刘 娜,王金萍,彭 雪,王子真,高俊涛 (吉林医药学院,吉林吉林 132013)
有关脑片膜片钳技术最早可追溯至1985年,美国的Gray和Johnston采用酶解撕裂法对豚鼠海马脑片GABA受体通道进行了研究。而将膜片钳技术成熟地应用于离体脑片神经元则是1989年,德国马普研究所Edwards、Sakmann和日本京都大学Takahashi首次将微分干涉相差技术应用到膜片钳技术领域,并对大鼠(海马,视皮层,嗅球,小脑,额叶皮层和脊髓等)、小鼠(海马)、猫(视皮层)神经元离子通道特点进行了广泛研究。近年来随着膜片钳技术的日益成熟,利用脑片研究神经细胞的电生理活动具有其独特的优势。其可以保留较完整的纤维联系与空间结构,同时又能排除在体内复杂的因素对其影响,使得研究变得简单化[1-2]。因此脑片在研究神经病、癫痫、电生理反应、微管相关蛋白tau表达及在各种条件下损伤程度等实验中有重要的应用,脑片培养技术十分重要,脑片的制取和培养也越来越突出了它的重要性[3]。目前,国内已经开始发展幼鼠海马脑片的技术,但可能因为各种不适条件或方法的不同[4]而产生误差甚至是失败,本文详细介绍一种幼鼠脑片的制备步骤及制备的过程以及可能遇到并需要注意的问题。
1 材料与方法
1.1 实验动物
新生1~2 d的Wistar乳大鼠由吉林医药学院实验动物中心提供。
1.2 试剂
人工脑脊液(artificial cerebrospinal fluid,ACSF)成分(mmol/L):NaCl 126,KCl 3.0,KH2PO41.2,NaHCO326,CaCl22.5,MgCl23.3。(每 250 mL ACSF用量:10×Stock 25 mL;ddWater 225 mL;CaCl2600 μL;MgCl2325 μL);葡萄糖 0.45 g(pH 7.4)。
Cutting solution pH 7.4成分(g/L):Choline chlofide 167.5;KCl 1.94;CaCl275μL;MgCl21 050 μL;NaHCO321.8;NaH2PO41.5;Glucose 27;A-scorbate acid 25.7(每150 mL Cutting solution用量:10 × Stock 15 mL;ddwater 135 mL;CaCl275 μL;MgCl21 050 μL;Glucose 0.405 g;Ascorbate acid 0.039 g)。瞬间粘合剂(Loctite 404TM胶);振动切片机(MA752 Motorised Advance Viborslice UK);脑片孵育槽;恒温水浴锅。
1.3 切片方法
将5%的琼脂块,裁成适当大小,在振动切片机(MA752型,Campden Ins,UK)标本托上涂上少许瞬间粘合剂(404TM胶),将修整好的琼脂粘贴在标本托上;制备250 mL ACSF,放在冰箱中,控温于2~4℃,然后取100 mL烧杯,加入80 mL ACSF,通入混合气体(95%O2+5%CO2)饱和,置于36℃的恒温水浴锅中;制备150 mL Cutting soluion,置于冰箱中控温0~2℃,然后在切片槽中,加满Cutting soluion,并通入混合气体(95%O2+5%CO2),待各溶液达到指定温度后,使用乙醚麻醉动物。
选用出生1~2 d的Wistar乳大鼠,乙醚麻醉下迅速断头取脑(留少许小脑,便于将大脑固定在琼脂上),将剥离好的大脑切平,置于混合气(95%O2+5%CO2)饱和的4℃ Cutting Solution中,然后取出大脑,平齐放在刀片上,用滤纸吸干Cutting Solution,在标本托涂上少许瞬间粘合剂(404TM胶),然后垂直粘贴于在振动切片机标本托上。在4℃和供氧混合气条件下,用振动切片机将海马沿长轴顺横向的纤维走向切成厚为300 μm的薄片6~10片。切片时,振动切片机切割速度调在3~4(约0.14 mm/s),振动频率选9(约3 500 r/min)。然后将切好的脑片置于混合气饱和的ACSF中,室温下孵育0.5 h待用。
2 结果
脑片颜色观察可见,健康脑片呈淡黄色,如果脑片变白则表明活性丧失。将制得的脑片放在红外显微镜下观察其形态,可以看出图1细胞的外形轮廓清晰,轴突较为明显,活性较高,而图2由其他方法制备的细胞胞体较大,空泡、轴突消失,活性较差。因此比较得出由此方法制备的脑片活性较高。
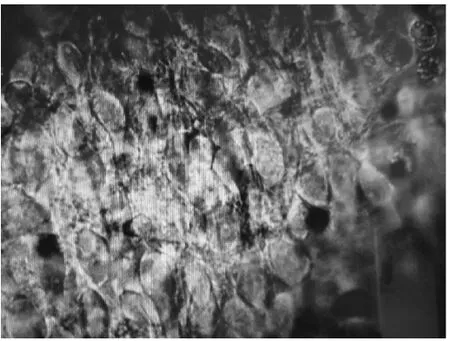
图1 细胞活性较好(40×)
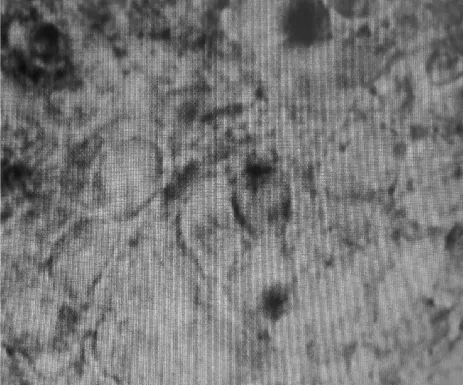
图2 细胞活性丧失(40×)
3 讨论
脑片的完好制备,尤其是脑片的细胞活性状态是膜片钳实验成功的重要前提基础。本实验通过对大量脑片制备过程的观察,在动物的选择和脑片的制备细节上总结以下需要注意的问题。
动物:一般选择出生1~2 d的乳鼠。原因有三:一是幼年动物颅骨软,取脑快,冷却也快;二是幼年动物抗缺氧能力比较强;三是幼年动物脑细胞膜韧性好,易于形成高阻封接,而成年或老年动物细胞脆性较大,颅骨较硬,不易封接和剥离。
麻醉:麻醉剂常用乙醚,其作用短暂,对动物影响较小。采用不使用麻醉剂而直接断头的方法会引起动物的应急损伤,同时不符合动物保护的要求。在本实验中,由于新生动物非常小,也可使用冰冻昏迷法而无需使用麻醉剂。
取脑:取脑时间(从断头到将脑浸入Cutting Solution中的时间)对脑片制备影响较大,一般以1~3 min较好。为保证脑片的存活,必须自始至终坚持无菌原则;分离大脑动作要轻柔、迅速,整个分离、切片时间最好应控制在5 min之内;在本实验中,由于采用全脑切片,冷却时间应控制在30~50 s内。
切片(以NVSLM1型振动切片机为例)相关注意事项为:(1)整个切片过程要求无菌操作,所有动物、解剖器具、切片机、浴槽及其他溶液均需消毒处理;(2)振动切片机在切割时刀片的振动频率要尽可能高,但应以刀片不产生垂直振动为准,一般选择振动频率为9(约3 500 r/min);(3)设定好所要切片的厚度后,务必将刻度盘锁住;(4)对一般脑组织来说,切片厚度在300 μm为宜,因为若脑片太薄(<150 μm)不利于细胞的存活,但如果脑片太厚(>500 μm),细胞不易得到充足的氧气,细胞存活率也会降低;(5)加入浴液,一般切片在液面下1 mm左右深度进行,液体温度保持在0~4℃,并不断通入氧气混合气;(6)振动切片机在切割时刀片的切割推进速度应尽量慢些,以防止挤压大脑;(7)不同部位的切片的频率不一样,需要注意;(8)刀片可采用不锈钢刮胡刀片,装片时要用酒精消毒,且刀片均为一次性使用,切完以后刀片抬高一点,再退刀片,这样对脑片的活性大有帮助。
脑片孵育:(1)孵育的纱网选用尼龙丝袜面料制作,原则是透水性好、质地光滑,脑片不易粘附;(2)采用医用输液器的细塑料管(带有针头)给予氧混合气,为增大气体与ACSF的接触面积,要将针孔用钳子夹扁,使气体在ACSF中形成非常小的气泡,同时还可以节省氧混合气(95%O2+5%CO2);(3)处于孵育中的脑组织,需要在一个稳定的环境下恢复,通入混合气体时,气流不应过大,否则会很容易吹动脑片组织,引起死亡。
[1]刘振伟.实用膜片钳技术[M].北京:军事医学科学出版社,2006:168-175.
[2]康华光.膜片钳技术及其应用[M].武汉:科学出版社,2003:100-103.
[3]刘振伟,李立君,刘传缋.海马脑片盲法膜片钳全细胞记录技术[J].生理学报,2001,53(5):405-408.
[4]王 勇,朱小南,陈汝筑,等.新生大鼠海马脑片培养方法[J].中国药理学与毒理学杂志,2005,19(1):70-74.

