以KDR为启动子的双自杀基因系统诱导结肠癌细胞凋亡的实验研究
王朝阳,黄宗海
(1.内蒙古医科大学附属医院 普外科,内蒙古 呼和浩特010051;2.南方医科大学珠江医院 普外科,广东 广州510282)
将自杀基因与化疗药物联合是目前主要的基因治疗策略,多种自杀基因已经进入临床试验阶段,是非常有前景的基因治疗手段[1]。但研究发现,单自杀基因系统治疗效果不理想并缺乏对肿瘤细胞杀伤的靶向性。因此本实验设计应用2种自杀基因联合治疗以提高肿瘤的杀伤效果,利用血管内皮生长因子(vascular endothelial growth factor,VEGF)能促进血管内皮细胞增殖、分化,血管内皮生长因子受体(KDR)在肿瘤血管内皮细胞中高表达的特点,以肿瘤血管为治疗靶点,可以降低对正常细胞的毒性。我们前期研究已经构建重组腺病毒pAdEsay-KDR-CDglyTK载体[2],本研究以KDR作为启动子驱动双自杀基因治疗,观察其对高表达KDR的结肠癌HCT116细胞和低表达KDR的LS174T细胞的杀伤作用,为进一步研究此双自杀基因治疗体系的疗效提供实验支持。
1 材料和方法
1.1 材料
重组腺病毒pAdEsay-KDR-CDglyTK(珠江医院普外科构建);HCT116、LS174(中山大学细胞库);293细胞(ATCC);胰蛋白酶、胎牛血清、RPMI1640(Gibco);Trizol Reagent(invitrogen);2×Taq PCR MasterMix(北京天根生物技术公司);RT-PCR试剂盒(Fermentas);5-FC、GCV、四甲唑蓝(MTT)(Sigma);CD-TK引物(上海英俊生物有限公司)。
1.2 方法
1.2.1 重组腺病毒转染HCT116、LS174T细胞用含10%胎牛血清的1640培养液培养HCT116和LS174T细胞,以2×105个/孔接种于6孔板,待细胞融合度达70%-80%,以不同感染复数(MOI)的腺病毒转染后缓慢震荡2-3h,补足培养液在37℃、5%CO2细胞培养箱内培养72h,荧光显微镜下计数绿色荧光蛋白(GFP)阳性细胞百分比。
1.2.2 RT-PCR检测目的基因 CDglyTK 表达收集转染及未转染的HCT116和LS174T细胞,TRIzol提取细胞的总RNA,分光光度计检测A260,按照逆转录试剂盒说明合成cDNA。CD-TK引 物 序 列 上 游 P1:5′-AGGCTAACAGTGTCGAATAACGCT-3′,下 游 P2:5′-GTTAGCCTCCCCCATCTC-3′。反 应 条件:94℃ 预 变 性 5 min,1个循环;94℃变性40sec,57℃退火1min,72℃延伸1.5min,30个循环后72℃延伸10min。PCR产物经1%琼脂糖凝胶电泳,紫外灯下观察结果并拍照。
1.2.3 化疗药GCV及5-FC对转染细胞的细胞毒作用 将HCT116和LS174T细胞制成浓度为1×105/ml的单细胞悬液接种于96孔培养板中,48h后融合度约为80%,用100MOI的重组腺病毒转染;培养24h后分别加入梯度浓度的前药,GCV为0.01mg/L,0.1mg/L,1mg/L,10mg/L,100mg/L,1 000mg/L,5-FC为20mg/L,40mg/L,80mg/L,160mg/L,320mg/L,640mg/L。培养72h后,加入5g/L MTT 20μl,孵育4h;吸去上清,加入200ml/孔DMSO,振摇10min,酶标仪检测每孔在490nm波长下的吸光度值(A),以不含细胞的培养基作空白对照,实验重复3次,设3个平行孔。计算细胞相对存活率=试验组OD值/对照组OD值×100%。
1.2.4 流式细胞仪(FCM)分析细胞周期及凋亡情况 将HCT116接种于6孔板中,48h后用100MOI的重组腺病毒感染,培养24h,加入1mg/L GCV和80mg/L 5-FC,设置阴性对照组,继续培养48h后收集细胞,PBS洗2次,1 000r/min离心5min,去上清液,-20℃预冷的70%乙醇固定1h。用200μl PBS制备细胞悬液加入等体积碘化丙碇染液混合,4℃放置30min上机。ModfitLT20软件分析细胞周期和细胞凋亡的变化情况。
1.2.5 免疫组织化学法检测Caspase3的表达HCT116细胞接种及转染方法同上。将感染和未感染CD/TK基因的HCT116细胞涂片,多聚甲醛固定,3%H2O2室温封闭5-10min,正常山羊血清封闭室温20min,甩去多余液体。滴加兔抗人Caspase3抗体(1∶100),37℃2h,生物素抗兔IgG 37℃30min,SABC 20min,DAB显色。各步骤之间用磷酸盐缓冲溶液冲洗3遍,梯度酒精脱水后,封片,拍照。阳性标准:细胞浆发现棕黄色颗粒为阳性细胞。在光学显微镜下观察,随机选择5个不同视野,每次细胞记数不少于200个,计算细胞阳性率。
1.2.6 统计方法 用SPSS13.0统计软件进行分析,计量资料采取独立样本t检验,结果用¯x±s表示;计数资料两组间比较采用 Mann-Whitney U秩和检验分析,P<0.05表示有统计学意义。
2 结果
2.1 重组腺病毒对结肠癌细胞的转染情况
不同MOI的重组腺病毒转染HCT116和LS174T细胞72h,结果显示转染率与腺病毒感染复数呈正相关,MOI=10时,仅显示少数微弱的荧光;MOI=100时,90%以上的细胞表达荧光;MOI=200时,95%以上的细胞表达较强的绿色荧光,腺病毒对两种肿瘤细胞的转染效率相似(图1)。
2.2 Ad-KDR-CDglyTK基因表达产物的鉴定
RT-PCR结果显示:转染后的HCT116内能检测到目的基因Ad-KDR-CDglyTK的表达,电泳图上可见约2 400bp阳性条带,LS174T细胞内则未检测到目的融和基因的表达(图2)。
2.3 重组腺病毒AdKDR-CDglyTK转染后结肠癌细胞存活率的测定

图1 重组腺病毒对HCT116和LS174T细胞的转染情况

图2 RT-PCR鉴定CDglyTK mRNA的表达
MTT检测结果显示:腺病毒 AdKDR-CDglyTK转染HCT116细胞后对前药GCV和5-FC的敏感性较高,细胞杀伤作用呈剂量依赖性,随前药浓度增加,生长抑制作用逐渐增强,细胞存活率明显下降,差异有统计学意义(P<0.001)。但相同剂量的前药对转染腺病毒AdKDR-CDglyTK的LS174T细胞不敏感,转染后的LS174T细胞的存活率不随前药浓度的改变而变化(图3)。
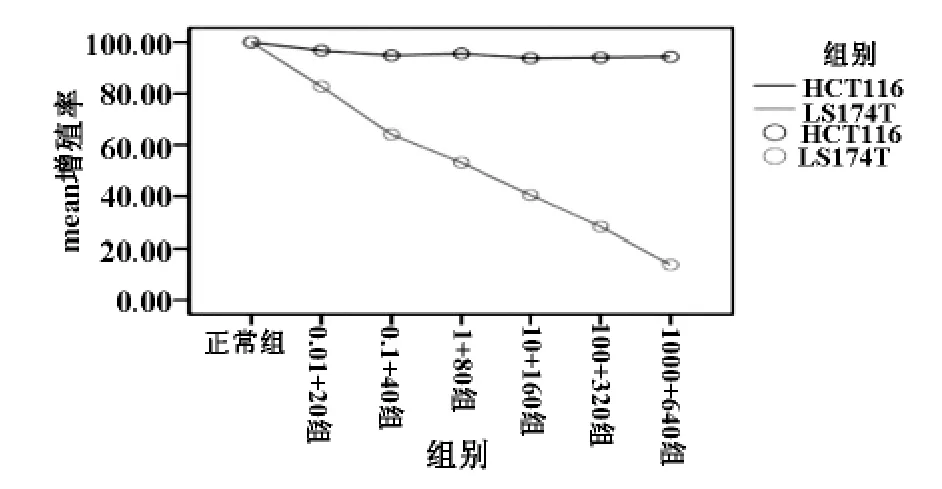
图3 AdKDR-CDglyTK对HCT116、LS174T细胞存活率的影响
2.4 以为KDR启动子的双自杀基因系统CDglyTK促进细胞凋亡
流式细胞仪检测结果显示:前药GCV 1mg/L、5-FC 80mg/L 作用 HCT116细胞48h,HCT116细胞G0/G1升高而S期下降(P<0.01)。治疗组GO-G1期峰左侧出现凋亡峰,凋亡率为14.83%,而阴性对照组未出现明显的凋亡峰,差异均有统计学意义(P<0.01)(表1,图4)。
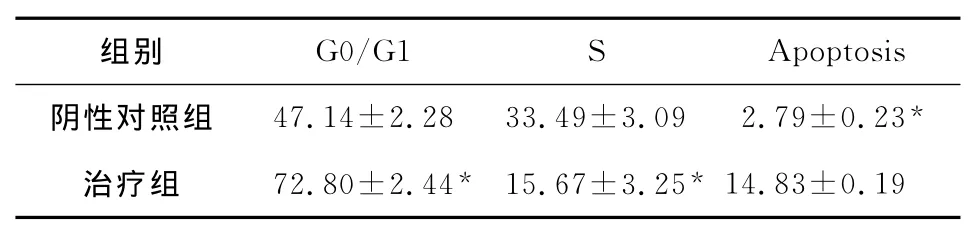
表1 以为KDR启动子的双自杀基因系统CDglyTK对HCT116细胞的周期分布及凋亡的影响(%)
2.5 caspase3蛋白在HCT116细胞中的表达
Caspase3免疫反应阳性产物呈棕黄色,主要在胞浆表达,少量胞核有微量表达。前药GCV 1mg/L、5-FC 80mg/L作用 HCT116细胞48h,治疗组caspase3蛋白表达明显高于阴性对照组的蛋白表达,治疗组阳性细胞占55.86%,阴性对照组阳性细胞占25.94%,差异具有统计学意义P<0.01(图5)。
3 讨论
肿瘤的自杀基因治疗策略是将某些细菌或病毒中对药物敏感的基因用基因工程技术构建到载体上导入肿瘤细胞中,此基因编码的特异性酶能将对细胞无毒或毒性低的药物前体代谢为细胞毒性药物,以提高肿瘤细胞对药物的敏感性[3]。由于肿瘤的发生、发展的复杂性,单自杀基因治疗具有表达不稳定、转染效率不足、特异靶向性不强、对肿瘤细胞杀伤效果低等缺点,应用单前药体系很难达到根治肿瘤、抑制肿瘤转移的目的,多个自杀基因的联合是提高疗效的主要途径之一。

图4 HCT116细胞的DNA含量和细胞周期

图5 免疫细胞化学检测HCT116细胞caspase3蛋白表达(A图为对照组,B图为治疗组)
CD/5-FC和TK/GCV是目前研究最为深入的两种自杀基因系统。单纯疱疹病毒Ⅰ型胸苷激酶(herps simplex virus typeⅠ thymidine kinase,HSV-Ⅰ TK)催化更昔洛韦(Ganciclovir,GCV)磷酸化,经细胞激酶转化成三磷酸GCV,渗入到分裂细胞的DNA中,抑制DNA合成[4]。胞嘧啶脱氨酶(cytosine deaminase,CD)将无毒的5-FC转化为高度细胞毒性的5-FU,抑制胸苷酸合成酶活性影响DNA复制,并以伪代谢物形式渗入到RNA中,干扰RNA功能抑制蛋白质合成[5,6]。二者作用机制相似,但作用环节不同,联合转染将会产生相加或协同效应杀伤敏感性不同的肿瘤细胞。本研究通过流式细胞仪检测证实,给予前药5-FC和GCV后转基因HCT116细胞被阻滞于G0-G1期,S期下降,出现明显的凋亡峰,提示结肠癌细胞的DNA合成被抑制,双自杀基因系统能特异性抑制结肠癌HCT116细胞增殖。
基因治疗的关键是将目的基因片段高效地导入靶细胞并获得有效稳定的表达。治疗的靶向性是优化基因治疗策略的重要环节,利用肿瘤组织特异性启动子驱动自杀基因在肿瘤细胞中表达是实现肿瘤治疗的靶向性、提高转染效率的有效手段。血管内皮生长因子(VEGF)能增强小血管内皮细胞内的代谢、引起血管外基质成分改变刺激内皮细胞增殖和迁移,在血管新生中起重要作用。实验证实VEGF的表达水平能反映肿瘤血管内皮细胞增殖、迁移和血管构建水平,直接反映肿瘤生长速度和转移倾向[7]。在实体肿瘤原发灶及远处转移灶中可检测到的VEGF及其受体(KDR)表达水平明显升高,而在正常血管表达弱或不表达[8]。因此。本研究构建以KDR为启动子驱动双自杀基因系统,将有高度肿瘤特异性KDR与双自杀基因系统结合起来,提高自杀基因系统对肿瘤组织及肿瘤血管的靶向性而对正常组织影响较小。实验结果表明转染Ad-KDR-CDglyTK后,表 达 KDR 的 结 肠 癌 细 胞HCT116的生存率随前药5-FC和GCV浓度的增加而递减,而不表达KDR的LS174T细胞生存率则几乎不受影响。证实以KDR为启动子调控双自杀基因系统能增强肿瘤组织的靶向特异性、提高转染效率。
Caspase家族被认为是细胞凋亡过程中最重要的蛋白酶,Caspase-3广泛存在于正常人体组织及多种肿瘤组织中,正常情况下,胞质内的caspase-3以无活性的酶原形式存在,只有当细胞凋亡时才被激活为有活性的caspase-3,在细胞凋亡的执行阶段,caspase-3水解底物蛋白,引起细胞凋亡[9]。本实验通过免疫组织化学的方法检测肿瘤细胞内caspase-3蛋白含量,结果显示治疗组的caspase-3蛋白表达明显高于对照组,说明前药作用于转基因HCT116细胞后诱导细胞凋亡,其机制可能是通过诱导细胞内caspase-3活性升高,增强caspase-3促进细胞凋亡途径实现的。
综上所述,以KDR基因为启动子可以提高对肿瘤细胞和肿瘤血管组织的靶向性,双自杀基因系统可增强转染效率、提高对肿瘤细胞的杀伤效果、诱导肿瘤细胞凋亡。
[1]Duarte S,Carle G,Faneca H,et al.Suicide gene therapy in cancer:where do we stand now[J].Cancer Lett,2012,324(2):160.
[2]孔 恒,黄宗海,陈海金,等.慢病毒介导的双自杀基因对胃癌细胞的杀伤作用[J].南方医科大学学报,2010,30(1):47.
[3]Tani J,Faustine,Sufian JT.Updates on current advances in gene therapy[J].West Indian Med,2011,60(2):188.
[4]Yi BR,Choi KJ,Kim SU,et al.Therapeutic potential of stem cells expressing suicide genes that selectively target human breast cancer cells:evidence that they exert tumoricidal effects via tumor tropism[J].Int J Oncol,2012,41(3):798.
[5]Mailly L,Leboeuf C,Tiberghien P,et al.Genetically engineered T-cells expressing aganciclovir-sensitive HSV-tk suicide gene for the prevention of GvHD[J].Curr Opin Investig Drugs,2010,11(5):559.
[6]Bhaumik S.Advances in imaging gene-directed enzyme prodrug therapy[J].Curr Pharm Biotechnol,2011,12(4):497.
[7]Liu L,Wu N,Li J.Novel targeted agents for gastric cancer[J].Hematol Oncol,2012,5(31):1186.
[8]Chekhonin VP,Shein SA,Korchagina AA,et al.VEGF in neoplastic angiogenesis[J].Vestn Ross Akad Med Nauk,2012;(2):23.
[9]Snigdha S,Smith ED,Prieto GA,et al.Caspase-3activation as a bifurcation point between plasticity and cell death [J].Neurosci Bull,2012,28(1):14.

