IL-6抗原抗体干预对T2DM大鼠肝脏IL-6mRNA表达的影响
陈 雨,郑少雄,孟春梅,郝 杰
(天津医科大学第二医院 内分泌科,天津300211)
T2DM的病因可归结为胰岛β细胞分泌胰岛素缺陷和胰岛素作用障碍。炎症或免疫因素是胰岛素抵抗和β细胞功能衰竭的重要原因,大量的免疫炎症介质参与了上述过程,其中,关于IL-6的作用一直是一个引起争议的话题。本研究旨在探讨炎症因子IL-6在T2DM发病机制中的作用。
1 材料与方法
1.1 材料
1.1.1 实验动物 健康雄性SD大鼠36只,平均体重254±7.5g,购于北京大学医学部实验动物中心。
1.1.2 主要试剂 高糖高脂乳剂(脂肪乳);链脲佐菌素 (STZ);IL-6 抗 原、抗 体;Trizol试 剂、Oligo(dT)18、dNTP、目的基因引物 DNA、内参基因引物DNA、逆转录酶。
1.2 方法
1.2.1 T2DM 大鼠模型的建立,IL-6抗原、抗体的干预及标本留取 按体重随机分为4组:N组(正常对照组,10只),A 组(糖尿病IL-6抗原组,10只),B组(糖尿病IL-6抗体组,8只),C(糖尿病对照组,8只)。均普通饲料喂养。A、B、C三组连续7周按1ml/100mg体重/d给予脂肪乳灌胃,N组按同样剂量给予水灌胃对照,之后称取动物体重,按30mg/kg体重尾静脉注射STZ。3天后,血糖测定结果大于16.7mmol/L为T2DM造模成功。造模后继续普通饲料喂养和脂肪乳灌胃(0.5ml/100mg体重/d)。成模后第2天,A组给予IL-6抗原稀释液(10 μg/ml)腹腔注射0.6ml/只/d,连续干预5天;B组给予0.01MPBS液腹腔注射0.6ml/只/d,连续干预4天,第5天IL-6抗体液(1mg/ml)腹腔注射0.6ml/只;C、N组均给予0.01MPBS液腹腔注射0.6ml/只/d,连续干预5天。四组大鼠均于成模后第7天处死。采集标本:剪尾测血糖,股动脉取血,称重,并取肝脏液氮保存。
1.2.2 血糖及胰岛素测定 罗氏血糖仪每周检测血糖1次;血清胰岛素采用液相平衡竞争放射免疫分析法测定。
1.2.3 按照试剂盒说明,采用双抗体夹心ELISA法测定血清IL-6;提取大鼠肝细胞膜,按照试剂盒说明,采用固相夹心ELISA法测定肝组织细胞膜上胰岛素受体(InsR)。
1.2.4 肝脏组IL-6mRNA表达 Trizol提取肝脏细胞总RNA,后经逆转录反应,合成cDNA,对其进行PCR扩增。采用的引物序列及反应参数如下:IL-6,上游:5’-AACTCCATCTGCCCTTCA-3’,下游引物:5’-GGTCCTTAGCCACTCCTT-3’。反应参数为94℃5min,94℃30s,52℃30s,72℃30s,共35个循环,72℃终末延伸10min,扩增片段长度588bp;内 参 基 因 β-actin,上 游:5’-CACCCGCGAGTACAACCTTC-3’,下游:5’-CCCATACCCACCATCACACC-3’,反 应 参 数 为 94℃ 5 min,94℃30s,60℃30s,72℃30s,共35个循环,72℃终末延伸10min,扩增片段长度232bp。用SYNGENE全自动凝胶成像分析系统对IL-6和内参β-actin的RT-PCR产物各条带灰度进行图像采集,计算IL-6/β-actin的比值,进行半定量分析。
1.3 统计学处理 应用SPSS11.5软件包处理行统计分析,数据用¯x±s表示,组间比较采用方差分析;采用Pearson相关系数评价IL-6抗原、抗体与血糖、胰岛素等指标的相关性。
2 结果
2.1 一般情况 普通饮食饲养并辅以脂肪乳灌胃,7周后与对照组相比,糖尿病A、B、C组血清胰岛素升高明显(20.10±10.02,20.45±7.94,19.46±5.94vs11.57±5.85)(P<0.05),7周时,各组大鼠体重的比较均无统计学差异。实验结束时,糖尿病A、B、C组体重较对照组降低明显(309.90±20.75,303.75±39.26,319.75±20.53vs410.60±22.37)(P<0.05);糖尿病A、B、C组血糖较对照组仍升高明显(24.03±6.93,23.80±1.67,21.93±1.56 vs5.50±0.42)(P<0.05)。
2.2 肝细胞膜InsR、血清IL-6的变化 与N组比较,A、B、C组大鼠肝细胞膜胰岛素受体水平升高(7.09±4.93,7.03±4.97,6.84±4.65vs4.39±3.09)(P<0.05);与B、C、N组比较,A组大鼠血清IL-6水平明显升高(1058.89±223.97vs404.34±60.33,411.72±126.17,407.43±88.52)(P<0.05)。
2.3 IL-6抗原抗体干预前后对胰岛素相关指标的影响
2.3.1 IL-6抗原及IL-6抗体等干预前后各组的血糖结果比较 见表1。A、B、C三组干预后较干预前血糖下降明显(P<0.05),但对各组内干预前后血糖的相关性分析显示,二者无相关关系(P>0.05)。表明IL-6抗原、IL-6抗体、PBS的干预对糖尿病大鼠的血糖没有影响。

表1 干预前后各组组内的血糖变化
2.3.2 IL-6抗原及IL-6抗体等干预前后各组的胰岛素结果比较 见表2。B、C二组干预后较干预前胰岛素下降明显(P<0.05);而与干预前相比,A组干预后的胰岛素水平下降,无统计学意义(P>0.05)。对各组内干预前后胰岛素的相关性分析显示,仅B组经IL-6抗体干预,前、后胰岛素水平有相关性,相关系数r=0.759(P<0.05)。表明,IL-6抗体的干预能够使糖尿病大鼠的胰岛素水平降低。2.4 RT-PCR 检测各实验组大鼠肝脏组织IL-6 mRNA的结果 外源性给予IL-6抗原干预,使A组大鼠肝脏的IL-6表达增加,仅与B组比较差异有统计学意义(P<0.05);见表3、图1。表明外源性给予IL-6抗原、抗体对大鼠肝脏组织的IL-6mRNA表达有影响。

表2 干预前后各组组内的胰岛素变化

表3 各组大鼠肝脏组织IL-6mRNA表达
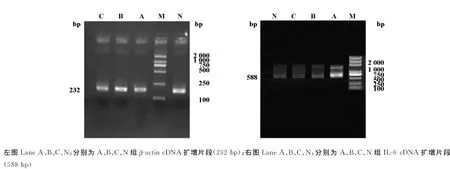
图1 大鼠肝脏组织IL-6mRNA RT-PCR扩增电泳结果
3 讨论
胰岛素抵抗和β细胞功能障碍是T2DM发病的两大机制。然而胰岛素抵抗也可以同样程度的存在于许多无糖尿病人群中,因此单独的胰岛素抵抗不可能是T2DM的决定性致病因素。更多的事实表明,胰岛特别是胰岛β细胞的异常可能是T2DM发病的中心环节[1-2]。
近年来,一些临床流行病学的研究发现T2DM患者血循环中的急性期反应产物和炎症因子水平升高,存在自然免疫的激活和低度炎症[3];而且抗炎治疗可以改善T2DM患者糖代谢异常、提高胰岛素敏感性。
IL-6产生于多种不同类型的细胞,肝脏的IL-6主要由Kupffer细胞、内皮细胞分泌,并以旁分泌方式作用于肝细胞[4],它既能刺激肝细胞合成急性期反应蛋白,又能引起再生反应,其作用主要通过IL-6受体活化细胞内一系列信号蛋白分子来实现。目前的研究现状表明,IL-6是炎症所导致的代谢综合征的罪魁祸首。有研究报道,IL-6缺乏的大鼠血糖水平升高并有糖耐量减低,雌性大鼠的血脂升高[5]。Senn等[6]研究发现,IL-6能抑制胰岛素信号转导及胰岛素作用。Rotter等研究发现,短时间(120分钟)注射IL-6对大鼠肝脏、肌肉、脂肪的胰岛素受体及胰岛素受体底物磷酸化无影响[7]。Klover等[8]在对小鼠注射IL-6第5天时发现,血浆IL-6升高6倍,与肥胖状态下IL-6水平相似(升高2-4倍)。另外,小鼠肝脏STAT(signal transducer and activator of transcription,信号转导子和转录激活子)磷酸化增加,胰岛素受体磷酸化下降60%,IRS-1和IRS-2磷酸化分别降低60%和40%。IL-6亦使葡萄糖激酶mRNA转录降低约40%,糖耐量试验提示胰岛素敏感性降低。Klover等[9]在对Lep ob小鼠注射IL-6中和抗体后发现,与对照组相比,IL-6缺乏的Lep ob小鼠胰岛素受体自身磷酸化及蛋白激酶激活分别增加35%及50%,高胰岛素正常血糖钳夹试验中,内源性葡萄糖生成抑制是对照组的2.8倍。这说明IL-6缺乏的小鼠胰岛素敏感性有所改善,反映了IL-6在肝脏IR中的作用。
我们的实验取T2DM大鼠的肝脏组织,在经过IL-6抗原、抗体等干预后,应用RT-PCR技术测定IL-6mRNA的表达,结果显示,经IL-6抗原腹腔注射的糖尿病大鼠肝脏IL-6mRNA的表达明显高于IL-6抗体腹腔注射组,但与糖尿病对照组及正常对照组之间的升高没有统计学的意义,这表明IL-6抗原及IL-6抗体对于肝脏的炎性细胞因子表达有一定作用,即IL-6抗原可能能够刺激肝脏的Kupffer细胞、内皮细胞等分泌IL-6,IL-6抗体也可能对抑制肝脏IL-6mRNA的表达起到不可忽视的作用。
同时,血清中的IL-6水平采用ELISA法测定也显示IL-6抗原干预组较其他组明显升高,而IL-6抗体腹腔注射的糖尿病大鼠与PBS腹腔干预的糖尿病和正常对照组大鼠之间没有明显差别,可以认为IL-6抗体的腹腔注射对于血清中的IL-6表达没有显著作用,而IL-6抗原的腹腔注射则会显著增加血循环中IL-6的水平,但其具体机制还有待于进一步研究。此外,本实验显示IL-6抗体的干预能够使糖尿病大鼠的胰岛素水平降低。
采用ELISA法测定肝细胞膜上InsR,结果显示糖尿病不同干预组间比较无统计学差别,仅有糖尿病组较正常组升高明显。其机制可能与T2DM大鼠胰岛素在肝脏作用减低,胰岛敏感性下降,代偿性引起高胰岛素血症和肝脏胰岛素受体表达增加有关。
综上,本实验证实了慢性低水平炎症是T2DM的发生发展的重要机制,IL-6等炎症因子或免疫因素促使胰岛素抵抗和β细胞功能衰竭。另外,本实验存在可以改进的的地方,即造模前后脂肪乳灌胃剂量一致,可保证大鼠的持续高胰岛素血症、胰岛素抵抗状态、胰岛素敏感性降低。因此,从另一角度而言,IL-6缺乏可能对T2DM大鼠胰岛β细胞功能具有一定保护作用。慢性低水平炎症在T2DM病生理过程中的重要地位,为今后T2DM病理机制研究和防治提供相应理论依据。
[1]Gerasi E.胰岛素生成,胰岛素分泌及2型糖尿病:问题的核心在于β细胞[J].中华内分泌代谢杂志,2005,21(3):194.
[2]赵家伟,马凤海,罗 梅,等.胰岛β细胞胰岛素抵抗的证据[J].中华内分泌代谢杂志,2005,21(4):4.
[3]Pickup JC.Inflammation and Activated Innate Immunity in the Pathogenesis of Type 2Diabetes[J].Diabetes Care,2004,27(3):813.
[4]Aldeguer X,Debonera F,Shaked A,et al.Interleukin-6from intrahepatic cells of bone marrow origin is required for normal murine liver regeneration[J].Hepatology,2002,35(1):40.
[5]Wallenius V,Wallenius K,Ahrén B et al.Interleukin-6deficient mice develop mature-onset obesity[J].Nat Med,2002,8(1):75.
[6]Senn JJ,Klover PJ,Nowak IA,et al.Interleukin-6induces cellular insulin resistance in hepatocyte [J].Diabetes,2002,51(12):3391.
[7]Rotter Sopasakis V,Larsson BM,Johansson A,et al.Short-term infusion of interleukin-6dose not induce insulin resistance in vivo or impair insulin signalling in rat[J].Diabetologia,2004,47(1):1879.
[8]Klover PJ,Zimmers TA,Konians LG,et al.Chronic exposure to interleukin-6causes hepatic insulin resistance in mice[J].Diabetes,2003,52(11):2784.
[9]Klover PJ,Clementi AH,Mooney RA,et al.Interleukin-6depletion selectively improves hepatic insulin action in obesity[J].Endocrinology,2005,146(8):3417.

