16SrRNA基因文库方法在感染标本菌群分析中的应用
常玉梅,刘海燕
感染是创伤患者的常见并发症,引起创伤感染的病原体以细菌为主。细菌侵入人体皮肤后发生炎症反应,局部可出现红、肿、热、痛和功能障碍,严重时细菌及毒素进入血液循环可引起毒血症或败血症。伤口感染是细菌在体内大量繁殖的结果,开放性创伤失去真皮的屏障作用,更容易引起细菌感染。一般医院均采用细菌培养的方法,根据纯培养物的形态和生化指标来对病原物进行鉴定,但难以获得一些苛养、不可培养及低丰度的细菌。随着基因组与生物信息学的快速发展,细菌基因诊断成为研究的热点。16S rDNA基因在细菌中普遍存在,并且可变区与保守区交错排列,可用于研究细菌的种系发生学关系,分子量大小适中,约1500多个核苷酸,便于序列分析。近年来对不同种属16S rDNA序列的大量测定,为利用细菌的16S rDNA基因对细菌进行检测提供了丰富的数据。因此,16S rDNA已逐渐成为细菌鉴别和分类最常用、最重要的工具[1],通常与用传统培养方法相比能获得更多的细菌种类和一些不可培养物[2-6]。本研究采用基因克隆文库的方法,从微生态学的角度分析创伤感染患者病原菌的16S rDNA序列,研究创伤感染患者的菌群组成。
1 材料与方法
1.1 标本来源与采集 选取笔者所在医院手足外科、创伤科70例创伤患者感染伤口的脓液或渗出液标本。标本采集后加入3 ml无菌生理盐水,振荡器震荡,-20℃保存。
1.2 主要试剂及仪器 DNA提取试剂盒、聚合酶链反应(PCR)试剂盒、DNA Marker、溶菌酶购自北京三博远志公司;凝胶回收试剂盒和T载体连接试剂盒购自Promega公司;限制性内切酶购自Takara公司;感受态细胞购自北京百泰克生物技术公司;PCR扩增仪、电泳仪购自Bio-Rad公司,凝胶成像系统购自Alpha公司。
1.3 试验方法
1.3.1 总DNA提取:将70份标本溶液用无菌滤膜过滤,无菌操作下将滤渣用TE缓冲液冲洗至1.5 ml的无菌EP管中,按细菌提取试剂盒说明书提取细菌总DNA用于PCR扩增。
1.3.2 16S rRNA基因扩增:使用细菌16S rRNA通用引物对标本中的总DNA进行扩增,引物序列为:27F:5'-AGA GTT TGA TCC TGG CTCAG-3'1492R:5'-GGT TAC CTT GTT ACG ACTT-3',产生相对应于大肠杆菌(E.coli)16S DNA序列核苷酸位于27~1513的PCR产物。反应体系为50 μl,包括10×buffer 5 μl,10 mmol/L dNTP 1 μl,10 mmol/L 引物各1 μl,Taq 酶 1 μl,模板 1 μl,ddH2O 40 μl。扩增条件:95℃预变性 4 min,后续 95℃ 40 s,54℃ 40 s,72℃ 1 min 30 s,30个循环;72℃延伸10 min。
1.3.3 克隆文库构建:PCR产物经小量DNA凝胶回收试剂盒纯化后,与pGEM-T载体连接,转化至E.coli DH5a感受态细胞。每份标本平行做2次,以氨苄西林(60 μg/ml)抗性和蓝白斑筛选阳性克隆子[7],采用 T 载体通用引物进行菌液 PCR[8],琼脂糖电泳检测插入片段的大小。
1.3.4 巢式PCR:挑选150个阳性克隆子接入含100 mg/ml的 LB培养基,37℃,225 r/min离心,过夜培养,收集菌体后加入50 μl TE,沸水浴10 min,分别用 SP6/T7、27f/1492两对引物做巢式 PCR,SP6F:5'-ATT TAG GTG ACA CTA TAG-3'T7R 5'-TAA TAC GAC TCA CTA TAG GG-3',体系与扩增条件同“1.3.2”。
1.3.5 克隆文库核糖体DNA扩增片段限制性酶切分析(amplified ribosomal DNA restriction analysis,ARDRA)分型与测序:将巢式PCR中的阳性产物进行ARDRA,分别用HaeⅢ和HinfⅠ2种限制性内切酶消化,酶切反应体系为:PCR产物6 μl,限制性内切酶 1 μl、10 × Buffer 2 μl,ddH2O 补充体系至20 μl。37℃酶切3 h。1.5%琼脂糖凝胶电泳检测酶切图谱类型。根据ARDRA酶切图谱的差异分析聚类,根据酶切图谱的划分操作分类单元(operational taxonomic units,OTU),选取每个OTU中的代表性菌株1~3个测序。
1.3.6 序列比对与统计分析:测序结果用Chromas软件分析,去除质粒序列部分,Contig Express软件拼接序列,登录美国国家生物技术信息中心(NCBI)利用碱基局部对准检索工具(BLAST)进行序列比对。将统计结果按序列的相似程度百分比进行分类统计分析。
2 结果
2.1 细菌DNA及细菌特异性PCR扩增 从收集的感染伤口脓液与渗出物标本中进行DNA抽提,得到了可以进行PCR扩增的总DNA。通过细菌特异性引物扩增,获得了混合的16S rRNA基因序列,琼脂糖凝胶检测片段大小在1.5 kb,表明扩增产物无明显非特异性扩增。
2.2 阳性克隆子筛选与酶切分析 从所构建的16S rRNA基因文库中选择150个阳性克隆,巢式PCR后证实目标条带为1500 bp左右(图1)。扩增产物分别用HaeⅢ和HinfⅠ酶切,根据酶切图谱判断细菌的种类(图2)。

图1 感染伤口脓液或渗出物标本阳性克隆巢式聚合酶链反应M.200 bp Maker;1~7,9~13,15.阳性克隆;14.阴性对照
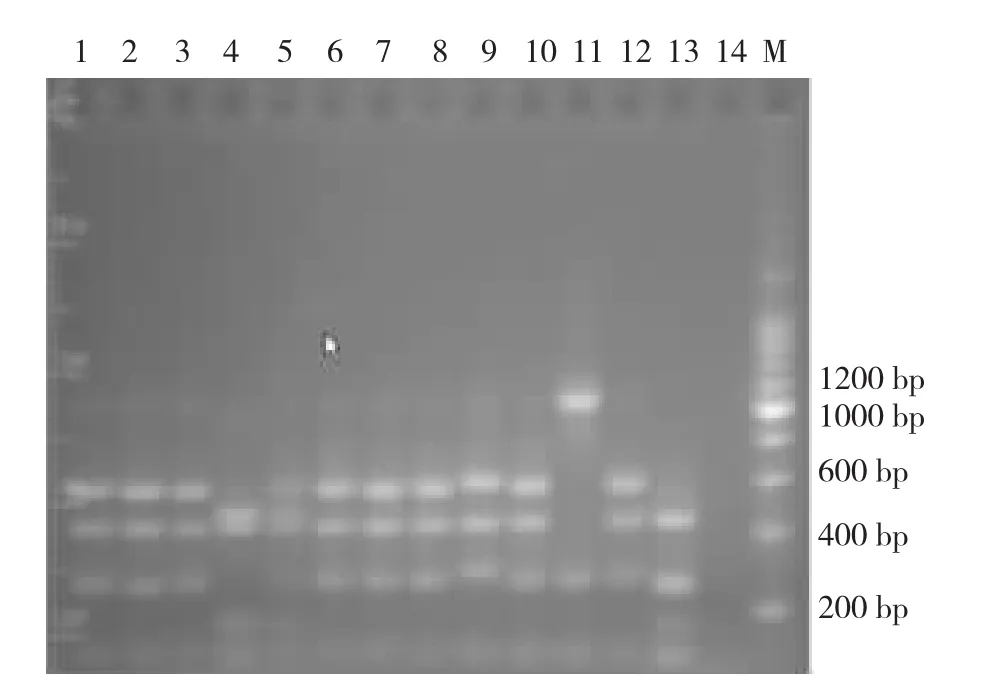
图2 感染伤口脓液或渗出物标本Hif I酶切图谱M.200 bp Maker;1-13.阳性克隆;14.阴性对照
2.3 酶切后基因型频率分析 对于150个含有细菌16S rDNA片段的阳性克隆,经ARDRA分型表明共有7种酶切类型,其中屎肠球菌具有绝对高的基因型频率(88%),坚强肠球菌与5种非可培养微生物数量较少,基因频率在2%,见表1。
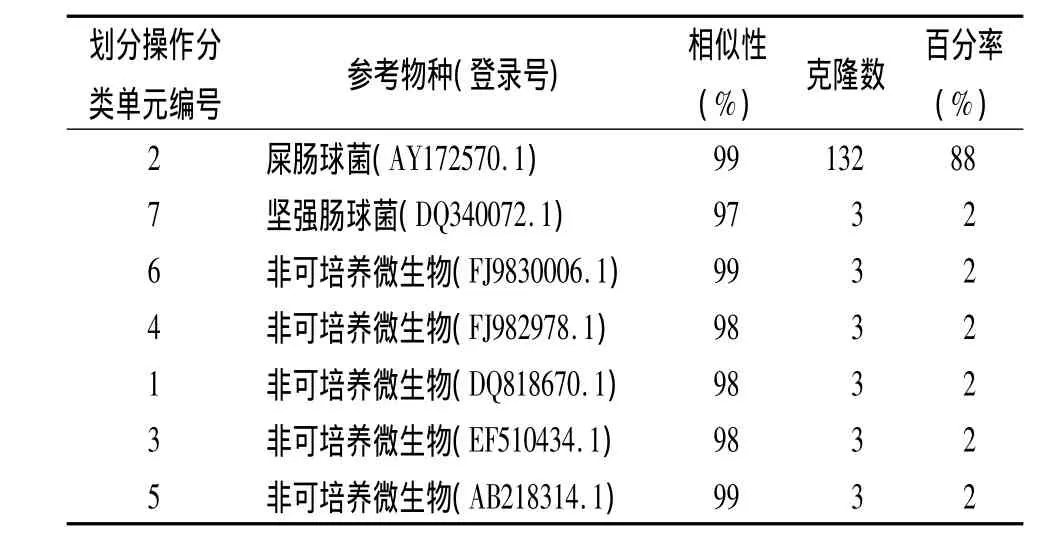
表1 感染伤口脓液或渗出物标本16S rRNA基因序列分析结果(n=150)
3 讨论
创伤感染大多由细菌引起,伤口与外界相通甚至裸露,局部的坏死细胞和渗出液是细菌良好的培养基,极易受到细菌侵染,感染严重时可威胁到患者的生命。随着医疗水平的不断提高,一般在刚发生创伤或皮肤损伤时,消毒处理比较及时,一些常见的感染细菌在经酒精、聚维酮碘等处理后即被杀死,尤其是随着抗生素的大量使用,敏感菌会很快被杀死或受到限制,然而仍然有一些感染在细菌培养阴性的情况下反复发生,因此,明确引起感染的病原体显得尤为关键。
本次试验中共分离到7类细菌,其中5类为非可培养细菌,说明16s rDNA文库的方法能有效分离到非可培养微生物。但是由于标本量有限,得到的病原菌数量与种类均不多。其中2类为屎肠球菌和坚强肠球菌。胡晓卫等[9]在分析陕西省中医院分离的感染细菌中,屎肠球菌的百分率也明显高于其他肠球菌。而以往报道的感染标本中大多为粪肠球菌数量在肠球菌中占优势。肠球菌为兼性细菌,可在缺氧或有氧的环境下生长,在不适宜生长的寄生部位可保持其繁殖力。由于屎肠球菌可以聚集在胃肠道,并且具有固有的和获得的耐药性,因而它引起一系列的感染后给临床治疗带来诸多困难[10]。2010年我国分离到的3株超级细菌中2例是屎肠球菌。以往的报道认为,与其他肠球菌相比,屎肠球菌的毒力较弱,但耐药性较强。本试验中涉及感染标本均来自住院患者,因此从临床治疗和院内感染方面应重视肠球菌的影响,而感染标本中存在种类较多的非可培养细菌,这些细菌是否存在抗药性基因,有无多重抗药基因等问题均有待于进一步研究验证。
[1] Barlaan E A,Sugimori M,Furukawa S,et al.Electronicmicroarray analysis of 16S rDNA amplicons for bacterial detection[J].J Biotechnol,2005,115(1):11-21.
[2] Sun W,Dong L,Kaneyama K.Bacterial diversity in synovial fluids of patients with TMD determined by cloning and sequencing analysis of the 16S ribosomal RNA gene[J].Oral Surg Oral Med Oral Pathol Oral Radiol Endod,2008,105(5):566-571.
[3] Perkins S D,Woeltje K F,Angenent L T,et al.Endotracheal tube biofilm inoculation of oral flora and subsequent colonization of opportunistic pathogens[J].Int J Med Microbiol,2010,300(7):503-511.
[4] Ifantidou A M,Diamantidis M D,Tseliki G,et al.Corynebacterium jeikeium bacteremia in a hemodialyzed patient[J].Int J Infect Dis,2010,14(Suppl 3N):e265-e268.
[5] Daly K,Stewart C S,Flint H,et al.Bacterial diversity within the equine large intestine as revealed by molecular analysis of cloned 16S rRNA genes[J].FEMS Microbiol Ecol,2001,38(1):141-151.
[6] 周琳,张杰.群落分析中的16S rRNA及其基因16S rDNA 优化扩增[J].微生物学报,2010,50(1):7-14.
[7] 萨姆布鲁克 J,拉塞尔 D W.分子克隆实验指南:上册[M].3版.黄培堂,译.北京:科学出版社,2002:103-105.
[8] 崔静,黄爱龙,张文露.结合通用引物快速简便鉴定阳性克隆的PCR方法[J].生物技术通报,2008(3):99-102.
[9] 胡晓卫,范宁.屎肠球菌58株耐药性分析[J].陕西医学杂志,2009,38(11):1525-1526.

