脑内铁沉积性神经变性病的MRI表现(附3例报告及文献复习)
黎佩君,黄飚,梁长虹,刘红军,张水兴
脑内铁沉积性神经变性病(neurodegeneration with brain iron accumulation,NBIA)是一种罕见的常染色体隐性遗传的神经变性疾病,与铁代谢障碍有关,基底节区铁沉积是其最重要的病理特点,最主要的致病基因是泛酸激酶2(pantothenate kinase 2,PANK2)基因缺陷。该病主要临床表现为进行性加重的肌张力障碍、构音不清、强直、手足徐动等锥体外系症状。本文搜集3例NBIA病例,回顾性分析其常规MRI及磁敏感加权成像(susceptibility weighted imaging,SWI)影像表现,旨在提高对该病的认识。
材料与方法
1.临床资料
搜集我院2005-2011年NBIA患者3例。病例1,男,8岁,双手取物困难,与同龄童相比言语含混不清,智力较低;查体:头围51cm,脊柱侧弯,四肢肌张力正常,坐立欠佳,共济失调试验(+),病理反射(+),双眼垂直运动差,四肢浅感觉存在,深感觉减退,骨髓穿刺检查未见海蓝细胞。病例2,女,16岁,左侧肢体不由自主运动20余天,左上肢为甚,左上肢不自主摸左肩,走路时左下肢足内翻,步态不稳,症状不能控制,紧张性加重,休息时有所改善,睡眠时缓解,症状刻板性,并伴有躯体扭曲;查体:左侧病理征阳性,骨髓穿刺检查未见海蓝细胞。病例3,女,13岁,是患者2的亲妹妹,右下肢活动障碍3年,左下肢活动障碍1年;辅助检查:骨髓穿刺检查未见海蓝细胞。病例2、3经基因学检查发现存在基因PANK2突变。
2.影像学检查
MRI扫描采用GE Signa Excite II HD 3.0T超导型磁共振成像系统,8通道标准头线圈。常规MRI成像序列包括:横轴面T1WI,液体衰减反转恢复(FLAIR)序列,TR 2700ms,TE 24ms,TI 860ms,矩阵320×256;横轴面、冠状面及矢状面FSE T2WI,TR 5100ms,TE 130ms,矩阵 512×288;横轴面 T2FLAIR,TR 9600ms,TE 110ms,TI 2400ms,矩阵288×224。层厚5mm,间隔1mm,激励次数2。2例女性患者在行常规MRI序列扫描时均加行磁敏感加权成像的多回波采集的增强T2*加权血管成像(enhanced T2star weighted angiography,ESWAN)序列:3DGRE序列,回波数为13,首个回波时间TE为2.9ms,回波间隔5.2ms,TR 136ms,翻转角30°,带宽62.5Hz,激励次数0.69,层厚3mm,层数32,矩阵320×224,视野20.0cm×19.6cm,扫描时间5min。对ESWAN图像进行后处理。扫描的每一层均得到分别对应13个回波的幅度图和相位图。
3.图像分析
所有图像均由本院放射科神经组两位医师进行观察分析,分析内容包括病灶部位、数目、大小、形态、范围等,意见不一时两人协商达成一致。
结 果
3例患者在T1WI图像上脑内均无明显异常信号。双侧苍白球在T2WI图像上均呈低信号(图1~2),边界较清,在苍白球低信号的前内部均有对称性斑点状高信号(图1a、2a),即“虎眼征”,脑内其他部位均未见异常信号。两位女性患者的SWI幅度图上双侧苍白球均呈极低信号,其形态、范围与T2WI序列上的表现相似,但在SWI幅度图上苍白球与周围组织的对比较T2WI图像更加明显(图1b、2b),幅度图上脑内其他区域未见异常低信号区。SWI相位图上双侧苍白球的相位值均降低(图1c、2c),双侧苍白球中央区相位值增高,亦呈明显的“虎眼征”。
讨 论
1.NBIA的病因、发病机制和临床表现
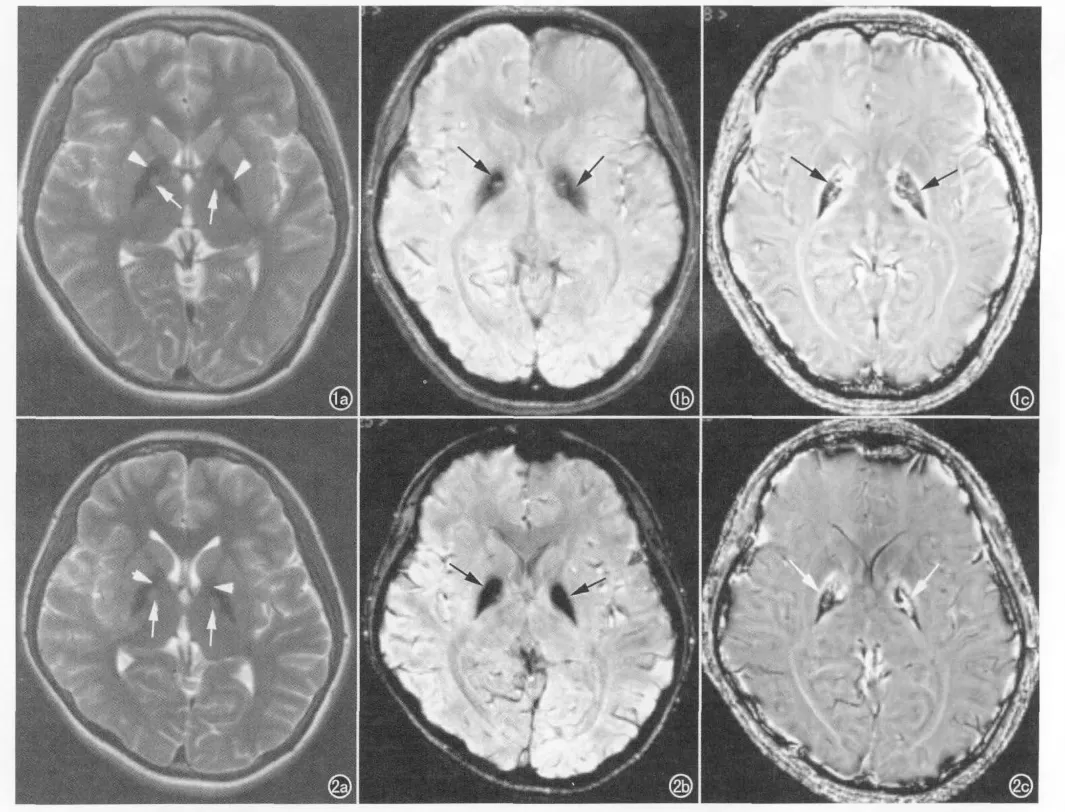
图1 女,16岁,左侧肢体不自主运动20余天。a)横轴面T2WI图像示双侧苍白球呈低信号(箭头),在低信号区域的前内部对称出现稍高信号(箭),呈“虎眼征”;b)横轴面SWI幅度图像示双侧苍白球边界清晰,呈极低信号(箭);c)横轴面SWI相位图示双侧苍白球的相位值降低(箭),其内部可见相位值增高区,亦表现为明显的“虎眼征”。 图2 女,13岁,右下肢活动障碍3年,左下肢活动障碍1年。a)横轴面T2WI图像示双侧苍白球呈周边低信号(箭头)、中央高信号(箭)的“虎眼征”;b)横轴面SWI幅度图像示双侧苍白球呈均匀极低信号(箭);c)横轴面SWI相位图示双侧苍白球亦表现为明显的“虎眼征”(箭)。
NBIA是一种非常罕见的神经变性疾病,过去称为 Hallervorden-Spatz disease(HSD),于1922年由Hallervorden和Spatz首先报道,由于Hallervorden曾帮助德国纳粹进行非人道的安乐死研究,因此有学者建议把HSD改称为脑内铁沉积性神经变性病(NBIA)。此病一般为常染色体隐性遗传,具体发病机制不清,但与铁代谢障碍有关。Zhou等[1]发现许多NBIA患者存在泛酸盐激酶2(PANK2)基因的突变,该基因所编码的泛酸激酶为辅酶A生物合成的关键酶。因此存在PANK2基因突变的又被称为泛酸盐激酶相关神经变性(pantothenate kinase-associated neurodegeneration,PKAN)。本研究中的两姐妹均存在PANK2基因突变,研究普遍认为NBIA存在较多的亚型。有学者把NBIA从分子遗传学水平上分成4个亚型:泛酸盐激酶相关神经变性(PKAN)、无血浆铜蓝蛋白(neuroferritinopathy)、幼儿神经轴索性营养不良(infantile neuroaxonal dystrophy,INAD)、铁蛋白相关的神经退行性疾病(aceruloplasminemia)[2]。也有学者把具有苍白球异常铁沉积同时伴发其他脑内表现的NBIA分为8个亚型[3],并指出可能存在不伴有脑内异常铁沉积的NBIA。若MRI上有“虎眼征”同时合并棘红细胞增多、前β脂蛋白明显减少甚至缺如以及视网膜色素变性,则称低前β脂蛋白血症-棘红细胞增多症-视网膜色素变性-苍白球变性综合征[4]。
NBIA主要临床表现为锥体外系症状,如肌张力障碍、构音不清、强直和手足徐动等,肌张力障碍是最常见的症状。部分患者合并智力减退、精神症状和视力下降(视网膜色素变性)等。根据发病年龄、临床表现及疾病进展速度将NBIA分为两型:①经典型 (早发型),发病年龄<10岁,病情进展较快,一般发病15年内不能行走,20岁前生活不能自理;②不典型(迟发型),发病年龄≥10岁,病情缓慢进展,多数患者到后期仍能行走。目前尚缺乏对NBIA的有效治疗方法,Zorzi等[5]发现去铁酮可提高NBIA患者的耐受性,并在MRI复查中发现苍白球铁含量减少,但临床症状并无明显改善。NBIA患者出现症状的平均生存期为11.8年[6]。
2.NBIA的病理基础和影像学表现
NBIA的病理基础是铁盐主要沉积在星形细胞、小胶质细胞及神经元细胞内外。铁沉积致神经轴索损害、细胞变性、空泡形成,轴索肿胀导致球形体形成。NBIA患者颅脑T1WI一般无明显异常改变,有报道称严重的胶质增生和大量的铁沉积可致T1WI上双侧苍白球出现低信号改变[7]。T2WI双侧苍白球呈周围低信号、中央斑点状高信号改变,形似虎眼,称为“虎眼征”。低信号对应病理上铁盐沉着和神经轴索肿胀区,这是由于顺磁性物质铁的T2*效应导致低信号;高信号对应病理上细胞死亡、胶质细胞增生、水含量增加及空泡形成区域,即所谓的“疏松组织区”[8]。疾病晚期大量铁沉积,T2WI苍白球可完全变成低信号,其他脑结构如黑质等也可受累,表现为T2WI信号下降。本研究中3例NBIA患者均出现典型的虎眼征改变,与大多数文献报道一致。Hayflick等[9]报道的一组有PAKN基因突变的NBIA患者中均可发现虎眼征。Delgado等[7]发现少数NBIA患者没有虎眼征,仅表现为双侧苍白球T2WI呈对称性低信号,对于病程中虎眼征的遮盖或者消失,可能属继发的病程改变,与随时间不断沉积的磁性物质覆盖原先的T2WI高信号区域有关。值得注意的是,“虎眼征”也可见于其他神经变性病,Erro等[10]报道1例73岁行动迟缓与步态冻结的男性患者,T2WI图像上也可见典型的“虎眼征”,但这种老年性神经退变性疾病患者年龄较大,与NBIA较容易鉴别。
磁敏感加权成像是一种利用不同组织间磁敏感度的差异产生图像对比的磁共振成像技术。它实际上是一种T2*技术,通过采用完全流动补偿(3个方向均有流动补偿)的3D梯度回波序列,获得相位图像和幅度图像。SWI通过引入相位信息来获得组织磁敏感的对比度,相比于其他影像方法,SWI图像可敏感地显示静脉血管、出血、铁沉积和钙化[11]。铁是能够引起相位改变的磁敏感效应较强的物质(顺磁性),可引起去相位改变。本研究2例NBIA患者的SWI幅度图像上均可明确显示病变,均呈双侧苍白球对称性低信号;在相位图上,双侧苍白球的相位值降低(呈低信号),双侧苍白球中央区相位值增高(呈高信号),呈典型的“虎眼征”,比T2WI更敏感。因此,SWI对于颅内铁质异常沉积疾病的诊断有较高价值。有学者提出NBIA疾病的严重程度与铁沉积量呈正相关[12]。Szumowski等[13]利用脑内组织间相位值的差别定量测定出铁含量,以期通过测量相位值的改变来监测病程的进展及疗效。Hajek等[14]利用氢质子 MR波谱研究发现NBIA患者苍白球NAA峰比健康人明显下降。Delgado等[7]利用扩散张量成像(diffusion tensor imaging,DTI)研究发现NBIA患者双侧苍白球区FA值和平均扩散率(mean diffusion,MD)升高,原因是铁沉积干扰局部磁场,但NBIA不同于其他累及基底节区及丘脑的变性疾病,如亨廷顿病或进行性核上行麻痹,DTI显示NBIA患者白质纤维仍正常。Awasthi等[15]发现在苍白球区域,“虎眼征”T2WI高信号区的FA值比低信号区的要低,但仍然高于健康人群组。
3.鉴别诊断
诊断NBIA时,必须与临床相结合,注意与以下几种具有类似MRI表现的疾病相鉴别。一氧化碳中毒性脑病、甲醇中毒性脑病等代谢中毒性疾病,均可表现为双侧苍白球对称性病变,但均表现为双侧苍白球T2WI信号增高,没有T2WI低信号改变,结合相关病史即可明确诊断;进行性核上性麻痹有特征性的核上性凝视麻痹,有智力障碍和步态异常,多为中老年患者发病,MRI显示中脑萎缩[16]。肝豆状核变性为遗传性铜代谢障碍引起的肝硬化和脑变性疾病,患者有肝硬化病史,血清铜蓝蛋白显著降低,可见角膜色素环K-F环,双侧豆状核T2WI呈高信号改变;少年型亨延顿病以弥漫性脑萎缩为主,头颅MRI常可见尾状核头部和壳核萎缩[8]。
总之,MRI是NBIA患者最重要的影像检查方法,“虎眼征”是NBIA的特异性征象,SWI幅度图能更清晰地显示苍白球的病变区域,SWI相位图不仅能敏感地显示“虎眼征”,而且可定量测量苍白球基底节区的铁沉积。
[1]Zhou B,Westerway SK,Levison B,et al.A novel pantothenate kinase gene(PANK2)is defective in Hollervorden-Spatz syndrome[J].Nat Genet,2001,28(4):345-349.
[2]McNeill A,Birchall D,Hayflick SJ,et al.T2*and FSE MRI distinguishes four subtypes of neurodegeneration with brain iron accumulation[J].Neurology,2008,70(18):1614-1619.
[3]Kruer MC,Boddaert N,Schneider SA,et al.Neuroimaging features of neurodegeneration with brain iron accumulation[J].AJNR,2012,33(3):407-414.
[4]张玉虎.Hallervorden-Spatz综合征的临床与遗传学研究进展[J].临床神经病学杂志,2006,19(2):151-152.
[5]Zorzi G,Zibordi F,Chiapparini L,et al.Iron-related MRI images in patients with pantothenate kinase-associated neurodegeneration(PKAN)treated with deferiprone:results of a phase II pilot trial[J].Mov Disord,2011,26(9):1756-1759.
[6]Sharma MC,Aggarwal N,Bihari M,et al.Hallervorden spatz disease:MR and pathological findings of a rare case[J].Neurol India,2005,53(1):102-104.
[7]Delgado RF,Sanchez PR,Speckter H,et al.Missense PANK2mutation without“eye of the tiger”sign:MR findings in a large group of patients with pantothenate kinase-associated neurodegeneration(PKAN)[J].J Magn Reson Imaging,2012,35(4):788-794.
[8]梁碧玲,黄穗乔,黄力,等.中枢神经系统疑难病例影像诊断[M].北京:人民卫生出版社,2010:253-255.
[9]Hayflick SJ,Hartman M,Coryell J,et al.Brain MRI in neurodegeneration with brain iron accumulation with and without PANK2 mutations[J].AJNR,2006,27(6):1230-1233.
[10]Erro R,Amboni M,Vitale C,et al.The“eye of the tiger”sign in pure akinesia with gait freezing[J].Neurol Sci,2011,32(4):703-705.
[11]舒红格,漆剑频,朱文珍,等.磁敏感成像在颅内钙化灶和铁沉积鉴别中的运用[J].华中科技大学学报(医学版),2009,(1):87-90.
[12]Hayflick SJ,Westerway SK,Levison B,et al.Genetic,clinical,and radiographic delineation of Hallervorden-Spatz syndrome[J].N Engl J Med,2003,348(1):33-40.
[13]Szumowski J,Bas E,Gaarder K,et al.Measurement of brain iron distribution in Hallervorden-Spatz syndrome[J].J Magn Reson Imaging,2010,31(2):482-489.
[14]Hajek M,Adamovicova M,Herynek V,et al.MR relaxometry and1H-MR spectroscopy for the determination of iron and metabolite concentrations in PKAN patients[J].Eur Radiol,2005,15(5):1060-1068.
[15]Awasthi R,Gupta RK,Trivedi R,et al.Diffusion tensor MR imaging in children with pantothenate kinase-associated neurodegeneration with brain iron accumulation and their siblings[J].AJNR,2010,31(3):442-447.
[16]严新翔.Hallervorden-Spatz病的临床和MRI特点(附2例分析)[J].中国医学影像学杂志,2005,13(3):167-169.

