儿童尿毒症脑病的MRI诊断
庞军,桂林,戴世鹏,戴景儒
儿童尿毒症脑病(children uremic encephalopathy)是晚期肾病患儿的严重并发症之一,具有病情危重、发病隐袭、病死率高的特点,早期发现、及时诊断和治疗可明显改善患儿的症状、降低病死率。笔者搜集2010年7月-2012年7月在本院诊治并行颅脑MRI扫描的28例儿童尿毒症脑病的病例资料,分析其MRI表现,旨在探讨MRI对诊断儿童尿毒症脑病的临床应用价值。
材料与方法
1.临床资料
本组共28例患儿,男18例,女10例;年龄8~14岁,平均(9.35±2.82)岁;病程3~25个月,平均(9.39±3.45)个月。本组病例既往均无神经、精神病病史。引起尿毒症的原发病因:高血压肾病9例,慢性肾盂肾炎7例,糖尿病肾病6例,慢性肾小球肾炎3例,狼疮性肾炎3例。本组患儿均符合慢性肾脏病5期诊断标准[1],所有患儿在初次MRI检查前均未行透析治疗。20例颅脑有局限性病灶的患儿经对症治疗7~10d后复查MRI。
2.儿童尿毒症脑病的临床表现及实验室检查
依据患儿首次发病方式对尿毒症脑病的主要临床表现进行分类:意识障碍8例、精神障碍7例、扑翼样震颤5例、癫痫大发作5例、癫痫小发作3例。
血生化检查:尿素氮值23.2~33.7mmol/L,平均29.5mmol/L;血肌酐值730~1640μmol/L,平均970μmol/L。28例患儿中,低钠血症(<130mmol/L)13例,低钙血症(<2.2mmol/L)15例,低氯血症(<98mmol/L)12 例,二 氧 化 碳 结 合 力 降 低(<22mmol/L)14例,高钾血症(>6.5mmol/L)10例。
3.检查方法
使用Philips Achieva 3.0T超导磁共振成像系统,头部SENSE 8通道相控阵线圈,均行常规MRI序列及扩散加权成像(diffusion weighted imaging,DWI)检查。13例患儿行颅脑MRI增强扫描,对比剂采用钆喷酸葡胺,剂量0.1mmol/kg。
常规 MRI序列及参数:横轴面TSE T1WI,TR 1990ms,TE 25ms,层厚5mm,无间隔,激励次数2,加速因子8;T2WI-TSE,TR 3020ms,TE 85ms,层厚5mm,无间隔,激励次数1,加速因子16;液体衰减反转恢复(FLAIR)序列,TR 11010ms,TE 125ms,IR 2850ms,层厚5mm,无间隔,激励次数2,加速因子30;矢状面 T2WI-TSE:TR 2123ms,TE 80ms,层厚5mm,无间隔,激励次数2,加速因子20。增强扫描应用T1WI-SE序列:TR 150ms,TE 2.5ms,层厚5mm,间隔1mm。DWI序列:单次激发敏感编码技术,TR 1510ms,TE 55ms,b=1000s/mm2,层厚5mm,间隔1mm。
4.MRI图像分析及评价方法
由两位MRI诊断医师采用双盲法,对患儿颅脑局限性病灶进行评价,分析病灶的部位、分布、大小,以及常规MRI序列和DWI上的影像特点。
结 果
1.颅脑局限性病灶
本组28例患儿中发现颅脑局限性病灶者20例,占71.43%。病灶均为多发,主要累及两侧顶枕叶皮层下白质,3例累及顶枕叶皮层和基底节区,呈对称性分布15例,非对称性分布5例。病灶最大径13mm,最小径3mm。病变于T1WI上呈低信号(图1a)、T2WI上呈高信号(图1b)、FLAIR图像上呈高信号(图1c)12例,于 T1WI上呈等信号(图2a)、T2WI上呈稍高信号(图2b)、FLAIR图像上呈稍高信号8例;于DWI上呈较低及等信号(图1d)、ADC图上呈较高信号(图1e)12例,于DWI上呈等信号(图2c)、ADC图上呈稍高信号(图2d)8例。其中13例患儿行颅脑MRI增强扫描,所有局限性病灶均无强化(图2e)。
2.临床转归及复查MRI表现
所有患儿依据不同的临床表现经药物治疗及(或)血液透析治疗后,患儿的临床症状均逐渐减轻。2~3个月后随访21例患儿无临床症状,7例患儿仍有轻微的症状。对颅脑有局限性病灶的20例患儿对症治疗7~10d后复查颅脑MRI,示14例患儿颅脑局限性病灶完全消失(图1f-i),6例患儿局限性病灶总数量由原来的18个减少至10个,病灶大小由原来的最大径平均8mm缩小至4mm。复查MRI所观察到的局限性病灶与初次MRI图像对比,病灶信号强度于T2WI和FLAIR像上均较前减低,病灶边界较前模糊。
讨 论
1.尿毒症脑病的病因
尿毒症患者发生精神、神经等中枢神经系统方面的异常表现,称为尿毒症脑病[2](uremic encephalopathy,UE),为尿毒症患者最常见的并发症。目前认为有以下几种致病因素:①代谢产物的蓄积中毒。肾功能衰竭时,体内代谢产物如肌酐、肌酸、尿毒、尿酸和胍类等非蛋白氮以及吲哚化合物和酚类的蓄积[3],导致毒副作用。中分子物质如β2-微球蛋白在体内的蓄积与尿毒症脑病密切相关[4]。②代谢失衡、电解质紊乱。主要原因有低钾血症[5]、低钠血症、水中毒、代谢性酸中毒以及肾功能不全导致液体的过渡灌注而引起的血压急剧增高[6]。③内分泌功能的变化。尿毒症患者常继发性甲状旁腺功能亢进,血中甲状旁腺素升高,引发甲状旁腺素的神经毒性作用,出现神经、精神症状。
2.儿童尿毒症脑病的典型MRI表现及临床应用价值
本组儿童尿毒症脑病的MRI典型表现为颅脑多发性、局限性异常信号,好发部位为顶枕叶,主要累及皮层下白质,皮层及基底节极少受累,少见部位的病灶常与顶枕叶的病灶共存。病灶多数呈两侧对称性分布,也可表现为非对称性,单侧病变较为少见,其最大径以6~10mm最为多见,边界清楚。病灶于T1WI呈低信号或等信号,T2WI呈高信号或稍高信号,FLAIR图像上呈高信号,DWI上呈低信号或等信号,表观扩散系数(apparent diffusion coefficient,ADC)图上呈稍高信号。本病颅脑局限性病灶的另一个特点为具有可逆性,绝大多数病灶经过治疗后可完全消失。
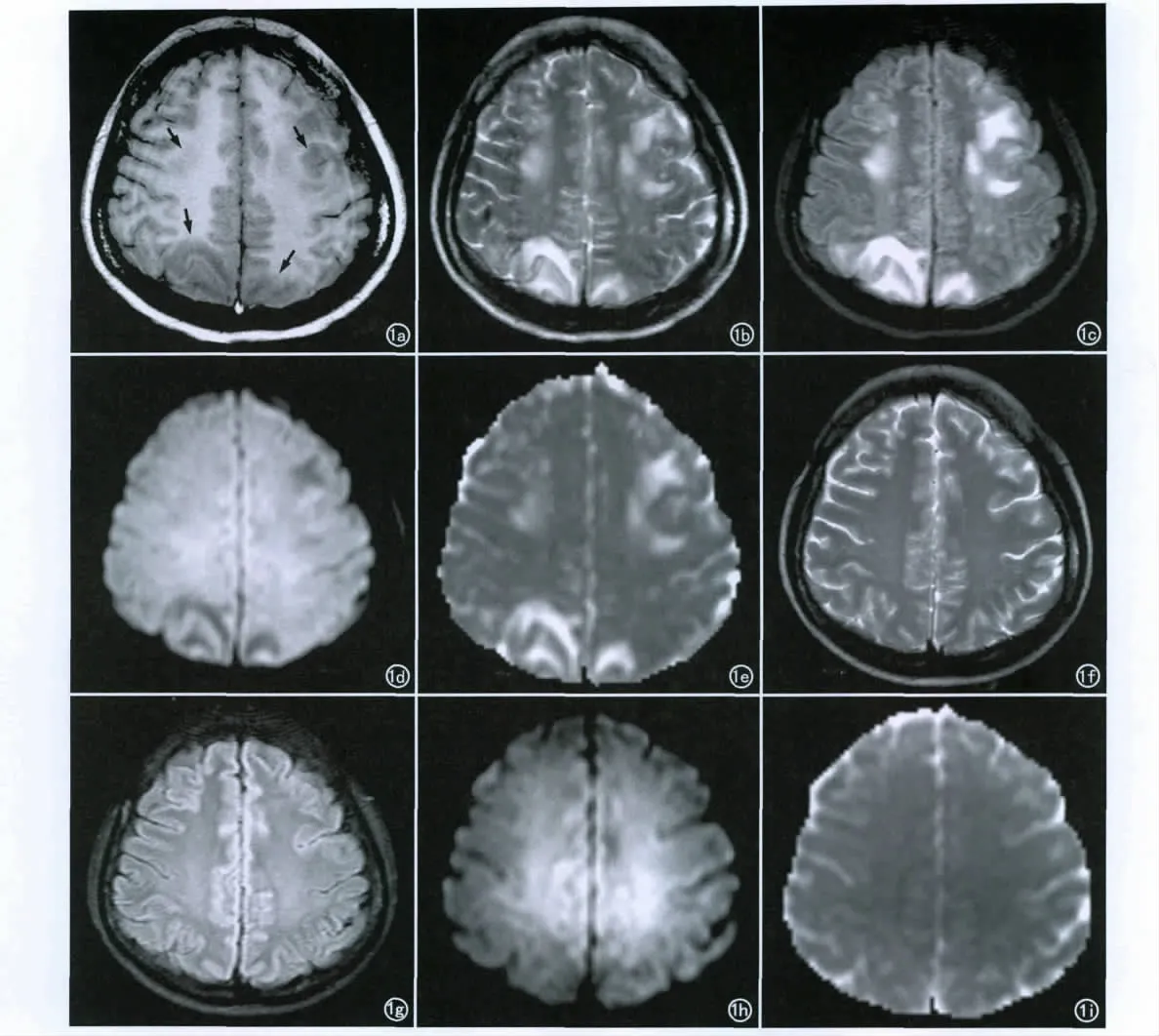
图1 男,12岁,高血压肾病,22个月。a)T1WI示两侧额顶叶皮层下白质局限性低信号灶,多发、对称性分布(箭);b)T2WI示病灶呈局限性高信号,边界清楚;c)FLAIR图示病灶呈局限性高信号;d)DWI示病灶呈较低信号及等信号;e)ADC图示病灶呈较高信号;f)与前片对比,T2WI示颅脑局限性病灶完全消失;g)FLAIR图示颅脑内未见异常;h)DWI示脑内未见异常;i)ADC图上未见异常。(f~i同一患儿透析治疗10天后复查颅脑MRI)。
MRI常规序列,特别是FLAIR序列可清晰、明确的显示儿童尿毒症脑病脑内局限性病灶的发生部位、分布、大小;DWI序列则在鉴别诊断方面具有重要价值,可明确区分血管源性水肿与细胞毒性水肿,不仅能判定病灶的性质,还可初步评估患儿的预后。因此,MRI可依据其典型表现并结合病史,对本病作出明确诊断。此外,MRI可明确显示患儿治疗后脑内局限性病灶的变化,在观察患儿的转归方面具有显著优势,为临床治疗提供可靠依据,因此,MRI在诊断儿童尿毒症脑病中具有重要的临床应用价值。
3.鉴别诊断
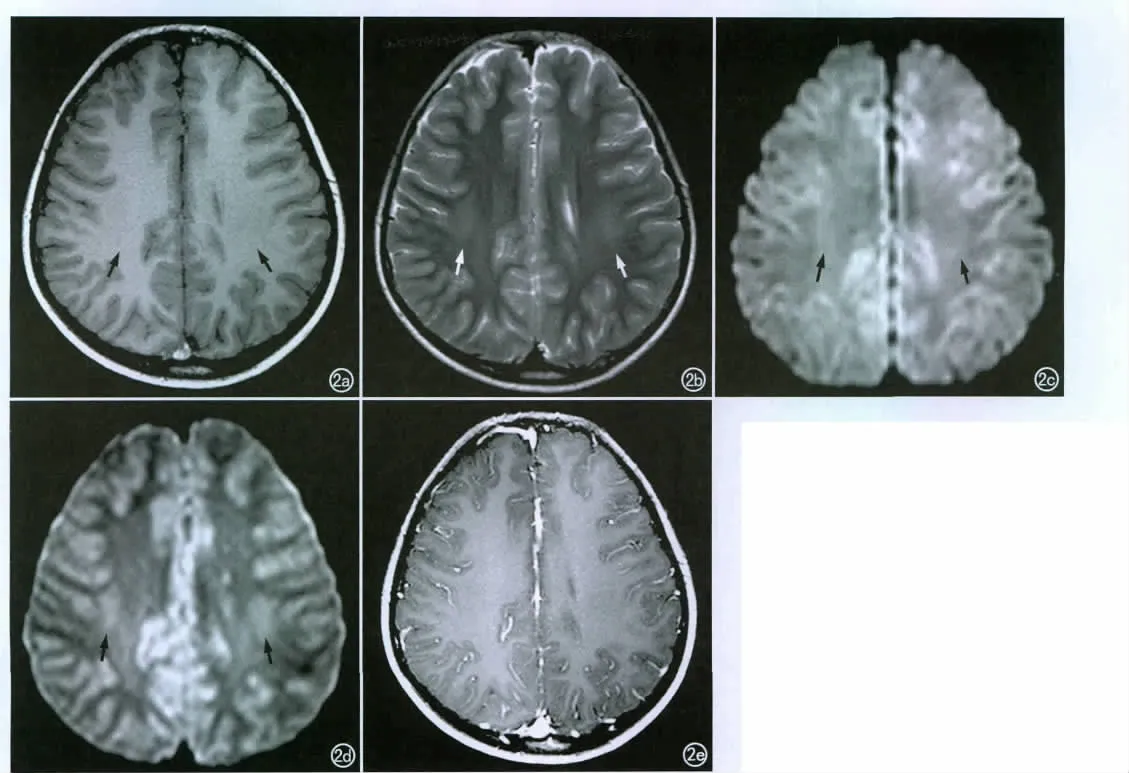
图2 女,13岁,糖尿病肾病,20个月。a)T1WI上脑内局限性病灶呈等信号(箭);b)T2WI示两侧额顶叶白质内小片状局限性稍高信号(箭);c)DWI示病灶呈等信号(箭);d)ADC示病灶呈稍高信号(箭);e)Gd-DTPA增强扫描示局限性病灶未见强化。
儿童尿毒症脑病主要与以下几种疾病鉴别。①脑后部可逆性脑病综合征(posterior reversible encephalopathy syndrome,PRES):PRES是一种可逆性神经综合征,由Hinchey等[7]于1996年提出,其发病机制始终不明确[8],与多种疾病有关,包括高血压病、慢性肾功能不全、妊娠子痫、接受免疫抑制、细胞毒性药物治疗等[9]。PRES以急性起病的癫痫发作、意识错乱、视觉改变为主要临床症状,MRI显示双侧顶枕叶多发异常信号。PRES与儿童尿毒症脑病有以下不同之处。第一,致病因素不同。尿毒症脑病的致病因素主要有代谢产物的蓄积中毒、代谢失衡致电解质紊乱以及内分泌功能变化引发的甲状旁腺素的神经毒性作用。PRES的发病机制与脑血管自我调节功能紊乱和脑血管内皮细胞受损有关。颅内血管在PRES发生时的舒缩状态有高灌注和血管痉挛两种假说。第二,临床表现不同。PRES患儿主要以昏迷或视物模糊、眼睑水肿为主,而儿童尿毒症脑病患儿主要以急性癫痫发作、精神异常及意识障碍为主。第三,颅脑局限性病灶的发生部位不同。PRES患儿颅脑局限性病灶皮层受累较多见,病灶多呈不对称性分布。儿童尿毒症脑病颅脑局限性病灶主要累及皮层下白质,皮层极少受累,绝大部分病灶呈对称性分布。但两者的MRI表现存在交叉的情况,仅仅依据影像表现较难鉴别,因此临床资料十分重要,只要密切结合患者的病史,两者较易鉴别。同时,由于两者的临床治疗方法明显不同,其鉴别诊断具有非常重要的临床意义。②中枢神经系统免疫相关疾病:中枢神经系统免疫相关疾病种类较多,常见的有多发性硬化(mulitiple sclerosis,MS)、急性播散性脑脊髓炎(acute disseminated encephalomyelitis,ADEM)等免疫介导性脱髓鞘病以及系统性红斑狼疮脑 病 (neuropsychiatric systemic lupus erythemato-sus,NPSLE)等结缔组织病。MS病程较长,病情常呈缓解和复发交替出现,好发于20~40岁女性,儿童少见,在我国儿童MS首发症状以视觉障碍最为常见[10]。MRI显示脱髓鞘斑块多垂直于侧脑室排列,典型者呈“直角脱髓鞘”征,病灶缺乏对称性[11],活动期病灶呈斑点样或不完全环形强化。ADEM大多急性起病,常有发热,临床表现以运动障碍为主[12]。MRI表现为多发的长T1、长T2信号,累及额顶叶、小脑、脑干、脊髓的白质区,深层脑白质如基底节、丘脑也可受累,病灶多为双侧,较为对称,增强后可见边缘或环形强化。在发病一周左右有进展,短期内可出现脑萎缩。NPSLE的发病机制是由于自身抗体、血小板与血管壁作用产生广泛的血管炎和微血栓,脑内中小血管壁炎性细胞浸润、结构破坏、小血管闭塞[13],导致脑皮质、白质以及脑干的多发梗死灶,颅内出血及感染。同时,中枢神经系统的免疫反应激活补体系统,使脑内毛细血管通透性增加,出现精神、神经症状。MRI表现为分布于大脑皮质和深部白质的斑点样、条状较长T1、长T2信号或颅内出血灶。病灶的分布以双侧基底节和额顶枕叶多见。依据患儿的临床情况及MRI表现,上述疾病与儿童尿毒症脑病较易鉴别。③颅脑炎性病变:部分颅脑炎性病变可有MRI异常表现,其与尿毒症脑病会有“异病同影”的情况,但两者在患儿的病史、临床表现及实验室检查等方面明显不同,鉴别不难。④动脉性脑梗死:儿童的动脉性脑梗死较为少见,两者有以下鉴别点。首先,患儿的病史、临床症状及体征明显不同;其次,动脉性脑梗死以单发病灶多见,病灶位于脑动脉血管供应区,灰质和白质可单独或同时受累。早期脑梗死引起细胞毒性水肿,导致自由水的扩散受限,病灶于DWI上呈高信号,ADC图上呈低信号,与血管源性水肿无关[14-16],而儿童尿毒症脑病主要导致血管源性水肿,DWI序列可明确鉴别细胞毒性水肿及血管源性水肿,因此MRI扫描,尤其是DWI序列有重要的临床应用价值。
总之,对儿童尿毒症脑病患儿,依据典型的MRI表现并结合病史,可对其作出明确的诊断。MRI不仅在本病的诊断、鉴别诊断方面具有重要的临床应用价值,同时对本病的治疗后转归及预后评估也具有重要的指导意义,应进一步的研究和推广应用。
[1]Levey AS,Atkins R,Coresh J,et al.Chronic kidney disease as a global public health problem:approaches and initiatives apposition statement from kidney disease improving global[J].Kidney Int,2007,72(3):247-259.
[2]董艳娟.尿毒症性脑病[J].脑与神经疾病杂志,2007,15(4):311-312.
[3]Brouns R,De Deyn PP.Neurological complications in renal failure:a review[J].Clin Neurol Neurosurg,2004,107(1):1-16.
[4]Enomoto A,Takeda M,Taki K,et al.Interactions of human organic anion as well as cation transporters with indoxyl sulfate[J].Eur J Pharmacd,2003,466(1-2):13-20.
[5]王月红,李贞兰,陈燕,等.尿毒症脑病的危险因素分析[J].中风与神经疾病杂志,2010,27(10):935-937.
[6]Ozkan A,Hakyemez B,Ozkalemkas F,et al.Tumorlysis syndrome as a contributory factor to the development of reversible posterior leukoencephalopathy[J].Neuroradiol,2006,48(12):887-892.
[7]Hinchey J,Chaves C,Appignani B,et al.A reversible posterior leukoencephalopathy syndrome[J].N Engl J Med,1996,334(8):494-500.
[8]Sattar A,Manousakis G,Jensen MB.Systematic review of reversible cerebral vasoconstriction syndrome[J].Expert Rev Cardiovasc Ther,2010,8(10):1417-1421.
[9]Fugate JE,Claassen DO,Cloft,et al.Posterior reversible encephalopathy syndrome:associated clinical and radiologic findings[J].Mayo Clin Proc,2010,85(5):427-432.
[10]朱近,张玉琴,李鸿.儿童多发性硬化的临床特征及治疗随访[J].临床儿科杂志,2009,27(8):761-763.
[11]Callen DJ,Shroff MM,Branson HM,et al.MRI in the diagnosis of pediatric multiple scleraosis[J].Neurology,2009,72(3):961-967.
[12]Alper G,Heyman R,Wang L,et al.Mulitiple sclerosis and acute disseminated encephalomyelitis diagnosed in children after longterm follow-up:comparison of presenting features[J].Dev Med Child Neurol,2009,51(6):480-486.
[13]邱娟,梁昌华,左晓霞.系统性红斑狼疮脑病患者的rCBF显像与CT/MRI的对比研究[J].中国医学影像技术,2007,23(4):595-598.
[14]Ahn Kj,You WJ,Jeong SL,et al.A tipical manifestations of reversible posterior leukoencephalopathy syndrome:findings on diffusion and ADC maping[J].Neuroradiol,2004,46(12):978-983.
[15]Lamy C,Oppenheim C,Medre JF,et al.Neuroimaging in posterior reversible encephalopathy syndrome[J].J Neuroimaging,2004,14(2):89-96.
[16]Ugurel MS,Hayakawa M.Implications of post-gadolonium MRI results in 13cases with posterior reversible encephalopathy syndrome[J].Eur J Radiol,2005,53(3):441-449.