沙蓬地上部分三萜皂苷类化学成分的研究
刘紫淳,李英华,曲俊业,李玉山
(沈阳药科大学 中药学院,辽宁 沈阳 110016)
中药科技
沙蓬地上部分三萜皂苷类化学成分的研究
刘紫淳,李英华,曲俊业,李玉山*
(沈阳药科大学 中药学院,辽宁 沈阳 110016)
目的:对沙蓬地上部分三萜皂苷类化学成分进行研究。方法:采用D-101大孔吸附树脂柱色谱、反复硅胶柱色谱、半微量制备型高效液相色谱和制备薄层色谱分离、纯化,根据1H-和13C-NMR波谱数据进行结构鉴定。结果:从沙蓬地上部分乙醇提取物的正丁醇萃取物中分离得到4个齐墩果烷型三萜皂苷类化合物,分别鉴定为木鳖子苷Ⅱc(1)、伪人参皂苷RT1(2)、齐墩果酸-3-O-[α-L-吡喃阿拉伯糖基-(1→3)-β-D-吡喃葡萄糖醛酸基]-28-O-β-D-吡喃葡萄糖基酯苷(3)、齐墩果酸-3-O-[β-D-吡喃葡萄糖基-(1→3)-α-L-吡喃阿拉伯糖基]-28-O-β-D-吡喃葡萄糖基酯苷(4)。结论:化合物2和3从藜科植物中首次分离得到,4从沙蓬属植物中首次分离得到。
沙蓬;化学成分;齐墩果烷型三萜皂苷
蒙药沙蓬为藜科植物沙蓬Agriophyllumsquarrosum(L.)Moq.的干燥地上部分,始载于《认药白晶鉴》,分布于我国东北、华北、西北、河南及西藏等地[1-2]。性平,味苦、涩;具有祛疫、清热、解毒、利尿之功效,主治瘟疫、头痛、赤目、黄疸、肾热、口舌生疮等症[3]。为了阐明其药效物质基础,课题组对沙蓬地上部分的化学成分进行研究报道[4-6]。在继续深入的研究过程中,又从沙蓬地上部分乙醇提取物的正丁醇萃取物中分离得到4个齐墩果烷型三萜皂苷类化合物,它们的化学结构式见图1。
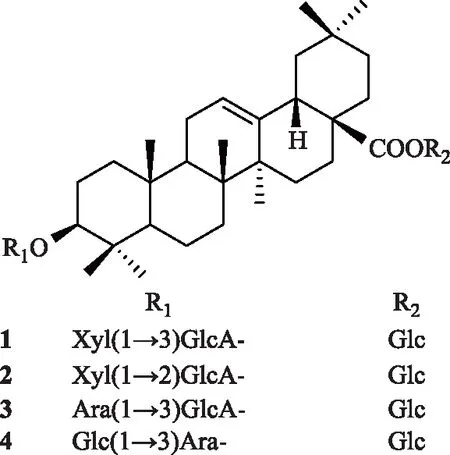
图1 化合物1~4化学结构
1 仪器与材料
Bruker AV-400核磁共振波谱仪(瑞士Bruker公司);LC-10AT高效液相色谱仪,SPD-10A紫外检测器;色谱柱DFVELOSIL ODS-HG-5NOMURA CHEMICAI Mfg.No.2911328(300 mm×10 mm,5 μm)(日本Shimadzu公司)。
薄层色谱用硅胶GF254(10~40 μm)、柱色谱用硅胶(200~300 μm)(青岛海洋化工厂)。D-101大孔吸附树脂(沧州宝恩公司)。高效液相色谱用甲醇(分析纯,天津博迪化工股份有限公司),水经重蒸馏后与有机溶剂按体积比配成流动相;其余试剂(分析纯,市售)。
沙蓬药材于2010年9月采自内蒙古,经沈阳药科大学李玉山教授鉴定为沙蓬Agriophyllumsquarrosum(L.)Moq.的干燥地上部分。药材标本保存在沈阳药科大学生药学教研室。
2 提取与分离
取干燥的沙蓬药材2 kg,粉碎,用体积分数70%的乙醇回流提取3次(3,2,2 h),回收溶剂得乙醇浸膏150 g。将乙醇浸膏用0.5 L水制成悬浮溶液,依次用石油醚、正丁醇分别萃取3次,得到石油醚萃取物10 g、正丁醇萃取物70 g。全部正丁醇萃取物通过D-101大孔树脂柱色谱、半微量制备型高效液相柱色谱、硅胶柱色谱、制备薄层色谱分离、纯化,得到化合物1(17.5 mg)、2(25.5 mg)、3(30.7 mg)和4(25.6 mg)。
3 结构鉴定
化合物1:白色无定型粉末(甲醇)。在硅胶薄层色谱上与10%浓硫酸乙醇试剂喷雾后加热显紫色斑点。1H-NMR(CD3OD,400 MHz)给出齐墩果烷型三萜皂苷元的7个甲基质子信号δ0.76(3H,s,H3-26),0.79(3H,s,H3-24),0.87(3H,s,H3-30),0.89(3H,s,H3-29),0.91(3H,s,H3-23),1.00(3H,s,H3-25),1.11(3H,s,H3-27),1个连氧次甲基质子信号δ3.15(1H,dd,J=11.6,4.0 Hz,H-3),1个烯质子信号δ5.21(1H,s,H-12)等特征信号。13C-NMR(CD3OD,100 MHz)波谱图数据(表1)给出齐墩果烷型三萜皂苷元的碳特征信号[7],包括7个甲基碳信号δ16.0(C-25)、17.0(C-24)、17.7(C-26)、24.0(C-30)、26.3(C-27)、28.5(C-23)、33.5(C-29),1个连氧次甲基碳信号δ90.9(C-3),1组双键碳信号δ123.9(C-12)和144.8(C-13),1个羰基碳信号δ178.3(C-28)。1H-NMR谱给出3个单糖基的端基质子信号δ4.34(1H,d,J=7.8 Hz,H-1′)、4.52(1H,d,J=7.6 Hz,H-1″)、5.34(1H,d,J=8.2 Hz,H-1‴)。13C-NMR波谱给出3组单糖基碳信号(表2),包括1个吡喃葡萄糖醛酸基[δ106.3(C-1′)、75.1(C-2′)、86.6(C-3′)、70.9(C-4′)、77.5(C-5′)、170.5(C-6′)],1个吡喃木糖基[δ105.6(C-1″)、74.9(C-2″)、77.1(C-3″)、71.0(C-4″)、67.1(C-5″)],1个吡喃葡萄糖基[δ95.7(C-1‴)、73.8(C-2‴)、78.6(C-3‴)、72.1(C-4‴)、78.2(C-5‴)、62.5(C-6‴)]。以上波谱数据与文献[8-9]数据基本一致,故鉴定化合物1为木鳖子苷(momordin)Ⅱc。
化合物2:白色无定型粉末(甲醇)。在硅胶薄层色谱,与10%浓硫酸乙醇试剂喷雾后加热显紫色斑点。1H-NMR(CD3OD,400 MHz)波谱图给出齐墩果烷型三萜皂苷元上的7个甲基质子信号δ0.83(3H,s,H3-26),0.87(3H,s,H3-24),0.95(3H,s,H3-30),0.97(3H,s,H3-29),0.98(3H,s,H3-23),1.08(3H,s,H3-25),1.19(3H,s,H3-27),1个连氧次甲基质子信号δ3.17(1H,m,H-3),1个烯质子信号δ5.28(1H,br s,H-12)等特征信号。13C-NMR(CD3OD,100 MHz)波谱图数据(表1)给出齐墩果烷型三萜皂苷元碳特征信号[7],包括7个甲基碳信号δ16.0(C-25)、17.0(C-24)、17.8(C-26)、24.0(C-30)、26.3(C-27)、28.5(C-23)、33.5(C-29),1个连氧次甲基碳信号δ90.8(C-3),1组双键碳信号δ123.9(C-12)和144.8(C-13),1个羰基碳信号δ178.1(C-28),以上数据表明化合物2的皂苷元与1相同。1H-NMR谱给出3个糖基相应的端基质子信号δ4.41(1H,d,J=7.9 Hz,H-1′)、4.59(1H,d,J=7.1 Hz,H-1″)、5.41(1H,d,J=8.0 Hz,H-1‴)。13C-NMR谱给出3组单糖基碳信号(表2),包括1个吡喃葡萄糖醛酸基[δ105.6(C-1′)、83.5(C-2′)、75.1(C-3′)、74.0(C-4′)、77.6(C-5′)、171.7(C-6′)],1个吡喃木糖基[δ106.4(C-1″)、75.0(C-2″)、77.6(C-3″)、71.0(C-4″)、67.2(C-5″)],1个吡喃葡萄糖基[δ95.8(C-1‴)、74.0(C-2‴)、78.3(C-3‴)、71.2(C-4‴)、78.7(C-5‴)、62.5(C-6‴)]。化合物2和1的区别在于C-3位的糖链上的木糖基连接在葡萄糖醛酸基的C-2位上。以上波谱数据与文献报道[10]数据基本一致,故鉴定化合物2为伪人参皂苷(pseudoginsenoside)RT1。
化合物3:白色无定型粉末(甲醇)。在硅胶薄层色谱与10%浓硫酸乙醇试剂喷雾后加热显紫色斑点。1H-NMR(CD3OD,400 MHz)波谱给出三萜皂苷元上的7个甲基质子信号δ0.83(3H,s,H3-26)、0.87(3H,s,H3-24)、0.95(3H,s,H3-30)、0.97(3H,s,H3-29)、0.98(3H,s,H3-23)、1.08(3H,s,H3-25)、1.19(3H,s,H3-27),1个连氧次甲基质子信号δ3.23(1H,m,H-3),1个烯质子信号δ5.29(1H,br s,H-12)等特征信号。13C-NMR(CD3OD,100 MHz)波谱图数据(表1)给出齐墩果烷型三萜皂苷碳特征信号,包括7个甲基碳信号δ16.0(C-25)、17.0(C-24)、17.7(C-26)、24.0(C-30)、26.3(C-27)、28.5(C-23)、33.5(C-29),1个连氧次甲基碳信号δ90.8(C-3),1组双键碳信号δC123.8(C-12)和144.8(C-13),1个羰基碳信号δC178.1(C-28),以上数据表明化合物3的苷元为齐墩果酸[7]。1H-NMR波谱给出3个糖基相应的端基质子信号δ4.42(1H,d,J=7.7 Hz,H-1′)、4.60(1H,d,J=7.4 Hz,H-1″)、5.42(1H,d,J=8.1 Hz,H-1‴)。13C-NMR波谱给出3组单糖基碳信号(表2),包括1个吡喃葡萄糖醛酸基[δ105.6(C-1′)、72.1(C-2′)、86.8(C-3′)、70.9(C-4′)、77.6(C-5′)、ND(C-6′)],1个吡喃阿拉伯糖基[δ106.3(C-1″)、74.9(C-2″)、73.9(C-3″)、70.9(C-4″)、67.1(C-5″)],1个吡喃葡萄糖基[δ95.7(C-1‴)、75.0(C-2‴)、78.7(C-3‴)、71.1(C-4‴)、78.3(C-5‴)、62.5(C-6‴)]。经与文献值[11]对照,确定化合物3为齐墩果酸-3-O-[α-L-吡喃阿拉伯糖基-(1→3)-β-D-吡喃葡萄糖醛酸基]-28-O-β-D-吡喃葡萄糖基酯苷{oleanolicacid3-O-[α-L-arabinopyranosyl-(1→3)-β-D-glucuronopyranosyl]-28-O-β-D-glucopyranosyl ester}。
化合物4:白色无定型粉末(甲醇)。在硅胶薄层色谱与10%浓硫酸乙醇试剂显紫色斑点。1H-NMR(CD3OD,400 MHz)波谱给出三萜皂苷元上的7个甲基质子信号δ0.84(3H,s,H3-26)、0.87(3H,s,H3-24)、0.95(3H,s,H3-30)、0.97(3H,s,H3-29)、0.98(3H,s,H3-23)、1.08(3H,s,H3-25)、1.19(3H,s,H3-27),1个连氧次甲基质子信号δ3.2(1H,d,4.2,H-3),1个烯质子信号δ5.29(1H,br s,H-12)等特征信号。13C-NMR(CD3OD,100 MHz)波谱图数据(表1)给出7个甲基碳信号δ16.0(C-25)、17.0(C-24)、17.8(C-26)、24.0(C-30)、26.3(C-27)、28.5(C-23)、33.5(C-29),1个连氧次甲基碳信号δ90.8(C-3),1组双键碳信号δ123.9(C-12)和144.8(C-13),1个羰基碳信号δ178.1(C-28),以上数据表明化合物4苷元亦为齐墩果酸[7]。1H-NMR波谱给出3个糖基的端基质子信号δ4.61(1H,d,J=7.2 Hz,H-1′)、4.42(1H,d,J=7.8 Hz,H-1″)、5.42(1H,d,J=8.0 Hz,H-1‴)。13C-NMR波谱给出3组单糖基碳信号(表2),包括1个吡喃阿拉伯糖基[δ105.6(C-1′)、72.1(C-2′)、86.7(C-3′)、71.0(C-4′)、67.1(C-5′)],2个吡喃葡萄糖基[δ106.3(C-1″)、73.9(C-2")、77.6(C-3″)、71.2(C-4″)、76.9(C-5″)、62.5(C-6″)]、[δ95.7(C-1‴)、75.0(C-2‴)、78.7(C-3‴)、71.2(C-4‴)、78.3(C-5‴)、62.5(C-6‴)]。经与文献值[12]对照,确定化合物4为齐墩果酸-3-O-[β-D-吡喃葡萄糖基-(1→3)-α-L-吡喃阿拉伯糖基]-28-O-β-D-吡喃葡萄糖基酯苷{oleanolic acid 3-O-[β-D-glucopyranosyl-(1→3)-α-L-arabinopyranosyl]-28-O-β-D-glucopyranosyl ester}。
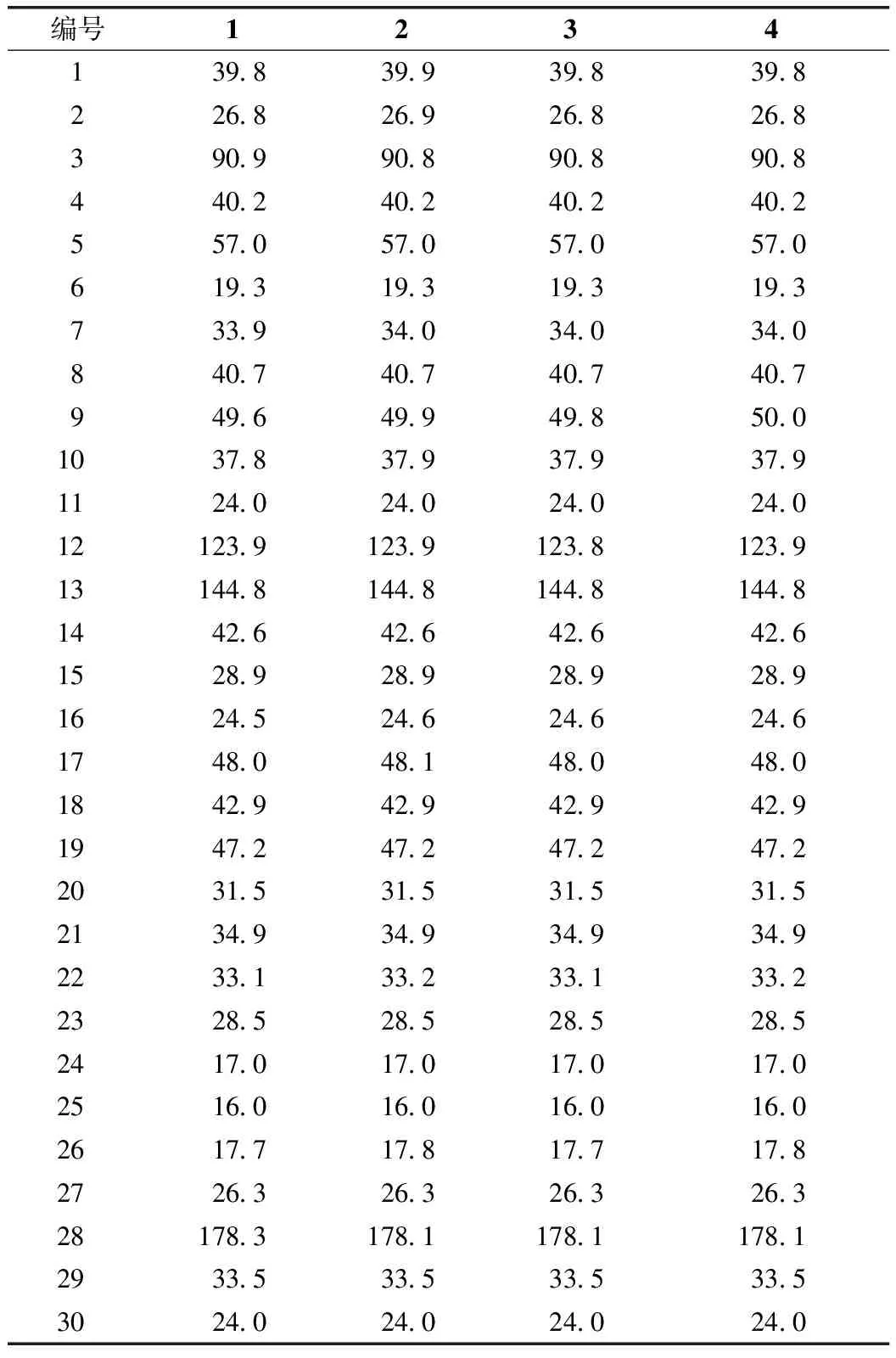
表1 化合物1~4中皂苷元的13C-NMR数据(CD3OD,100MHz,δC)
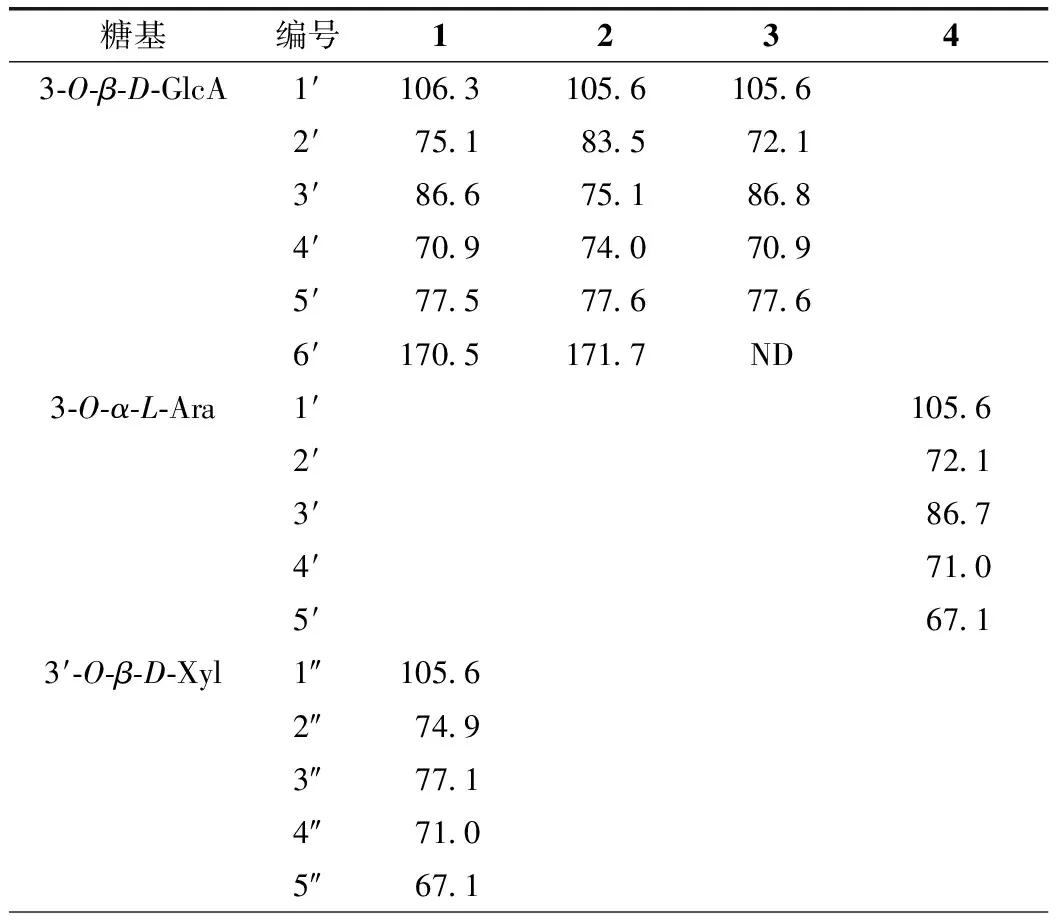
表2 化合物1~4中单糖基的13C-NMR数据(CD3OD,100MHz,δC)

续表2
4 结论
在对沙蓬地上部分的化学成分研究过程中,从沙蓬地上部分乙醇提取物中分离得到了4个齐墩果烷型三萜皂苷类化合物,其中化合物2和3为从藜科(Chenopodiaceae)植物首次分离得到,4为首次从沙蓬属(Agriophyllum)植物中分离得到。
[1] 内蒙古植物志编辑委员会.内蒙古植物志[M].第二版.
第二卷.呼和浩特:内蒙古人民出版社,1998:277.
[2] 内蒙古植物志编辑委员会.内蒙古植物药志[M].第一卷.呼和浩特:内蒙古人民出版社,2000:299.
[3] 国家中医药管理局中华本草编委会.中华本草[M].蒙药分卷.上海:上海科学技术出版社,2000:236.
[4] 李宝媛,战凯璇,周雨华,等.沙蓬黄酮类和香豆素类化学成分的分离与鉴定[J].沈阳药科大学学报,2012,29(12):923-926.
[5] 周雨华,战凯璇,龚邦,等.沙蓬化学成分的分离与鉴定(Ⅱ)[J].沈阳药科大学学报,2012,29(10):753-757.
[6] 龚邦,战凯璇,周雨华,等.沙蓬化学成分的分离与鉴定(Ⅰ)[J].中国现代中药,2012,14(10):7-11.
[7] 于德泉,杨峻山.分析化学手册核磁共振波谱分析[M].北京:化学工业出版社,1999:838.
[8] 汪豪,范春林,王蓓,等.中药地肤子的三萜和皂苷成分研究[J].中国天然药物,2003,1(3):134-136.
[9] Masayuki Y,Yue D,Hiromi S,et al.Studies on Kochiae Fructus.II.on the saponin constituents from the fruit of chineseKochiascoparia(Chenopodiaceae):chemical ctructures of kochianosides Ⅰ,Ⅱ,Ⅲ,and Ⅳ[J].Chem Pharm Bull,1997,45(6):1052.
[10] Chun Liang,Yan Ding,Huu Tung Nguyen,et al.Oleanane-type triterpenoids from Panax stipuleanatus and their anticancer activities[J].Bioorganic & Medicinal Chemistry Letters,2010,20:7110-7115.
[11] Luca Rastrelli,Francesco De Simone,Oreste Schettino,et al.Constituents of Chenopodium pallidicaule(Canihua)Seeds:Isolation and Characterization of New Triterpene Saponins[J].J Agric Food Chem,1996,44:3528-3533.
[12] Irene Dini,Oreste Schettino,Tiziana Simioli,et al.Studies on the Constituents of Chenopodium quinoa Seeds:Isolation and Characterization of New Triterpene Saponins[J].J Agric Food Chem,2001,49:741-746.
TriterpeneSaponinsfromtheAerialPartsofAgriophyllumsquarrosum
LIU Zi-chun,LI Ying-hua,QU Jun-ye,LI Yu-shan*
(SchoolofTraditionalChineseMateriaMedica,ShenyangPharmaceuticalUniversity,Shenyang110016,China)
Objective:To study triterpene saponins constituents fromAgriophyllumsquarrosum(L.)Moq.Methods:The chemical constituents were isolated by means of various chromatographic methods such as macro porous resin column chromatography,silica gel column chromatography and HPLC chromatography.Chemical characters and spectroscopic analysis,including1H-NMR and13C-NMR spectra,were employed for the structural identification.Results:Four compounds were isolated from then-BuOH extract of the aerial parts ofA.squarrosum,and their structures were identified as momordin Ⅱc(1)、pseudoginsenoside RT1(2)、oleanolic acid 3-O-[α-L-arabinopyranosyl-(1→3)-β-D-glucuronopyranosyl]-28-O-β-D-glucopyranoside(3)、oleanolic acid 3-O-[β-D-glucopyranosyl-(1→3)-α-L-arabinopyranosyl]-28-O-β-D-glucopyranoside(4).Conclusion:Compounds2and3were isolated from the family Chenopodiaceae for the first time,and Compound4was isolated from the genusAgriophyllumfor the first time.
Agriophyllumsquarrosum;Chemical constituents;Olean-type saponins
2013-05-29)
*
李玉山,教授,博士,主要从事生药学研究工作,Tel:(024)23986496,E-mail:lyshan888@126.com

