干燥方法与采收期对黄芩花中黄酮类化学成分的影响△
肖苏萍,何春年,曾燕*,田壮,赵润怀,王继永,宋国虎,韩志斌,杜越娟,田东凤
(1.中国药材公司,北京 100195;2.中国药材集团 承德药材有限责任公司,河北 承德 067000;3.中国医学科学院 北京协和医学院 药用植物研究所,北京 100193;4.国家教育部中草药物质基础与资源利用重点实验室,北京 100193)
干燥方法与采收期对黄芩花中黄酮类化学成分的影响△
肖苏萍1,何春年3,4,曾燕1*,田壮1,赵润怀1,王继永1,宋国虎2,韩志斌2,杜越娟2,田东凤2
(1.中国药材公司,北京 100195;2.中国药材集团 承德药材有限责任公司,河北 承德 067000;3.中国医学科学院 北京协和医学院 药用植物研究所,北京 100193;4.国家教育部中草药物质基础与资源利用重点实验室,北京 100193)
目的:考察不同干燥方法对黄芩花中黄酮类化学成分的影响。同时采用自然晒干法,考察采样时间对黄芩花中黄酮类化学成分的影响。方法:采集完全开放的黄芩花,分别采用阴干、烘干、晒干、真空干燥和微波干燥五种不同的干燥方法进行干燥,比色法分析花中总黄酮含量,HPLC法分析黄芩苷、黄芩素、汉黄芩苷、汉黄芩素、野黄芩苷、白杨素7-O-β-D-葡萄糖醛酸苷和芹菜素七种成分的含量。于七月中旬到八月下旬,每周采集完全开放的黄芩花,同时收集自然脱落的黄芩花,观察相关黄酮类化学成分的动态变化。结果:不同干燥方法对黄芩花中不同黄酮类成分影响有一定的差异。其中微波干燥法利于保留总黄酮、野黄芩苷和黄芩苷,阴干法利于保留芹菜素,真空干燥法利于保留黄芩素。干燥方法的差异对白杨素7-O-β-D-葡萄糖醛酸苷的影响不大;采收时间对黄芩花中黄酮化学成分有一定的影响。其中总黄酮、野黄芩苷和芹菜素在七月底八月初均出现了峰值,白杨素7-O-β-D-葡萄糖醛酸苷在第一次采样点含量最高,之后急剧下降进入平稳期。黄芩苷和黄芩素含量在整个采集期内含量均比较稳定。与直接采摘的黄芩花相比,自然脱落的紫花和白花中总黄酮、黄芩苷、白杨素7-O-β-D-葡萄糖醛酸苷、芹菜素和黄芩素含量均较低。汉黄芩苷和汉黄芩素在所有实验中未检出到。结论:微波干燥法对于保存黄芩花中的药效成分效果较其他方法好,自然晒干法比较方便和经济。在黄芩盛花期的7月底到8月初集中采集完全开放的黄芩花,其质量佳,成本低。
黄芩花;干燥方法;采收期;黄酮成分
黄芩(ScutellariabaicalensisGeorgi)为唇形科多年生草本药用植物,以干燥根入药[1],为常用大宗中药材之一,始载于《神农本草经》,列为中品。临床应用已有两千多年的历史,近代药理研究证明有抗炎解热、降压、利尿及抑制流感病毒等作用[2]。黄芩药材主要产于华北、东北、西北等地区,历史上以河北承德为黄芩的道地产区,产品条大整齐、质地坚实、色泽纯正、品质好、疗效显著而驰名中外,素有“热河黄芩”之美称[3]。黄芩商品药材过去主要来源于野生,随着应用范围的扩大和需求量的增加,野生资源急剧下降,人工栽培黄芩已成为我国商品药材的主要来源[4-5]。
承德地区黄芩花现蕾时间一般在七月初,七月中下旬进入盛花期,八月初开始结果。花期花一般不做产品销售,黄芩的根部作为常用中药材已有大量的研究,地上部分的茎和叶也有一些报道[6],但黄芩花的研究至今尚未见系统研究,其主要成分尚不清楚,故黄芩栽培的药农一般不采收黄芩花。为了提高黄芩的综合利用价值,我们拟通过实验分析黄芩花的化学成分,考虑到黄芩根部和茎叶的主要成分均为黄酮类成分,因此本文以黄芩中主要黄酮类成分为测定对象,明确黄芩花黄酮类成分的主要种类和含量,推测其可能具有的一些疗效和保健功能,从而为进一步开发黄芩花系列产品提供依据,为提高黄芩药材综合利用价值,增加药农收益,推动黄芩产业提供支持。基于此目的,我们开展了不同干燥方法对黄芩花中的黄酮类成分的含量影响,同时考察了黄芩花在整个花期过程其黄酮类化学成分动态变化情况。通过以上研究,明确黄芩花的主要黄酮类化学成分,同时建立合适的采收时间和加工方法,为黄芩花的开发利用提供基础数据。
1 材料与方法
1.1 试验材料
黄芩花采自承德市围场县黄土坎乡黄土坎村黄芩GAP基地的二年生黄芩,经中国药材集团承德药材有限责任公司张学文教授鉴定为黄芩(ScutellariabaicalensisGeorgi)的花。
于2012年7月24日黄芩盛花期采集黄芩紫色花,用于不同干燥方法对黄芩花黄酮类化学生产的影响研究。于7月14日至8月23日,每周收集一次完全开放的成熟的黄芩紫色花,用于研究采收期对黄芩花中黄酮类化学成分的影响研究。
1.2 仪器与试药
DGG-9070型电热恒温鼓风干燥箱(上海森信实验仪器有限公司),DZF-6020型真空干燥箱(上海精宏实验设备有限公司),WD700G型微波炉(格兰仕集团),UV-2550型紫外分光光度计(日本岛津公司),Agilent 1200 高效液相色谱仪(G1322A 型在线脱气机、G1311A 型液相泵、G1329A 自动进样器、G1316A 柱温箱、G1315B 型DAD 检测器、Agilent 色谱工作站);梅特勒-托利多电子天平(AL204);ULVAC 薄膜真空泵(DTC-21);C9860A超声波清洗器(上海杰恩普超声设备有限公司)。
野黄芩苷(1)、黄芩苷(2)、白杨素7-O-β-D-葡萄糖醛酸甙(3)、汉黄芩苷(4)、芹菜素(5)、黄芩素(6)和汉黄芩素(7)对照品(购于中国药品生物制品检定所)。甲醇、乙腈为色谱纯(Fisher Scientific);甲酸(CNW公司,德国);纯净水(杭州娃哈哈集团);其余试剂均为分析纯。
1.3 实验方法
1.3.1 采花方法 采集黄芩花时不将花萼及叶片一同摘下,只采集花冠部分,包括雄蕊和雌蕊。
1.3.2 干燥方法 取鲜黄芩花5份,每份精密称量70 g,摊开,分别进行自然晾晒、室内通风阴干、烘箱鼓风干燥、真空干燥和微波干燥。干燥指标:不同干燥方式均达到花瓣质硬而脆,相互之间重量差异在1 g以内。将样品用粉碎机粉碎,过60目筛,备用。
自然晒干:将鲜黄芩花置室外自然晾晒。
自然阴干:将鲜黄芩花置室内阴凉通风处自然阴干。
烘箱干燥:根据相关文献报道[7],选择60 ℃作为干燥温度,同时为了加快干燥效率,采用鼓风干燥。
真空干燥:为了与烘干方法对比,也选择60 ℃作为干燥温度,减压真空干燥,当见水蒸汽较多时打开擦干,然后再继续减压干燥。
微波干燥:将鲜黄芩花置于微波炉内,于700 W下干燥3 min,每1 min取出翻动,以释放热量。
1.3.3 总黄酮含量测定方法
1.3.3.1 测定方法 参照作者前期对黄芩叶的研究方法[7]。
1.3.3.2 供试品溶液的制备 取干燥的黄芩花样品,粉碎、过60目筛,精密称取粉末约0.5克,加入50 mL 70%乙醇,精密称定,超声提取30 min,放置室温,精密称定,用70%乙醇补足减少的重量,0.45 μm滤膜过滤,作为供试品溶液。
1.3.3.3 重复性试验 取同一份样品(微波干燥)6份,按供试品溶液制备方法制备,按上述测定方法测定样品中总黄酮含量,得RSD值为:2.35%。表明此方法的重复性良好。
1.3.3.4 加样回收率试验 取已知含量的黄芩花样品6份,精密称定,每份约0.5 g,分别加入野黄芩苷对照品溶液适量,按照上述制备供试品溶液制备方法进行制备,测定吸收度,计算平均加样回收率为98.41%,RSD为2.87%。
1.3.3.5 样品测定 分别精密称取5种干燥方法样品约0.5 g,按照供试品溶液制备方法进行制备,取样品溶液200 mL,加5%的AlCl3溶液5 mL,用70%乙醇定容到10 mL刻度,摇匀,室温放置40 min,299 nm处测定总黄酮。结果见表1和表2。
1.3.4 主要黄酮类成分的含量测定方法
1.3.4.1 测定方法 参照作者前期对黄芩叶的研究方法[7]。7种黄酮化合物对照品色谱图见图1。
1.3.4.2 供试品溶液的制备 同“1.3.3.2”项下进行。

图1 7个对照品的液相色谱图1.野黄芩苷 2.黄芩苷 3.白杨素7-O-β-D-葡萄糖醛酸甙 4.汉黄芩苷 5.芹菜素 6.黄芩素 7.汉黄芩素

图2 不同干燥方法的黄芩花色谱图
1.3.4.3 重复性试验 取“1.3.4.2”项下的供试品溶液,按上述色谱条件测定各对照品的含量,RSD值分别为:0.58%(1)、1.27%(2)、1.05%(3)、1.93%(5)和1.89%(6),汉黄芩苷(4)和汉黄芩素(7)因未检出,故没有计算RSD值。表明此方法的重复性良好。
1.3.4.4 加样回收率试验 精密称取已知含量的黄芩花样品6份,每份约0.5 g。分别加入适量的6种对照品溶液。按供试品溶液制备方法进行,依上述色谱条件测定,计算回收率和RSD值:99.12%(1,1.07%)、98.36%(2,1.27%)、98.17%(3)、100.84%(4,2.33%)、98.81%(5,2.01%)、98.07%(6,1.73%)和103.44%(7,2.71%)。
1.3.4.5 样品含量测定 分别精密称取5种干燥方法样品约0.5 g,按照“1.3.3.2”项下供试品溶液的制备方法进行处理。测定样品中7种黄酮成分的含量,结果见表1和表2,不同干燥方法的样品色谱图见图2。
2 结果与分析
2.1 不同干燥方法对黄芩花中黄酮成分的影响
2.1.1 干燥方法对总黄酮的影响 由图1可见,不同干燥方法对黄芩花中总黄酮含量影响不一样,微波干燥法中黄芩花中总黄酮含量最高,真空干燥中黄酮含量最低,两者之间存在显著差异。不同干燥方法黄芩花中黄酮含量高低趋势为:微波>烘干>晒干>阴干>真空。
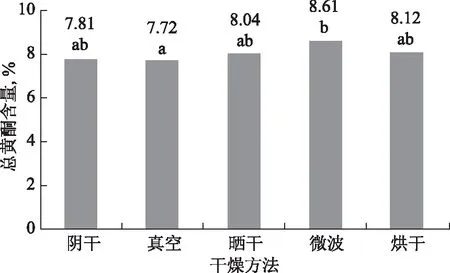
图3 不同干燥方法对黄芩花总黄酮含量的影响(n=3,p<0.05)
2.1.2 干燥方法对黄酮类化学成分的影响 由图4可见,不同干燥方法对黄芩花中不同的黄酮类化学成分影响有一定的差异。其中,

图4 a,b 干燥方法对黄芩花中黄酮类化学成分的影响(n=3,p<0.05)
野黄芩苷含量显示,微波干燥法含量显著高于阴干和真空干燥,其他干燥法之间差异不显著。含量高低趋势为:微波>晒干>烘干>阴干>真空。
白杨素7-O-β-D-葡萄糖醛酸甙含量显示,所有干燥方法下其含量均没有显著性差异。含量高低趋势为:烘干>微波>晒干>阴干>真空。
黄芩苷含量显示,微波干燥含量显著高于其他方法。含量高低趋势为:微波>烘干>晒干>阴干>真空。
芹菜素含量显示,不同加工方法对其含量影响较大,其中阴干法含量最高,其次是真空和晒干法,微波和烘干法含量最低。含量高低趋势为:阴干>晒干>真空>烘干>微波。
黄芩素含量显示,真空干燥含量最高,其次是阴干和晒干,微波和烘干含量最低。含量高低趋势为:真空>阴干=晒干>烘干=微波。
汉黄芩苷和汉黄芩素在所有的干燥方法中均为检测出。
2.2 采收时间对黄芩花中黄酮成分的影响
2.2.1 采收时间对总黄酮的影响 黄芩一般在7月初为花蕾期,然后花陆续开放,到7月下旬开始进入盛花期,7月底8月初花开的最多。从图5中可见,花中的总黄酮含量由始花期到盛花期,然后进去逐渐进入果期的过程中,出现了先下降,后上升,再下降,而后又小幅上升到现象。从整个花期来看,总黄酮含量在7月底8月初出现了个波峰,7月20日和8月10日左右是两个波谷期。

图5 不同采收时间黄芩花中总黄酮的含量
2.2.2 采收时间对黄酮类化学成分的影响 由图6可知,随着采样顺序,野黄芩苷开始时含量逐渐增加,在第四次采样点即8月2日含量达到波峰,而后出现下降的趋势。黄芩苷含量在整个采集期内含量均比较稳定,在3.11~4.32 mg·g-1之间波动。白杨素7-O-β-D-葡萄糖醛酸甙在第一次采样点7月14日含量最高达到了22.94 mg·g-1,之后急剧下降进入平稳期,在14.68~16.19之间波动。芹菜素含量一直波动非常大,在7月20日和8月17日出现了连个波峰,含量分别达到了1.23 mg·g-1和1.39 mg·g-1,比8月22日采样含量高出了五六倍。采样后期似乎进入一个高含量的平台期。黄芩素含量出现了两遍波峰中间较长一段时间处于比较稳定的波谷期。两个波峰期含量分别达到了0.16 mg·g-1和0.17 mg·g-1,其他时间在0.6~0.8之间小幅波动,基本没有变化。

图6 不同采收时间黄芩花中黄酮类化学成分的含量
汉黄芩苷和汉黄芩素在实验中未检出到。
2.3 自然脱落的白花和紫花黄酮类成分分析
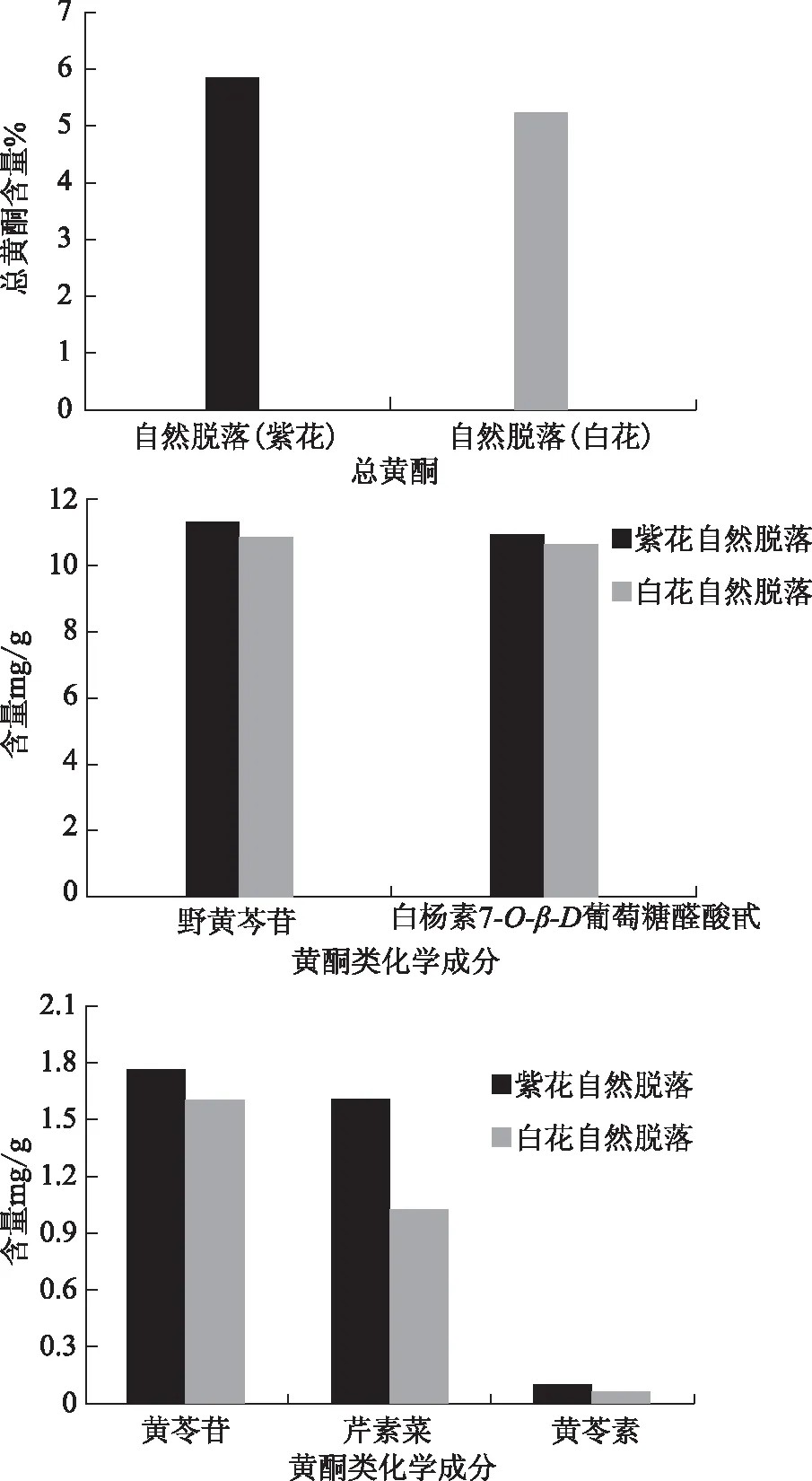
图7a、b和c 自然脱落的白花和紫花中黄酮类化学成分含量
由图7可见,自然脱落的黄芩紫花中总黄酮含量和其他各种黄酮类化合物成分含量均比白花高。其中总黄酮含量高出11.71%,野黄酮苷高出4.47%,白杨素7-O-β-D-葡萄糖醛酸甙3.22%,黄芩苷高出10.69%,芹菜素高出56.86%,黄芩素高出50%。
由于自然脱落的紫花和白花是在同一区域采集的一大批,没有分区域分别采集,所以没有做显著性差异分析,只是测定了平均值。同时,在此实验中也没有检测到汉黄芩苷和汉黄芩素。
3 结论与讨论
根据本实验结果发现,黄芩花与黄芩其他部位(茎、叶和根)同样主要含有黄酮类成分[6],但不同成分之间的相对含量差别较大,在根中含量较高的黄芩苷和黄芩素,在花以及茎叶中含量较低,汉黄芩苷和汉黄芩素在花中含量未检测到,可能是含量太低的原因。黄芩花中的黄酮主要为野黄芩苷和白杨素7-O-β-D-葡萄糖醛酸苷。
本研究通过采用阴干、烘干、晒干、真空干燥和微波干燥5种不同的干燥方法干燥进行干燥,同时采用动态采集黄芩花的方法,观察花中总黄酮、黄芩苷、黄芩素、汉黄芩苷、汉黄芩素、野黄芩苷、白杨素7-O-β-D-葡萄糖醛酸甙和芹菜素八种成分的变化,分析干燥方法和采样时间对黄芩花药效成分的影响。得出以下结论:
3.1 干燥方法对黄芩花的影响
不同干燥方法对黄芩花中黄酮成分含量影响不同,微波干燥法黄芩花中总黄酮含量最高,真空干燥法黄酮含量最低,两者之间存在显著差异。不同干燥方法对黄芩花中不同的黄酮类化学成分影响有一定的差异。其中,野黄芩苷和黄芩苷含量显示,微波干燥法含量显著高于阴干和真空干燥。白杨素7-O-β-D-葡萄糖醛酸苷含量显示,所有干燥方法下其含量均没有显著性差异。芹菜素含量显示,阴干法含量最高,其次是真空和晒干法,微波和烘干法含量最低。黄芩素含量显示,真空干燥含量最高,其次是阴干和晒干,微波和烘干含量最低。汉黄芩苷和汉黄芩素在所有的干燥方法中均为检测出。
3.2 采收期对黄芩花的影响
黄芩由始花期到盛花期,及逐渐进入果期的过程中,总黄酮和野黄芩苷在7月底8月初均出现了一个小波峰。黄芩苷含量在整个采集期内含量均比较稳定。白杨素7-O-β-D-葡萄糖醛酸甙在第一次采样点含量最高,之后急剧下降进入平稳期。芹菜素含量一直波动非常大,其中出现了两次波峰期,高峰期比低峰期高出了5倍多。汉黄芩苷和汉黄芩素在实验中未检出到。
3.3 自然脱落的黄芩花中化学成分变化
与直接采摘的成熟黄芩花相比,除紫花中的芹菜素含量较高之外,自然脱落的紫花和白花中总黄酮、黄芩苷、白杨素7-O-β-D-葡萄糖醛酸甙、芹菜素和黄芩素含量均较低。提示:自然脱落的黄芩花的治疗或保健功能较低,开发黄芩茶保健所用材料宜直接采集完全开放的黄芩花。
3.4 综合考虑原料质量和成本,选择合适的产地采收加工方法
无论何种加工方法,都应综合各个因素,从加工效果、效率、成本等方面全盘考虑。不同加工方法对药材的品质影响不同,并不是加工方法越先进越好,加工的便捷性和成本是产地加工最重要的因素[8]。本研究通过实验发现,微波干燥法对于保存黄芩花中的药效成分(如总黄酮、黄芩苷和野黄芩苷)效果较其他方法好,但考虑到产地加工过程中的实际情况,自然晒干法比较方便和经济。在黄芩花的采集时间上,除了要考虑到药效成分含量的高低,同时还应考虑到采集的难度和采集成本。如在盛花期的7月底到8月初,此时总黄酮含量处于波峰期,黄芩苷、野黄芩苷等主要指标性成分含量也相对较高,且此时花集中开放,减少采集次数,所以在这个时间段集中采集黄芩花较为合理。
黄芩花作为黄芩药材综合开发利用的重要组成部分,其研究一直处于空白。过去,种植黄芩主要取其根部,地上部分没有得到充分利用。现在,黄芩茎叶也开发出了相关产品,本文对黄芩花的基础研究,为充分利用黄芩植物资源奠定了基础。
[1] 国家药典委员会编.中国药典[S].北京:中国医药科技出版社,2010:282.
[2] 张建春,张华,施瑛,等.黄芩苷的研究近况[J].时珍国医国药,2005,16(3):247-249.
[3] 中国药材公司.中国药材资源地图集[M].北京:科学出版社,1995:39.
[4] 杨 全,白音,陈千良,等.黄芩资源现状及可持续利用的研究[J].时珍国医国药,2006,17(7):1159-1160.
[5] 陈君,杨世林,程惠珍.不同种源黄芩生长发育特性初步观察[J].中药材,2002,25(11):777-778.
[6] 何春年,彭勇,肖伟,等.黄芩地上部分与根部的化学成分比较研究[J].中国现代中药,2011,13(12):32-35.
[7] 何春年,肖苏萍,曾燕,等.不同干燥方法对黄芩叶中黄酮类成分的影响研究[J].中国现代中药,2012,14(12):
[8] 赵润怀,曾燕,肖苏萍,周海燕.中药材产地加工现代干燥技术的应用及中药材产地加工方法的科学评价和选择[J].中国现代中药,2012,14(12):
EffectsofDifferentDryingMethodsandHarvestingTimeonContentofFlavonoidsfromFlowersofScutellariabaicalensis
XIAO Su-ping1,HE Chun-nian3,4,ZENG Yan1*,TIAN Zhuang1,ZHAO Run-huai1,WANG Ji-yong1,SONG Guo-hu2,HANG Zhi-bing2,DU Yue-juan2,TIAN Dong-feng2
(1.ChinaNationalCorp.ofTraditional&HerbalMedicine;Beijing100195,China;2.ChengdePharmaceuticalCo.,Ltd.AffiliatedtoChinaNationalGroupCorp.ofTraditional&HerbalMedicine,ChengdeHebei067000,China;3.InstituteofMedicinalPlantDevelopment,ChineseAcademyofMedicalScience,PekingUnionMedicalCollege,Beijing100193,China;4.KeyLaboratoryofBioactiveSubstancesandResourcesUtilizationofChineseHerbalMedicine,MinistryofEducation,Beijing100193,China)
Objective:To compare the effect of different drying methods on the content of flavonoids from flowers ofScutellariabaicalensis,and study the effect of harvesting time on the flavonoids components.Methods:Harvesting the fully expanded flowers ofScutellariabaicalensison the late July in full-bloom stage,and drying the material using the methods of shade drying,baking,drying in the sun,vacuum drying and microwave drying.Analyze the total flavonoids content using colorimetric method.Analyze the content of baicalin,baicalein,wogonin-7-glucuronide,wogonin,scutellarin,chrysin and apigenin using HPLC respectively.Collecting the flowers during middle July and late August,and collecting the flowers of fall off naturally at the late August,study the dynamic change of the flavonoids.Results:Effects of different drying methods on the content of flavonoids were different.The content of total flavonoids,scutellarin and baicalin was higher using the method of microwave drying than others,the apigenin content was higher using shade drying method and the baicalein was higher using vacuum drying method than others.The different drying methods had no effect on the chrysin.The collecting time had some effect on different flavonoids.The contents of total flavonoids,scutellarin and apigenin had the peak value during the late of July and the beginning of August.The chrysin had showen the highest content at the first collecting time,and then reached a plateau with a sharp decreasing.The content of baicalin and baicalein was relatively stable during whole collecting time.The content of total flavonoids,baicalin,scutellarin,apigenin and baicalein of the purple and white flowers falling off naturally was relative lower than the harvest material.The wogonin-7-glucuronide and wogonin did not been detected during all the experiments.Conclusion:The method of microwave drying was superior to other methods as the drying method to keep the active ingredients of flavonoids,but the method of drying in the sun was relative more convenient and adaptive as the processing technology.The quality of flower is good when the flower was collected during the late of July and the beginning of August,and also was low-cost relatively.
Flowers ofScutellariabaicalensis;Drying methods;Collecting time;Flavonoids
2013-03-23)
工业和信息化部消费品工业司中药材生产扶持项目——中药材产地加工技术平台建设[工信部消费(2011)340];国家中医药管理局中医药行业科研专项——20种道地药材特色栽培及加工技术整理、规范及应用(201107009)
*
曾燕,博士,研究方向:中药资源与中药材生产加工,Tel:(010)61252980,E-mail:zyzy1221@126.com

