粉煤灰中三氧化硫的检测分析
李瑞敏,武 丽,黄 侃
(1.河北建研科技有限公司,石家庄市050021;2.藁城市廉州建筑工程公司,藁城市052160)
目前,随着环保意识的增强,普通粉煤灰、高钙灰、高钙高硫灰等各种形式的粉煤灰已被广泛应用于建材、建筑工程。粉煤灰中三氧化硫主要以硫酸钙形式存在,掺入混凝土后,有的会生成水化硫铝酸钙晶体,由于晶体含有大量结晶水,使水泥体积增大,造成混凝土开裂。三氧化硫含量是危害工程质量的成分,为保证混凝土工程的建设质量,《用于水泥和混凝土中的粉煤灰》GB/T1596-2005强制要求三氧化硫含量小于3%,因此在选用粉煤灰前必需检测三氧化硫含量是否达标具有重要作用。
1 检测方法原理
在酸性溶液中,用氯化钡溶液沉淀硫酸盐,沉淀经过滤、洗涤和灼烧后,以硫酸钡形式称量。从而求得SO3或SO42-离子含量,测定结果以三氧化硫计。
2 仪器设备和试剂
仪器:高温炉、坩埚、坩埚钳、定量滤纸、电炉
试剂:盐酸溶液:1:1(体积比)
硝酸银溶液:1%(质量与体积之比)为克服硝酸银在水中发生水解和预防硝酸银见光分解,须将1g硝酸银溶解在适量水中,而后加入10mL浓硝酸,再稀释至100mL,并储存在棕色瓶中。
3 分析步骤
(1)称取约0.5g试样m1(精确至0.0001g),置于200mL烧杯中,加入约40mL蒸馏水,搅拌使试样完全分散,在搅拌下加入10mL盐酸溶液(1+1),用平头玻璃棒压碎块状物,在电炉上加热微沸(5±0.5)min,取下冷却,用中速定量滤纸过滤,用热水洗涤10~12次,滤液及洗液收集于400mL烧杯中。加水稀释至约250mL。
(2)滤液于电炉上加热,微沸时,从杯口缓慢逐滴加入10mL热的氯化钡溶液,继续微沸3min以上使沉淀良好地形成,然后在常温下静置12h~24h或温热处静置至少4h(仲裁分析应在常温下静置12h~24h),此时溶液体积应保持在约200mL。
(3)进行第二次过滤,用慢速定量滤纸过滤,以温水洗涤,洗至检验无氯离子为止(即无白色沉淀,用1%的硝酸银溶液检验)。
(4)将沉淀及滤纸一并移入已灼烧恒量的瓷坩埚中,于电炉上灰化完全后,放入800℃ ~950℃的高温炉内灼烧30min,取出坩埚,置于干燥器中冷却至室温,称量。反复灼烧,直至恒量。
(5)结果计算见式(1):
场地无全新活动断裂、地裂缝及滑坡等不良地质作用存在,场地覆盖层厚度大于60 m,可忽略发震断裂地面错动的不利影响。场区土层分布连续,厚度及高差变化较小,均匀性较好,承载力及工程性质较好,不会产生较大的差异性沉降,无液化及软弱土层存在,综合评价为稳定地基。

式中:ωSO3-三氧化硫的质量分数,%;m2-灼烧后沉淀的质量,g;m1-试样的质量,g;0.343-硫酸钡对三氧化硫的换算系数。
4 试验过程注意事项
1.1 测定条件
(1)除去酸不溶物 由于粉煤灰试样中含有SiO2,用盐酸溶解试样时SiO2可能部分成硅酸凝胶析出影响测定,因此试样分解后,用中速定量滤纸过滤除去酸不溶物。
(2)最好控制溶液酸度在0.25~0.3mol/L
①在这种酸度下进行沉淀,可防止生成BaCO3、Ba(PO4)2、BaHPO4、Ba(OH)2等沉淀。
②增加BaSO4的溶解度,以降低相对过饱和度,有利于生成大颗粒沉淀。
③在该酸度下的盐酸溶液中Fe3+、Al3+等离子不会生成沉淀。
④克服了因Ca2+存在而产生的共沉淀现象。
(3)晶形沉淀条件 硫酸钡沉淀为晶形沉淀,硫酸钡结晶初生成时比较细小,应按照晶形沉淀条件进行(稀、热、搅、慢、陈),以便获得相对大的晶形沉淀,便于过滤和洗涤。
(4)沉淀在灼烧前应将滤纸充分灰化 沉淀在灼烧前如果滤纸未灰化完全,仍有未燃烧尽的炭粒存在,灼烧时BaSO4可能被部分还原为 BaS,使结果偏低(BaSO4+2C=BaS+2CO2↑)。
(5)灼烧硫酸钡的温度 应控制在800℃ ~950℃的温度下灼烧,若温度过高(如1000℃以上)BaSO4将分解,影响测定,其反应为BaSO4=BaO+SO3↑。
1.2 测试样品时应注意的问题
(1)称取粉煤灰试样前,应将试样放入干燥的烧杯中并搅匀,使所称取的样品具有代表性。
(2)分解试样时,向试样中加入盐酸前,应将试样用玻璃棒搅散,加入盐酸后要仔细搅拌,不得有大块试样存在,以便使试样充分溶解。
(3)第一次过滤,采用定量中速滤纸,用四折法折叠滤纸,滤纸应紧贴在漏斗壁上,可用手指轻轻压紧滤纸,排除滤纸和漏斗之间的气泡使接触密实。
(4)洗涤时,第1次洗液滤完后,再进行第2次洗涤;第2次洗液滤完后,再进行第3次洗涤……约洗涤10~12次(洗涤需采用80~90℃左右或已煮沸的蒸馏水)。
(5)BaSO4是晶形沉淀,为了获得较纯净的BaSO4沉淀,滴加 BaCl2溶液时应缓慢加入,切不可将10mLBaCl2溶液一次全倒入试验溶液中,否则结果偏高;且应不断搅拌,以防止因试验溶液中氯化钡局部过浓而生成过多的晶核。另外,沉淀过程应当在热溶液中进行,即将溶液煮沸,最好BaCl2溶液也加热后使用(因为在热溶液中BaSO4的溶解度略有增大,从而降低了溶液的相对过饱和度;同时在热溶液中还可减少BaSO4沉淀对杂质的吸附作用)。
(6)沉淀后不应立即过滤,应对沉淀进行"陈化"处理,即将沉淀连同溶液一起在常温处静置12h~24h或温热处静置至少4h。陈化可使小晶体不断溶解,大晶体不断长大。因为小晶体的溶解度比大晶体大,在同一溶液中,对大晶体为饱和溶液时,对小晶体则为未饱和溶液,因此,小晶体就要溶解,溶解到一定程度时,溶液对小晶体为饱和溶液,对大晶体则为过饱和溶液,沉淀就在大晶体上析出,直至饱和为止。此时溶液对小晶体又不饱和了,于是小晶体继续溶解。如此反复进行,小晶体逐渐消失,大晶体不断长大。"陈化"作用不仅使沉淀颗粒长大,而且使沉淀变得更加纯净,因为小晶体吸附和包藏的杂质在陈化过程中被排除到溶液中,大晶体总表面积小,吸附的杂质也就减少。
(7)沉淀经陈化后,需第二次过滤,应选用定量慢速滤纸过滤BaSO4沉淀溶液。因为定量滤纸经过盐酸和氢氟酸处理,蒸馏水洗涤,灼烧后灰分极少,可忽略不计;还应注意所用慢速滤纸的质量,防止沉淀穿滤。从烧杯往滤纸上转移沉淀时一定要转移干净,若有沉淀粘附在烧杯壁上,可用带橡皮管的玻璃棒擦洗烧杯。
(8)用热蒸馏水洗涤沉淀,应坚持"少量多次"的原则,既不能洗涤次数不够,又不能过量洗涤。若洗涤次数少,则会因沉淀不干净而使分析结果偏高;洗涤次数过多,BaSO4沉淀部分溶解,使分析结果偏低。根据经验,一般洗涤7~8次即可,每次洗涤约10mL左右。直至用1%硝酸银溶液检验,无白色AgCl沉淀为止。
(9)将沉淀连同滤纸放入一恒重的坩埚,斜盖上坩埚盖,置于电炉上,用低温烘去水分,待滤纸干燥后再提高温度灰化,使滤纸灰化完全。灰化时特别注意不要使滤纸着火,否则会因气流的强烈流动使沉淀飞失。另外,如果灰化温度过高,部分BaSO4沉淀有可能会被还原成BaS,而使分析结果偏低。
笔者在工作实践中采用同一粉煤灰试样,根据操作过程中的几个关键环节,分别进行试验对比,从而得出分析数据,分析检测结果见表1。
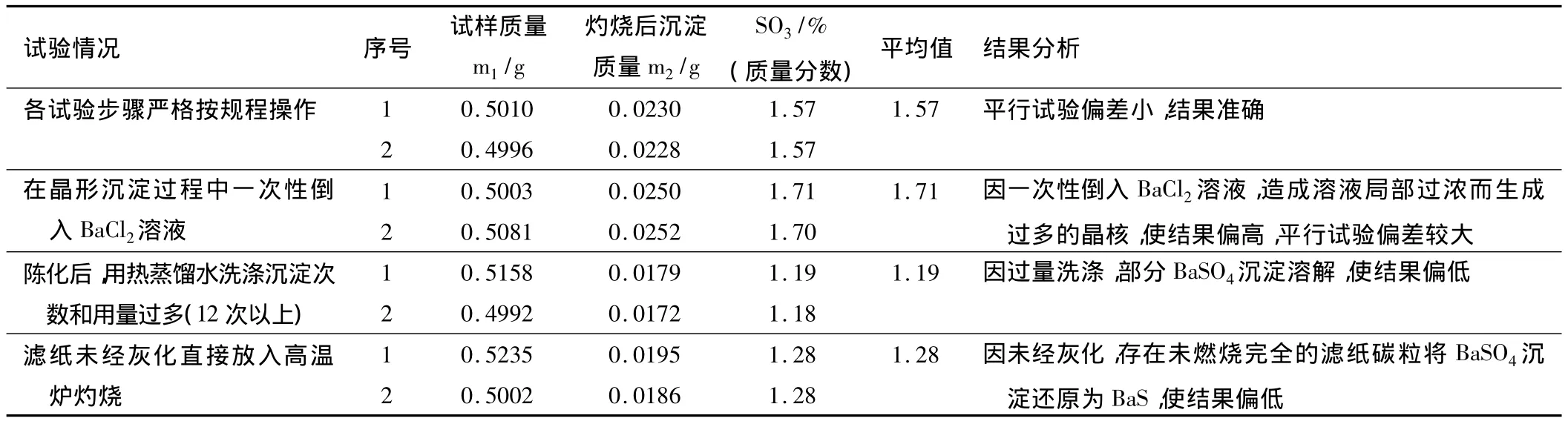
表1 同一试样试验结果分析表
5 结论
在实际操作中,严格按照操作规范并注意关键技术操作环节,才能为保证工程质量的选材提供可靠、准确检测结果。

