老年食管癌患者术后肠内外混合营养支持临床疗效研究
徐洪波,肖 勇
六安市人民医院胸心外科(安徽六安237005)
老年食管癌患者常因肿瘤梗阻导致吞咽困难,影响营养物质摄入;同时老年人胃肠道功能弱,手术前几乎均存在不同程度的营养不良。而老年食管癌患者“能量负债”常是导致术后并发症增多和住院时间延长的重要原因[1-2]。肠内营养由于操作方便、成本低,有利于早期促进胃肠道功能的恢复等优点[3],近些年被广泛应用于食管癌患者的术后营养支持。但全肠内营养由于需较长时间的持续应用等缺点并不完全适用于老年食管癌患者,因此临床上需要一种更为有效的术后营养支持方法。本研究通过收集2008年1月至2011年12月期间167例老年食管癌患者的临床资料,比较肠内外混合营养和全肠内营养两种营养支持的临床疗效,现将结果报告如下。
1 资料与方法
1.1 一般资料 167例老年食管癌患者,其中男108例,女59例;年龄为60~76(平均67.8岁);所有患者术前均有病理明确诊断,均行食管癌根治术。167例老年食管癌患者按照数字随机方法分为两组:肠内外混合营养组85例、全肠内营养组82例,两组患者性别、年龄、体质量等一般资料差异无统计学意义(P>0.05)。
1.2 营养支持方法 两组患者术中均常规放置胃肠减压管及十二指肠营养管,营养管置于屈氏韧带远端20 cm处。所有入组患者按每天热量125.52 kJ/kg 及氮0.2g/kg给予营养支持7d[4]。全肠内营养组术后第1d滴注生理盐水500 ml,如无不良反应,术后第2 d起应用肠内营养输注泵持续滴注,量从500 ml逐渐增至2000 ml,速度根据患者耐受情况,50~150 ml/h,液体不足部分给予5%葡萄糖溶液补充。肠内外混合营养组肠内营养支持方法同上,肠内营养液逐步增加至1000 ml/d,同时进行静脉营养输注补足氨基酸、维生素、微量元素及钾钠等成分。两组肠内营养控制温度在35~40℃。
1.3 观察指标 (1)记录两组患者术后肛门排气时间;(2)并发症:包括腹胀、腹泻等腹部并发症、睡眠障碍、电解质紊乱;(3)观察两组患者术前及术后体重、总蛋白、白蛋白、球蛋白、IgG、IgA、IgM。
1.4 统计学处理 SPSS13.0软件进行统计分析。计量资料比较用t检验,计数资料比较用χ2检验。P<0.05为差异有统计学意义。
2 结果
2.1 两组患者术后1周并发症情况 两组患者术后均未发生死亡等严重并发症,两组患者术后肛门首次排气时间无统计学差异(P>0.05)。全肠内营养组每日平均肠内营养治疗持续时间为16.8 h,而肠内外混合营养组缩短为7.5 h,患者消化道反应(包括恶心呕吐、腹胀腹泻)、电解质紊乱(包括术后出现低钾、低钠血症)、术后睡眠障碍发生率低于全肠内营养组(P<0.05)(见表1)。

表1 两组术后1周内并发症的比较
2.2 两组患者术后1周营养和免疫状况 营养支持前,实验组和对照组的营养及免疫状况差异无统计学意义。经过1周营养支持,全肠内营养组中,营养及免疫指标(IgG除外)与术前比较有所下降,但差异无统计学意义。肠内外混合营养组上述营养及免疫指标较术前均有改善,且高于全肠内营养组(P<0.05)(见表2)。
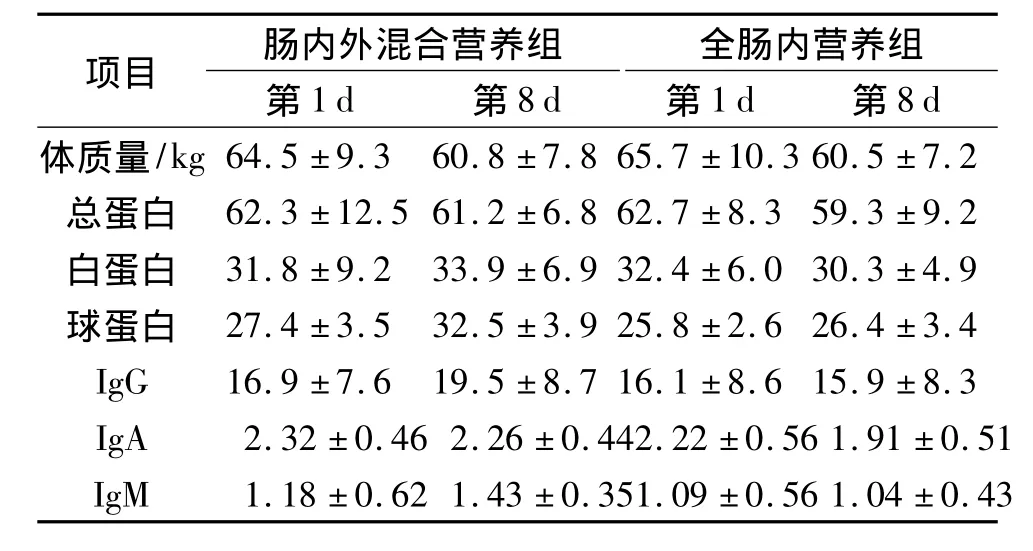
表2 两组术后1周营养及免疫状况差异比较结果
3 讨论
国外研究[5-6]表明术后胃肠道麻痹仅限于胃和结肠,小肠的蠕动和吸收功能在术后几小时内即可得到恢复。而大量营养素的吸收均在小肠内就可完成,这为食管癌患者术后早期肠内营养提供了理论根据。目前肠内营养作为食管癌患者术后重要的营养支持方式已被广泛接受并应用于临床,甚至采用全肠内营养作为食管癌患者术后营养支持的唯一途径。而食管癌好发于老年人,老年患者胃肠道功能较弱,术后恢复相对较慢;同时长期卧床易发生肺炎、栓塞等并发症,在老年食管癌患者术后实际临床营养支持过程中,患者往往容易出现腹胀、腹泻等不适感[7]。因此关于老年食管癌患者是否应把肠内营养作为单一的营养支持途径目前意见并不一致。
有研究结果发现单一的肠内或肠外营养均需要较长时间的持续输注来满足患者术后的营养需要,而本研究结果显示肠内外混合营养组营养支持时间明显较全肠内营养组减少。同时食管癌患者术后出现的睡眠障碍、术后电解质紊乱等并发症,肠内外混合营养组发生率明显低于全肠内营养组;且肠内外混合营养组患者术后免疫功能得到更快恢复。分析原因可能为肠内外混合营养不易受到腹泻等因素导致的电解质紊乱影响;本实验入组患者均为老年患者,术前睡眠障碍普遍存在,术后较长时间甚至夜间仍需输注,严重影响患者的睡眠质量;同时长时间的输注使患者长时间卧床,而术后深静脉血栓形成、甚至肺栓塞与术后长期卧床密切相关;患者术后免疫指标需要得到较快恢复,而肿瘤的发生、发展与患者的免疫状态有着紧密联系,为患者术后放化疗等综合治疗提供可能。
综上所述,老年食管癌患者术后肠内外混合营养作为一种更为有效的营养支持手段,在充分改善患者的营养状态[8]的同时有效的缩短了患者的营养支持时间,改善了患者术后较为常见的睡眠障碍,免疫功能得到较快恢复,有效预防患者术后发生深静脉血栓形成,使得患者术后得到快速康复。但需要注意的是,在实际应用中肠内外混合营养的时候也需遵循从少到多、从慢到快、从稀到浓的方式[9]。总之,肠内外混合营养支持作为一种对老年食管癌患者更为理想的营养支持方法将更广泛应用于临床。
[1] Scurlock C,Mechanick J I.Early nutrition support in the intensive care unit:a US perspective[J].Curr Opin Clin Metab Care,2008,11(2):152-155.
[2] Kreymann KG.Early nutrition support in critical care:a European perspective[J].Curr Opin Clin Nutr Metab Care,2008,11(2):156-159.
[3] Sakurai Y,Kanaya S,Komori Y,et al.Is postoperative early enteral nutrition with regular or disease-specific enteral formula really beneficial in patients undergoing esophagectomy[J].Esohpagus,2009,6(3):149-154.
[4] Braga M,Gianotti L,Nespoli L,et al.Nutritional approach in malnourished cancer patients[J].Arch Surg,2002,13(7):174-180.
[5] Lieffers JR,Mourtzakis M,Hall KD,et al.A viscerally driven cachexia syndrome in patients with advanced colorectal cancer:contributions of organ and tumor mass to whole - body energy demands[J].Am J Clin Nutr,2009,89(4):1173-1179.
[6] Gabor S,Renner H,Matzi V,et al.Early enteral feeding compared with parenteral nutrition after oesophageal or oesophagogastric resection and recon struction[J].Br J Nutr,2005,93(4):509-513.
[7] Braga M,Gianotti L,Gentilini O,et al.Early post operative enteral nutrition improves gut oxygenation and reduces costs compared with total parenteral nutrition[J].Crit Care Med,2001,29(2):42-48.
[8] Luo M,Bazargan N,Griffith DP,et al.Metabolic effects of enteral versus parenteral alanyl-glutamine dipeptide administration in critically ill patients receiving enteral feeding:A pilot study[J].Clin Nutr,2008,27(2):297 -306.
[9] 尤俊,秦维霞,吴培仁.老年食管贲门癌术后早期肠内营养与肠外营养疗效的对比研究[J].肠外与肠内营养,2010,17(2):78-80.

