GPC3在原发性肝细胞癌中的表达及其临床病理相关性研究
钟鼎文,邹书兵,谢元才,郭广秀
1.赣州市人民医院肝胆外科(江西赣州341000)
2.南昌大学第二附属医院肝胆外科(江西 南昌330000)
原发性肝癌(primary liver cancer,PLC,简称肝癌)是世界上第5大恶性肿瘤,居癌症死亡原因的第3位[1],其发病率逐年增加,据统计每年全球约有748300例新发肝癌病例,有约600 000例肝癌患者死亡。而我国又是肝癌高发区,全球发病患者约有一半在中国[2]。全球范围内,男性、女性发病率约为2∶1[3]。在所有恶性肿瘤中,原发性肝癌的预后极差,手术后短期内容易复发,一般生存期在3年左右,5年生存率极低。尽管如此,包括小肝癌、大肝癌亦或是复发性肝癌在内,手术切除仍是目前最佳的治疗手段,但大多数患者就诊时已是中晚期,失去了最佳治疗时机。所以早发现、早治疗是提高患者生存率的关键。甲胎蛋白(AFP)作为一种肝癌的血清学肿瘤标志物目前已得到公认,并已广泛用于临床筛查,但它的敏感性、准确性还不是很高,甚至对分化好的肝癌敏感性只有70%左右,阳性率也只有64%左右[4],漏诊率较高;其次在一些良性肝病、肺癌、生殖性畸胎瘤患者中AFP也可有升高,容易造成误诊。寻找敏感的早期肝癌肿瘤标志物成为近年临床研究的主要方向。
1 材料与方法
1.1 实验材料 选自赣州市人民医院肝胆外科近5年手术切除并经病理确诊为肝细胞癌患者43例(术前均未经任何抗肿瘤治疗),将距肿瘤边缘2 cm处肝组织作为癌旁对照;肝硬化肝组织20例,正常肝组织(肝胆管结石或肝良性肿瘤)20例。其中女性3例,男性40例;年龄28~79岁,平均年龄50.9岁;病理学特征:肿瘤直径<5cm的18例,≥5cm的25例;高分化5例,中分化20例,低分化18例。临床分期:Ⅰ期9例,Ⅱ期23例,Ⅲ期11例。本研究所有原发性肝癌标本均按WHO组织学分级,分高、中、低3级,临床分期标准参考中国抗癌协会肝癌专业委员会制定并通过的“原发性肝癌的临床诊断与分期标准”[5]。
1.2 实验方法 应用免疫组化通用型二步法检测磷脂酰肌醇蛋白聚糖3(GPC3)在原发性肝细胞癌组织、癌旁组织、肝硬化组织及正常肝组织中的表达情况。对比分析GPC3和AFP在原发性肝细胞癌中的阳性表达率。主要试剂:GPC3鼠抗人单克隆抗体;0.01 M柠檬酸缓冲液(pH 6.0);PBS缓冲液、DAB工作液由福州迈新生物技术有限公司提供;Elivision plus免疫组化检测试剂盒含有:Polymer Helper(即用型,试剂 1)和 HRP标记的 antimouse/rabbit IgG(即用型,试剂2)。实验仪器:石蜡切片机(Leica公司);摊片机(Leica公司);显微镜(Olympus公司);图象分析系统(武汉千屏)。主要步骤:载玻片和盖玻片的处理;切片和烤片;脱蜡;水化组织切片;阻断内源性过氧化物酶;抗原修复;封闭;一抗;试剂 1、2;显色;衬染;脱水;封片。
1.3 判断标准结果 综合考虑免疫组化染色强度和细胞染色阳性率,每张染色切片随机选取5个染色均匀的高倍视野(×400),取平均数。判定标准:染色强度打分按无色、淡黄色、棕黄色、棕褐色分别计为0分、1分、2分、3分;阳性细胞所占百分比打分按无阳性细胞,阳性细胞比例≤25%、26% ~50%、51% ~75%、>75%分别计为0分、1分、2分、3分、4分。染色强度与阳性细胞百分比的乘积<3分免疫组化反应(-),>3且≤6者(+),>6且≤9 者(++),>9且≤12者(+++)[6]。以上判定均由两位具有临床经验的病理医生独立评估得出。1.4 统计学方法 应用SPSS 13.0软件进行统计分析,组织GPC3阳性表达率的比较采用χ2检验,为便于统计学比较将(-)称为表达阴性,(+)(++)和(+++)合并,称为表达阳性,两者进行检验。P<0.05为差异具有统计学意义。
2 结果
43例肝细胞癌组织中有28例呈不同程度的阳性表达,表达阳性率为65.1%(28/43)。而癌旁、肝硬化及正常肝脏组织中GPC3阳性表达率分别为4.6%(2/43)、0%(0/20)、0%(0/20);详见图 ad。癌旁组织、肝硬化组织及正常肝脏组织中表达明显低于肿瘤组织,肝细胞癌组与癌旁组,肝细胞癌组与肝硬化组及肝细胞癌组与正常肝脏组织组之间阳性表达率差异比较具有统计学意义(P<0.05);GPC3与患者年龄、性别、肿瘤直径及临床分期、是否合并肝硬化无显著相关性(P>0.05),而与肿瘤的分化程度有显著相关性(P=0.006)。详见表1。43例患者免疫组化染色AFP阳性表达21例,阴性表达22例,阳性率48.8%(21/43),明显低于GPC3阳性表达率65.1%(28/43),两组对比差异有统计学意义(P<0.05)。
3 讨论
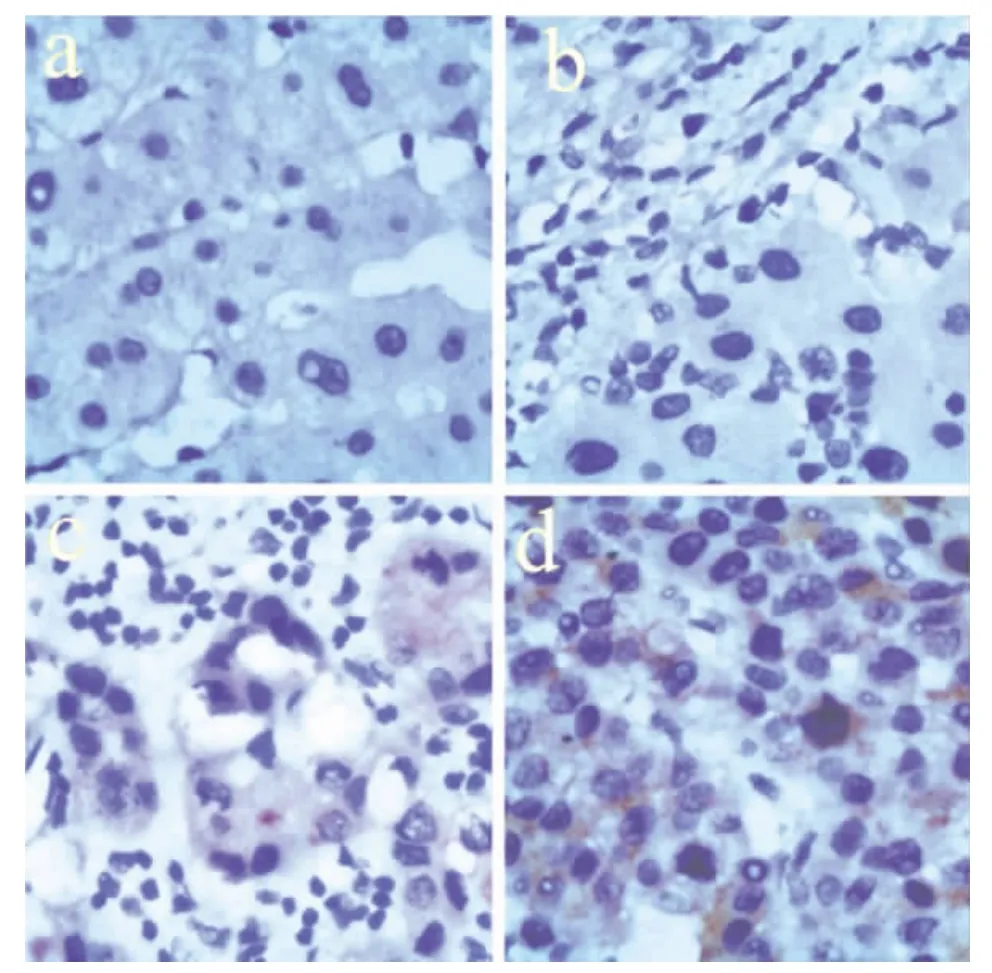
图a-d分别为:GPC3在正常肝组织(-)、肝硬化组织(-)、癌旁组织(+)和肝细胞癌组织(+)中表达(x400)。

表1 GPC3表达与肝细胞癌临床病理特征的关系分析
肝癌早期无明显特异性表现,部分病例在临床上发现时多有肝内外侵袭转移。最近几年肝癌研究的热点之一就是寻找能够早期诊断肝癌的肿瘤标志物。
3.1 GPC3在肝细胞癌组织、相应癌旁组织、肝硬化组织和正常肝组织中的表达及其意义 GPC3是1996年 Pilia等[7]在过度生长畸变综合征的患者中,通过STSS-PCR分离克隆得到的一个cDNA,属glypican家族。GPC3是一种相对分子量为66 Kda的细胞外糖蛋白,位于人染色体Xq26.1,其基因通过磷脂酰肌醇锚定在细胞膜上。以往有研究表明,GPC3在调节肿瘤细胞增殖、分化、黏附和转移等过程中发挥重要作用[8]。
本研究结果表明43例GPC3在肝癌组织中有28例呈不同程度的阳性表达,阳性率为65.1%(28/43)。而癌旁、肝硬化及正常肝脏组织中GPC3阳性表达率分别为 4.6%(2/43)、0%(0/20)、0%(0/20);肝癌组与癌旁组,肝癌组与肝硬化组及肝癌组与正常肝脏组织组之间阳性表达率差异比较具有统计学意义(P <0.05)。Di Tommaso L等[9]的研究显示GPC3对早期肝细胞癌诊断的敏感性为69%,特异性91%。Capurro M等[10]检测了肝细胞癌患者血清GPC3,53%(18/34)的肝细胞癌患者升高,低于肝细胞癌组织阳性率(72%),20例肝硬化患者血清中只有1例GPC3升高,正常对照和肝炎均为阴性。Wang H L等[11]研究结论表明GPC3可作为一种免疫标记物来鉴别肝细胞癌和其他良性肿瘤。综合以上分析及本研究结果表明GPC3在肝细胞肝癌组织中的表达具有较高的阳性率,有望成为一种新的免疫标志物应用于肝癌的临床免疫组化诊断和鉴别诊断。
3.2 GPC3表达与肝细胞癌临床病理特点之间的关系 原发性肝癌已成为严重威胁人类生存的恶性肿瘤之一,本实验研究了肝细胞癌患者年龄、性别、肿瘤直径及临床分期、病理分化程度及是否合并肝硬化等临床病理特点与GPC3的关系。结果表明GPC3与患者年龄、性别、肿瘤直径及临床分期、是否合并肝硬化无显著相关性(P>0.05),而与肿瘤的分化程度有显著相关性(P=0.006<0.05)。在肝细胞癌预后的研究中,Shirakawa H等[12]研究结果显示:GPC3的着色强度与肿瘤的分化程度有相关性,GPC3的高表达多发现在中/低分化的肝细胞癌中,低分化肝细胞癌中的高表达比低表达有更高的病死率,说明GPC3表达程度越高,其预后越差。我们的实验结果也提示低分化的肝细胞癌中GPC3的表达明显高于中、高分化患者,这与Shirakawa H等的表述一致。但我们的实验尚未涉及患者预后,未行进一步的生存期随访调查,对上述论点还需进一步实验证实。
3.3 GPC3与AFP在肝细胞癌病理诊断中的意义目前肝癌的临床诊断主要依靠影像学检查及血液肿瘤标志物检查,而血液肿瘤标志物检查更为简单易行,容易普及。AFP作为一种肝癌的血清学肿瘤标志物目前已广泛用于临床筛查,但它的诊断敏感性、准确性还不具有很高的特异性,甚至对分化好的肝癌敏感性只有70%左右,阳性率也只有64%左右,漏诊率较高;其次在一些良性肝病、肺癌、生殖性畸胎瘤患者中AFP也可有升高,容易造成误诊。本研究中43例患者免疫组化染色AFP阳性表达21例,阴性表达22例,阳性率48.8%(21/43),明显低于GPC3阳性表达率65.1%(28/43)。其中在AFP表达阴性的22例HCC组织标本中有11例呈现GPC3阳性表达(50%),而在GPC3表达阴性的15例HCC组织标本中仅有4例呈AFP阳性表达(26.7%)。两组对比差异有统计学意义(P<0.05),说明GPC3比AFP敏感性更高。研究结果提示将多个有效的分子标记联合检测可能会得到更准确的诊断。但本实验研究仅仅局限与肿瘤免疫组化,未进行血清GPC3蛋白的研究。相关研究表明GPC3在肝癌患者血清中的诊断敏感性和特异性分别为46.7%和93.5%[13],为今后血清 AFP、GPC3联合检测肝细胞肝癌提供了理论依据。
[1] Jemal A,Bray F,Center MM,et al.Global cancer statistics[J].CA:a cancer journal for clinicians,2011,61:69-90.
[2] El-Serag HB.Epidemiology of viral hepatitis and hepatocellular carcinoma[J].Gastroenterology,2012,142:1264-1273.e1.
[3] Ferlay J,Shin HR,Bray F,et al.Estimates of worldwide burden of cancer in 2008:GLOBOCAN 2008[J].International journal of cancer,2010,127:2893-2917.
[4] Soresi M,Magliarisi C,Campagna P,et al.Usefulness of
alphatetoproten in the di-agnosis of hepatocellular carcinoms[J].Anticancer Res,2003,23(2c):1747-1753.
[5] 中国抗癌协会肝癌专业委员会.原发性肝癌的临床诊断与分期标准[J].中华肝脏病杂志,2001,9:324.
[6] 许良中,杨文涛.免疫组织化学反应结果的判断标准[J].中国癌症杂志,1996,6:229-231.
[7] PILIA G,HUGHES BENZIE R M,MACKENZIE A ,et al.Mutations in Glypican - 3,a glypican gene,cause the Simpson - Golabi- Behmel overgrowth syndrome[J].Nature Genet,1996,12(3):241-247.
[8] 余彬彬,苏建家,曹骥,等.Glypican-3及胰岛素样生长因子Ⅱ在肝癌中的表达及意义[J].广西医科大学学报,2008,25(1):70-72.
[9] Di Tommaso L,Franchi G,Park Y N,et al.Diagnostic value of HSP70,glypican3 and glutamine synthetaseinhepatocellularnodules in cirrhosis[J].Hepatology,2007,45(3):725-734..
[10] Capurro M,Wanless I R,Sherman M,et al.Glypican-3:a novelserum and histochemical marker for hepatocellularcar carcinoma[J].Gastroenterology,2003,125(1):89-97.
[11] Wang H L,Anatelli F,Zhai Q J,et al.Glypican-3 as a useful diagnostic marker that distinguishes hepatocellular carcinoma from benign hepatocellular mass lesions[J].Arch Pathol Lab Med,2008,132(11):1723-1728.
[12] Shirakawa H,Suzuki H,Shimomura M,et al.Glypican-3 expression is correlated with poor prognosis inhepatocellular carcinoma[J].Cancer Sci,2009,100(8):1403-1407.
[13] Hui L ,Peng L,Yun Z,et al.Diagnostic value of glypican-3 in serum and liver for primary hepatocellular carcimoma[J].World Journal of Gastroenterology,2010 September 21,16(35):4410-4415.

