缝隙连接蛋白43在胃癌中表达的意义
刘海旺,李春辉△,李建玲
(承德医学院附属医院:1.病理科;2.麻醉科,河北承德 067000)
胃癌是我国常见恶性肿瘤之一,其发病率和病死率在我国各类肿瘤中居首位,但胃癌的发病机制目前尚未完全明确,因此胃癌发病机制的研究就成为了目前的研究重点。缝隙连接是相邻细胞间的膜通道结构,由胞膜上的缝隙连接蛋白(con-nexin,Cx)构成,其中包括Cx43,细胞通过它所介导的细胞缝隙连接通讯(gap junction intercellular communication,GJIC)进行细胞间信息和能量的传递,调控细胞的生长、分化和内环境的稳定。而在胃肿瘤细胞中存在Cx的异常表达,可能使得肿瘤细胞生长速度加快,增值能力增强,与肿瘤的侵袭与转移也有密切的联系。本研究通过免疫组织化学染色方法观察Cx43在胃癌组织和正常胃组织中的表达情况,并通过分析其表达方式与临床病理特征的关系,进一步探讨胃癌的发生、发展机制。
1 资料与方法
1.1 一般资料 收集承德医学院附属医院2010年9月至2012年2月手术切除经病理证实为胃癌组织60例及正常胃组织25例,常规取材固定于中性甲醛液后,逐级脱水石蜡包埋,用于免疫组织化学法染色。60例胃癌患者中,男48例,女12例;年龄45~77岁,平均(58.5±10.0)岁。高、中分化者24例,低分化者36例;无淋巴结转移者25例,有淋巴结转移者35例;Ⅰ+Ⅱ期28例,Ⅲ+Ⅳ期32例。25例正常胃组织来自本院健康体检者,其中男16例,女9例;年龄46~72岁,平均(60.0±6.0)岁。
1.2 试剂与仪器 一抗兔抗人多克隆Cx43抗体(ZA-0444)购自北京中衫金桥生物技术有限公司,抗体稀释倍数为1∶100,二抗为快捷型酶标羊抗鼠/兔IgG聚合物,DAB显色试剂盒购自福州迈新生物技术开发有限公司(DAB-0031),二甲苯、乙醇、3%H2O2、枸橼酸钠等常规试剂购自北京化学试剂公司。全自动脱水机(英国Shandon Thrmo公司),S325石蜡切片机(英国Shandon公司产品),G2X-DH-40X45电热恒温箱(山东立鹤公司产品),BX40F4显微镜(日本 Olympus公司产品),显微照相系统(日本Olympus公司产品)。
1.3 实验方法
1.3.1 免疫组织化学方法 标本经常规石蜡包埋后连续切片4μm,切片以二甲苯脱蜡及系列乙醇脱水;磷酸盐缓冲液(PBS)冲洗5min,以3%H2O2孵育10min(室温);PBS冲洗2×6min后在微波炉中进行抗原修复;加Cx43抗体,在37℃湿盒中温育60min后,在湿盒中4℃过夜;PBS洗3×5min,滴加二抗,室温孵育15min;PBS洗3×5min,DAB显色5 min,蒸馏水冲洗终止显色,苏木素复染核;封片,观察。另外,组织切片用PBS替代Cx43抗体(其余染色步骤相同)作为阴性对照,用已知正常胃组织的阳性切片作为阳性对照。
1.3.2 免疫组化结果判定方法 正常胃组织中Cx43阳性信号主要表达于细胞膜,在胃癌组织中可表达于细胞质。在染色均匀的区域,选取5个高倍镜视野(×400):(1)按阳性细胞百分率(A值)评分:1%~25%为1分,>25%~50%为2分,>50%为3分;(2)按染色强度(B值)评分:不着色为0分,浅棕黄色为1分,棕黄色为2分,棕褐色为3分。综合A值与B值判断结果,阴性(-)为0分,弱阳性(+)为1~2分,中度阳性(++)为3~4分,强阳性(+++)为5~6分。
1.4 统计学处理 实验数据通过SPSS17.0统计软件完成,计数资料采用四格表χ2检验,以P<0.05为差异有统计学意义。
2 结 果
2.1 Cx43在正常胃组织和胃癌组织中的表达 正常胃组织中Cx43的阳性表达率为100%(25/25),明显高于胃癌组织阳性表达率66.7%(40/60),差异有统计学意义(P<0.05)。见表1。

表1 胃癌组织中Cx43的表达与临床病理的关系

图1 高、中分化胃癌Cx43的表达(×100)
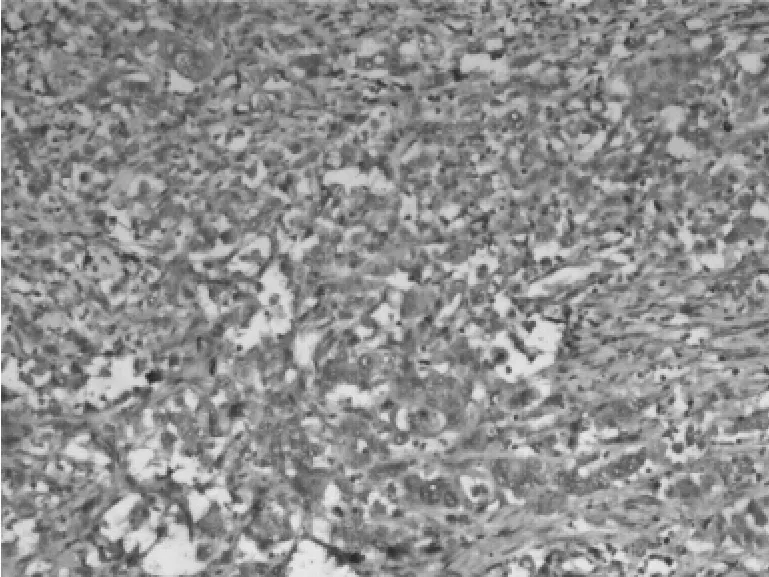
图2 低分化胃癌Cx43的表达(×100)
2.2 胃癌组织中Cx43的表达与临床病理特征的关系 高、中分化者Cx43的阳性表达率为83.3%(20/24)高于低分化者的阳性表达率55.6%(20/36),无淋巴结转移者Cx43的阳表达率为88.0%(22/25)高于有淋巴结转移者的阳性表达率51.4%(18/35),Ⅰ+Ⅱ期 Cx43的阳性表达率为89.3%(25/28)高于 Ⅲ+Ⅳ期的阳性表达率46.9%(15/32),差异有统计学意义(P<0.05)。见表1,图1、2。
3 讨 论
缝隙连接是相邻细胞间的膜通道结构,由胞膜上的Cx构成,细胞通过它所介导的GJIC进行细胞间信息和能量的传递,调控细胞的生长、分化和内环境的稳定,对机体功能的维持发挥重要作用,胃癌的发生可能与 GJIC功能异常有关[1-2]。Cx43被认为是胃黏膜中的主要连接蛋白,连接蛋白的共同结构由4个跨膜亲水片段M1-4,为α螺旋结构,2个胞外环E1-2和1个胞质环,缝隙连接是通讯连接的主要形式,是沟通相邻细胞的跨膜通道[3-4]。一些离子和相对分子质量较小的物质可以直接从一个细胞流入另一个细胞内,这样周围的健康细胞便可以营养相邻的病态细胞[5]。缝隙连接的功能除介导细胞之间的连接外,主要是偶联细胞间通讯,包括电偶联和化学偶联[6],大多数肿瘤细胞的缝隙连接通讯功能微弱或缺失,细胞发生转化后其GJIC功能降低或抑制,被认为是促癌变阶段的重要机制,Cx43主要表达在细胞膜上,当其表达异常,如表达于细胞质时可能已经发生了癌变[7]。Tang等[8]研究发现在胃肿瘤细胞中与邻近的正常细胞相比Cx43显著性的低表达,在有转移的淋巴结中与胃肿瘤细胞相比Cx43显著性的高表达,同时提出Cx43的低表达可能促成了胃癌的发生。但Cx43的高表达也可能促成了胃癌细胞高效的新陈代谢以至于发展到有淋巴结转移[9-11]。研究也发现在胃癌细胞和血管内皮间可有明显的阳性着色,这表明肿瘤细胞可能利用间隙连接从血管中获取营养物质[12]。Cx43表达量的变化还可能与多种肿瘤的发生、发展密切相关,Su等[13]应用Cx43转染恶性黑色素瘤细胞株发现细胞的Cx43表达增强,贴壁依赖性生长受到了抑制,Cx43基因可上调肿瘤细胞Cx43mRNA的表达,促进磷酸化,恢复和增强GJIC功能,逆转恶性表型,抑制肿瘤细胞增殖。同时也有研究认为缝隙连接的表达是肿瘤细胞浸润的条件之一[14]。本实验通过免疫组织化学法对Cx43在正常胃黏膜及胃癌组织中的表达进行研究,研究发现Cx43在正常胃黏膜中的表达明显高于其在胃癌组织中的表达,高、中分化胃癌Cx43的表达均高于低分化胃癌组;无淋巴结转移胃癌Cx43的表达高于有淋巴结转移胃癌组,胃癌组织Ⅰ+Ⅱ期Cx43的表达高于 Ⅲ+Ⅳ期的表达。这一实验结果与之前的某些研究结果一致[15],进一步验证了缝隙连接的异常表达与肿瘤的浸润性生长能力较强有关。
[1]Sosinsky GE.Molecular organization of gap junction membranechannels[J].J Bioenerg Biomembr,1996,28(4):297-308.
[2]John SA,Revel JP.Connexin integrity is maintained by noncovalent bonds:intracellular disulfides bonds link the extracellular domains in rat connexin-43[J].Biochem Biophs Res Commun,1991,178(8):1312-1318.
[3]Herrmann S,Seidelin M,Bisgaard HC,et al.Indolocarbazole inhibits gap junctional intercellular communication in rat primary hepatocytes and acts as a potential tumor promoter[J].Carcinogenesis,2002,23(11):1861-1868.
[4]Kumar NM,Gilula NB.The gap junction communication channel[J].Cell,1996,84(2):381-388.
[5]Kanczuga-Koda L,Koda M,Sulkowski S,et al.Gradual loss of functional gap junction within progression of colorectal cancer-a shift from membranous CX32and CX43 expression to cytoplasmic pattern during colorectal carcinogenesis[J].In Vivo,2010,24(1):101-107.
[6]Willecke K,Haubrich S.Connexin expression systems:to what extent do they reflect the situation in the animal[J].J Bioenerg Biomembr,1996,28(4):319-326.
[7]Uchida Y,Matsuda K,Sasahara K,et al.Immunohistochemistry of gap junctions in normal and diseased gastric mucosa of humans[J].Gastroenterology,1995,109(5):1492-1496.
[8]Tang B,Peng ZH,Yu PW,et al,Expression and significance of Cx43and E-cadherin in gastric cancer and metastatic lymph nodes[J].Med Oncol,2011,28(2):502-508.
[9]Xu CX,Jia Y,Yang WB,et al.Relationship between helicobacter pylori infection and expression of connexin(Cx)32and Cx43genes in gastric cancer and gastric precancerous lesions[J].Zhonghua Yi Xue Za Zhi,2008,88(22):1523-1527.
[10]Wu J,Zhou HF,Wang CH,et al.Decreased expression of Cx32and Cx43and their function of gap junction intercellular communication in gastric cancer[J].Zhonghua Zhong Liu Za Zhi,2007,29(10):742-747.
[11]Guerrero PA,Schuessler RB,Davis LM,et al.Slow ventricular conduction in mice heterozygous for a connexin43 null mutation[J].Clin Invest,1997,99(8):1991-1998.
[12]Fan SQ,Zhou M,Xiang Q,et al.In situ expression of connexins in various carcinomas[J].Ai Zheng,2003,22(7):686-690.
[13]Su YA,Bittner ML,Chen Y,et al.Identification of tumor suppessor genes using human melanoma cell lines UACC903,UACC903(+6).and SRS3by comparision of expression profiles[J].Mol Carcing,2000,28(2):119-127.
[14]Brauner T,Hulser DF.Tumor cell invasion and gap junctional communicationⅡnormal and malignant cells confronted in multicell spheroids[J].Invasion Metastasis,1990,10(1):31-48.
[15]Nishitani A,Hirota S,Nishida T,et al.Differential expression of connexin43in gastrointestinal stromal tumours of gastric and small Intestinal ongin[J].J pathol,2005,206(4):377-382.

