数字乳腺X线三维定位系统引导Mammotome微创活检的临床应用价值
谭 欢,曾勇明
(重庆医科大学附属第一医院放射科 400016)
乳腺癌是女性最常见的恶性肿瘤之一,近年来发病率逐年递增,并且伴有年轻化趋势。提高早期乳腺癌的检出率,能有效降低乳腺癌患者的死亡率,并提高乳腺癌患者的生存质量。乳腺X线检查能发现一部分自检、临床医生检查、超声检查都无法发现的早期乳腺癌[1]。然而确诊乳腺癌仅靠影像学评估是不够的,病理组织学的诊断结果才是金标准。平板数字乳腺X线机的三维定位系统引导Mammotome旋切系统微创提取组织样本是一种新型的穿刺活检技术。本文收集了77例行乳腺X线定位引导下Mammotome微创活检的病例进行回顾性分析,结合文献评价其临床应用价值。
1 资料与方法
1.1 一般资料 搜集本院2011年3月至2012年6月77例女性患者,年龄31~65岁,平均49岁。77例患者临床检查均为乳腺触诊阴性病变。
1.2 仪器设备 美国GE公司生产的Senographe DS型平板数字乳腺X线机,以及配套的坐立式数字化三维立体定位系统。美国强生公司Mammotome微创旋切系统,由11G活检针、真空抽吸泵、控制器及相关软件组成。
1.3 操作方式 患者坐在专用检查椅上,调整好椅子的高度,使患者较为舒适地坐在椅子上,以便保证在整个检查期间保持不动。将目标乳房加压,尽量保证病灶区域置于压迫板开口的中心。随后,摄片得到搜索影像,观察病灶是否位于视野内,同时要将参照标记定位。再旋转X线管分别置于正、负15°位置摄片,得到两幅立体影像,在立体影像上确定穿刺点,由定位系统电脑自动算出病灶在三维坐标即X、Y、Z的精确数据,并发送到穿刺系统。然后将Mammotome的穿刺针连接到机架上,发射穿刺到病灶中心。在旋切前,需摄片看穿刺针是否到位。确认到位后,旋切病灶,取出条状组织标本整齐放置,以便术后标本摄片。完成活检术前,再对病灶区摄片,以确定可疑病灶被切除或部分被切除。手术结束后,穿刺点压迫止血,可使用胸带。组织标本一定要先摄片,以确认可疑钙化灶位于标本内,再送病检。见图1。
2 结 果
2.1 手术结果 在这77例病例中,有47例乳腺X线图像显示有钙化影,另有30例X线片中没有钙化灶,仅表现为高密度结节影或者局部结构扭曲。放射科医师对这77例病灶BIRADS评级分类为Ⅱ、Ⅲ、Ⅳ、Ⅴ级。除有5例病灶未能进行三维定位,其余72例均成功取得病灶组织样本,每个病灶都获得12~24条样本不等。其中47个含钙化的病灶微创活检后,所得样本经X线片证实100%都取到钙化。
2.2 病理结果 在成功进行Mammotome微创活检术后72例病例中,最终得到病理学检查结果有11例确诊是乳腺癌,61例为良性病变(1例为轻度不典型增生)。在11例确诊的乳腺癌中,4例为乳腺导管内癌(DCIS);7例为乳腺浸润性导管癌(IDC)。4例DCIS中Mammotome活检病理结果1例为重度不典型增生,2例为乳管内乳头状瘤,细胞增生活跃,均提示导管内癌不除外。其余8例乳腺癌微创活检结果与开放性手术病检结果相符,病理符合率72.7%,组织学低估率27.3%。11例乳腺癌术后分期,除1例为Ⅱ期,其余全为Ⅰ期属早期乳腺癌(91%)。此11例乳腺癌在乳腺X线片BI-RADS评级均是Ⅳ级以上。60例良性病变中包括1例乳头状瘤,9例纤维腺瘤,50例乳腺病,在乳腺X线片BI-RADS评级均是Ⅲ级以下。见表1、2。
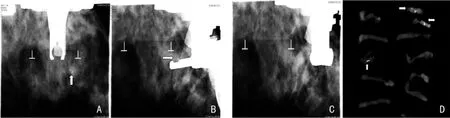
图1 数字乳腺X线三维定位系统引导Mammotome微创取活检过程
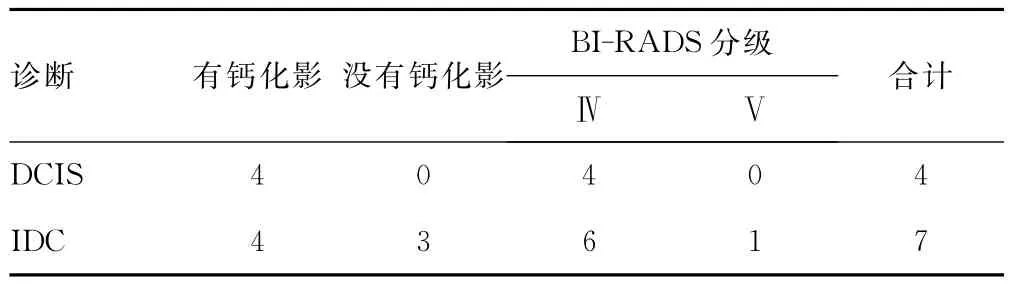
表1 病理诊断为乳腺癌病例的情况(n)
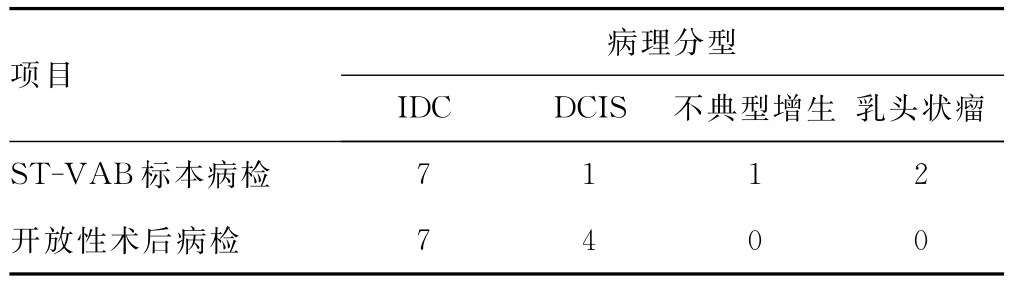
表2 ST-VAB诊断恶性或可疑恶性结果与术后结果比较(n)
3 讨 论
3.1 乳腺X线引导下的3种常用活检方式的比较[2]空心针活检(core needle biopsy,CNB)[3]、金属丝定位活检及真空辅助抽吸活检(stereotactic vacuum-assisted biopsy,ST-VAB)是现在比较常用的3种取组织活检的方式[4],这3种方式都是可以在数字乳腺X线机定位引导下精确到达病灶位置取出活检组织的。CNB目前多采用巴德活检装置[5],空心针的大小为14G,直径为1.628 14mm,穿刺损伤比较小,但是最多只能获得17mg组织[6]。因一次所取组织样本量少,需要反复插入穿刺针以获得足够的样本,增加了肿瘤发生针道转移可能性[7]。而且组织取样太少和取样部位的问题还会导致假阴性和组织学低估的现象,目前报道的假阴性率为0%~8.9%[8],组织学低估可达32.3%。
金属丝定位活检是在乳腺X线定位引导下留置金属丝于病灶中,进行开放式手术获取病变组织进行冰冻病理学检查。此方法的准确性很高,不会出现假阴性和组织学低估的现象。但是开放性手术活检会限制或影响确诊后的原发性乳腺癌的治疗选择,基本上不存在新辅助治疗的机会,同时也会影响前哨淋巴结活检可靠性[9]。对诊断为良性的患者,也会留下较大的疤痕,影响乳腺美观。在欧美发达国家已逐步被穿刺活检替代[10]。
ST-VAB相当于是CNB的改进[11],主要是采用 Mammotome。它通过一次穿刺即可反复切割,标本不接触针道,有效减少了针道肿瘤细胞移位的发生。乳腺X线引导的Mammotome多采用11G的活检针,直径为2.303 78mm,再加上真空抽吸作用,最多可获得105mg组织[6]。活检组织获取量的大大增加使假阴性率和组织学低估现象可得到一定降低,但还是不能杜绝,本组病例恶性低估率还是有27.3%。病理学的低估与乳腺癌组织学的异质性、钙化灶的大小、形态及病灶的选择有关。因此,ST-VAB诊断为不典型增生及不明确的病灶仍需及时进行开放手术进一步诊断治疗。
3.2 乳腺X线定位引导与超声定位引导的比较 乳腺的STVAB一般采用乳腺X线定位和超声定位引导[12],病灶多是乳腺触诊阴性病变。
3.2.1 病灶的区别 乳腺触诊阴性病变就是患者自觉无症状,临床医生也未触摸到包块等异常,但影像学检查却有异常征象。它在乳腺X线片上通常显示为:成簇细小钙化;边界不清楚高密度影;新出现的边界清楚的孤立肿块;乳腺结构变形扭曲,不对称。它在超声表现可为实质性和囊肿性两种,前者声像图为均匀低回声或分布不均实质性衰减,后者为均质性无回声区。对于早期乳腺癌来说,发现成簇细小钙化的意义重大[13]。因此,乳腺X线定位引导 Mammotome微创取出含钙化的组织活检,对发现早期乳腺癌更有帮助。在本组病例中,11例乳腺癌病例有8例在乳腺X线片都发现有钙化,并通过三维定位引导 Mammotome微创取得了含钙化的组织,进行病理检查。
3.2.2 操作方式的区别 超声引导的Mammotome微创比较灵活,穿刺针不固定,可以从不同的方向进入,进入后也可根据超声引导变化位置、深度等对病灶进行旋切。乳腺X线引导就比较固定了,一旦三维定位确定好穿刺点,Mammotome的穿刺针的位置以及进针的深度就确定不变了。因此,根据病灶的位置选取定位方式很关键,一般头尾位(CC位)病灶显示清楚的,多采用CC位进行定位;若病灶太靠近胸壁或太靠上方,则采用内外侧斜位(MLO位)进行定位更好。有时也会采取一些特殊的位置,本组病例就出现过多次病灶位于外下象限,且很靠下的位置。CC位和MLO位定位后,乳腺X线机都因自我保护程序,避免平板探测器被穿刺针撞击,而无法发出弹射命令,最终采取反MLO位(LMO位)定位才穿刺成功。
综上所述,乳腺X线定位引导Mammotome微创活检对早期乳腺癌的诊断有较高的临床应用价值。乳腺X线摄片检查发现簇状细小钙化或结构紊乱结节影等异常征象,BI-RADS评级为Ⅲ~Ⅴ级,而临床触诊或超声检查并未发现异常,实施乳腺X线定位引导Mammotome微创取活检能帮助诊断[14]。通过影像学精确定位穿刺活检提取样本做病理学评估是非常有效可行的。目前,在欧美发达国家穿刺活检已取代术中冰冻病理成为诊断乳腺疾病的主要方法。该活检方式不会影响乳腺癌新辅助化疗的实施。这项检查的顺利开展不仅需要手术医生的成功操作,更需要放射科技术人员的通力配合,准确定位,这对于准确取得活检组织至关重要。最后,还存在术后随访的问题,由于有假阴性和组织学低估现象的存在,对良性病变患者,并不需要再进行开放性手术,但是必须接受影像学随访,随访期限应多长还有待确定。
[1]张廷璆,柳光宇.具有微灶钙化、临床未能触及肿块的乳腺癌的早期诊断[J].中国癌症杂志,2002,12(5):444-446.
[2]柳光宇,陈灿铭,胡震.乳腺X线立体定位活检方法评价及选择[J].中华外科杂志,2006,44(19):1322-1324.
[3]张蕴,杜红文,张毅力,等.钼靶X线引导下定位FNAC或CNB及其对乳腺微小病变的诊断价值[J].实用放射学杂志,2006,22(9):1121-1124,1144.
[4]冀焕梅,梁秀芬.钼靶X线定位穿刺留置导丝活检对乳腺微小病灶的诊断价值[J].实用放射学杂志,2006,22(4):463-465.
[5]柳光宇,沈坤炜,张家新.乳腺X线立体定位空芯针活检的临床应用[J].肿瘤,2004,24(3):264-266.
[6]Burbank F,Parker SH,Fogarty TJ.Stereotactic breast biopsy:improved tissue harvestion with the mammtome[J].Am Surg,1996,62(9):738-744.
[7]Cho E,Kim MH,Cha SH,et al.Breast cancer cutaneous metastasis at core needle biopsy site[J].Ann Dermatol,2010,22(2):238-240.
[8]Park HL,Kim LS.The current role of vacuum assisted breast biopsy system in breast disease[J].J Breast Cancer,2011,14(1):1-7.
[9]Ceccarelli G,Casciola L,Battistini I,et al.Non palpable lesions of the breast:the mammotome-biopsy in the preoperative management of breast cancer[J].G Chir,2005,26(5):187-193.
[10]Liberman L.Percutaneous image-guided core breast biopsy:state of the art at the millennium[J].AJR Am J Roentgenol,2000,174(5):1191-1199.
[11]Kettritz U.Minimally invasive biopsy methods-diagnostics or therapy personal opinion and review of the literature[J].Breast Care(Basel),2011,6(2):94-97.
[12]刘佳,于谦,郭文斌,等.高频超声引导 Mammotome乳腺活检系统微创治疗乳腺良性肿块[J].中国影像技术,2006,22(7):1015-1017.
[13]赵亚平,周世英.乳腺X线片中成簇样微小钙化对乳腺癌的诊断价值[J].临床放射学杂志,2001,20(1):7-10.
[14]郑一琼,张艳君,孙珊梅,等.BI-RADS分级在临床不可触及的乳腺病变活检中的应用[J].中国医学影像学杂志,2009,17(3):207-210.

