外压与凝聚态物质饱和蒸气压关系的讨论*
梁山 崔玉红 郭艳玲
(天津科技大学理学院 天津 300457)
某温度下一种物质的饱和蒸气压指的是这种物质的气相与其凝聚相(固相或液相)达到平衡状态时气相的压力。蒸气压是物质分子脱离液体或固体表面能力的一种量度。一般情况下,固体的饱和蒸气压较小,所以在这里我们主要讨论液体的饱和蒸气压。
液态纯物质的饱和蒸气压随温度非线性增加,二者之间的关系可用克劳修斯-克拉佩龙方程来描述。另外,外界压力、曲率半径对饱和蒸气压也有一定的影响,本文将对这两种因素加以探讨。
1 真空密闭系统中纯组分液体的饱和蒸气压
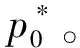
2 外压与液体饱和蒸气压的关系[1-4]
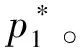
Vm(l)dp=Vm(g)dp*
(1)
式中Vm(l)、Vm(g)分别为液体和气体的摩尔体积,结合理想气体状态方程,视Vm(l)为常数,即可推导出如下关系式:
(2)
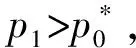
2.1 加入惰性气体
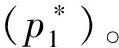
解:外压与饱和蒸气压的关系公式为:
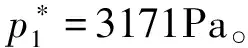
2.2 机械加压[1,6]
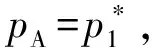
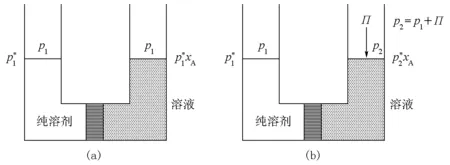
图1 渗透现象示意图(a) 无外加压力;(b) 施加外加压力后
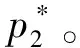
ΠnAVm≈ΠV=nBRT
这里利用外压与饱和蒸气压的关系公式及拉乌尔定律推导出了范霍夫(van′t Hoff)公式。计算表明,饱和蒸气压若有一定量的改变,外压往往会非常大。如23℃时,质量摩尔浓度为0.01mol·kg-1的非电解质水溶液液面上方水的分压仅比纯水的饱和蒸气压低0.6Pa,但是溶液的渗透压却高达2.46×104Pa[3]。可见,饱和蒸气压对外压的影响是显著的。
3 曲率半径与饱和蒸气压的关系
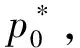
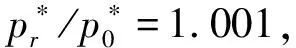
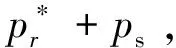
4 结论
饱和蒸气压是物理化学的重要概念,是联系气相与凝聚相的桥梁,是凝聚态物质的固有属性,与温度、压力、曲率半径等因素有关。
① 一定温度下,平液面气液平衡时,饱和蒸气压随外压的增加而增大,且往往是外压变化很大,饱和蒸气压改变很小。平液面中的饱和蒸气压不会比真空密闭系统中纯物质气液平衡时的饱和蒸气压小。
② 在弯曲界面中,曲率半径的变化会影响饱和蒸气压的大小,等温时二者遵从开尔文公式。且在毛细管凹液面,物质的饱和蒸气压比在平液面气液平衡时的饱和蒸气压低。
③ 应用外压与饱和蒸气压的关系公式,推导了范霍夫公式和开尔文公式。其中范霍夫公式的推导方法未见于现行教材中。在弯曲液面时,外压不再与液体受到的压力相等,在这种情况下,将外压与饱和蒸气压的关系公式称为“凝聚相表面的压力与饱和蒸气压的关系公式”可能更为合理。
参 考 文 献
[1] 傅献彩,沈文霞,姚天扬,等.物理化学(上册).第5版.北京:高等教育出版社,2005
[2] 天津大学物理化学教研室.物理化学(上册).第5版.北京:高等教育出版社,2009
[3] 范康年,陆靖,唐颐,等.物理化学.第2版.北京:高等教育出版社,2005
[4] 胡英,吕瑞东,刘国杰,等.物理化学.第5版.北京:高等教育出版社,2007
[5] 李华昌,符斌.实用化学手册.北京:化学工业出版社,2006
[6] 吴振玉,谢安建,李村,等.大学化学,2009,24(2):63
[7] 沈文霞.物理化学核心教程.第2版.北京:科学出版社,2009
[8] 刘国杰,黑恩成.物理化学释疑.北京:科学出版社,2010

