葫芦[7]脲的合成及其与甲基橙的超分子行为研究
——综合性研究型实验设计
张海波 龚林波 夏春兰 丁琼
(武汉大学化学与分子科学学院 湖北武汉 430072)
葫芦脲(cucurbit[n]uril,n=5~10,缩写CB[n]),是超分子化学中继冠醚(crown ether)、穴醚(cryptands)、杯芳烃(calixarene)、环糊精(cyclodextrin)之后发展起来的一类新型高度对称的笼状大环主体分子化合物[1],具有疏水的内部空腔及由环绕的羰基氧原子组成的端口。这些结构特征使它能够通过疏水作用、氢键、离子-偶极等键合作用键合多种有机阳离子,通过与金属配位形成金属配合物。随着超分子化学的兴起,葫芦脲以其特有的结构特性和广阔的应用前景,越来越受到主客体化学、自组装超分子化学、环境化学、催化、材料化学、生物化学等学科研究者的关注。特别是进入到21世纪,这一领域呈现蓬勃发展的趋势[2]。本文介绍的实验可作为本科生综合实验,使学生较早地接触前沿科学,更好地了解超分子化学的发展方向,有利于高素质人才的培养。
1 实验目的
(1) 了解葫芦脲及其在超分子化学中的应用。
(2) 熟悉葫芦脲的制备方法和同系物的分离方法。
(3) 熟悉葫芦脲的超分子行为及常用研究手段。
2 实验原理
葫芦脲的最重要性质是其端口和空腔具有负静电势能。首先,葫芦脲两端分别分布着与其结构单元数相同的羰基基团,这些羰基基团对电荷稠密的金属阳离子来说是优良的σ给体;同时,羰基键的高极性也对键合有利;而对电荷稠密的金属阳离子来说,它本身是优良的σ接受体。因此,葫芦脲对多种有机阳离子、金属离子具有选择性包结配位能力[3]。其次,葫芦脲的环壁上含有4倍于其结构单元数的N,它们环绕所形成的空腔是疏水性的,可以包结有机分子、气体分子和其他客体小分子。再次,其羰基O和N都有可能形成氢键,可与存在的金属离子相互作用,形成自组装的分子胶囊或主-客体实体。
合成分离原理是:首先,由乙二醛和尿素合成甘脲并分离纯化,然后由自制甘脲与多聚甲醛反应,制备葫芦[5~8]脲同系物的混合产物,再利用葫芦[5~8]脲同系物的性质差别进行分离纯化,得到CB[5],CB[6],CB[7]和CB[8]。图1给出了甘脲和葫芦脲的合成示意图。
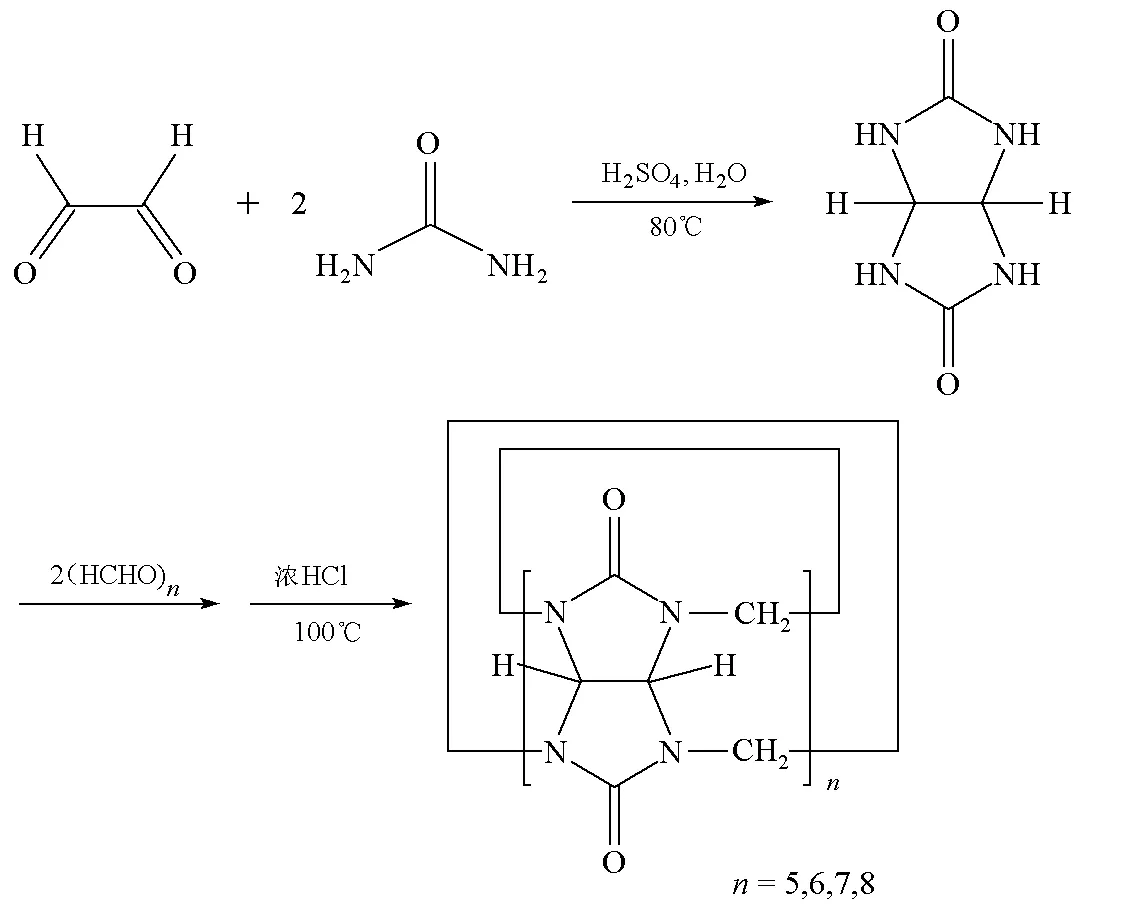
图1 甘脲和葫芦脲的合成示意图
本实验内容设计为两部分:① 葫芦脲的合成和分离;② 中性水体系中甲基橙与葫芦[7]脲的超分子作用。
3 实验仪器及药品
药品:乙二醛(40%水溶液),尿素(分析纯),多聚甲醛(化学纯),盐酸(36%),丙酮(分析纯),甲基橙(分析纯)。
仪器:500mL圆底烧瓶,10mL容量瓶,磁力搅拌器,恒压滴液漏斗,球型回流冷凝管,旋转蒸发仪,恒温槽,循环水多用真空泵,电热真空干燥箱,超声波清洗器,UV-2010型紫外可见分光光度计(UV),红外光谱仪(IR),Varian Mercury VX-300M型核磁共振仪。
4 实验过程
4.1 甘脲的合成
将120.00g尿素溶于300mL水中,滴加浓硫酸调节pH至1~2,搅拌下升温至75℃,用滴液漏斗向其中缓慢滴加92mL 40%乙二醛水溶液,约1h滴完。升温至80℃继续反应约8h。冷却至室温,过滤,分别用大量去离子水、丙酮洗涤固体,真空干燥24h, 得白色粉末状固体107.58g,收率为94.7%。IR(KBr):3203cm-1(s,NH),2848cm-1(s,CH),1732 cm-1(s,CO)。与甘脲标准图谱一致。
4.2 葫芦[5~8]脲的合成及葫芦[6~8]脲分离与纯化
称取28.40g甘脲,加入150mL浓盐酸,搅拌使甘脲完全溶解。在室温搅拌下加入12.00g多聚甲醛粉末,数分钟后得到胶状溶液。缓慢升温至100℃,一段时间后胶状固体溶解,得棕红色溶液。12h后反应完全,停止反应。冷却至室温,尽量蒸除HCl后减压浓缩,然后分次加入大量丙酮直至沉淀不再增多为止,所得沉淀为固体a。固体a用大量水洗至固体不再溶解减少,所得洗涤液c中分次加入大量丙酮析出固体d,而洗涤后所剩固体为固体b。
固体b中主要含CB[6]和CB[8]。用4mol/L HCl水溶液洗涤几次,所剩固体为粗CB[8],洗涤液浓缩后加入大量丙酮析出沉淀,为粗CB[6]。粗CB[6]以浓盐酸重结晶,真空干燥,得纯CB[6]。
固体d中主要含CB[5]和CB[7]。用20mL的3mol/L HCl水溶液洗涤,所剩固体为粗CB[5]。洗涤液稍浓缩后加入丙酮析出沉淀,所得固体再用50%的甲醇水溶液反复洗涤几次,可以得到纯CB[7]。将CB[7]溶于稀硫酸中,在密闭容器中用丙酮小分子扩散的方法,可以得到纯度更高的CB[7]。葫芦脲的分离过程见图2。

图2 葫芦脲同系物的分离示意图
葫芦脲同系物的分离一般都是利用CB[n]在不同溶液中溶解度的差异,采用多次溶解沉淀进行的。在将反应体系进行沉淀而与溶液分离之后,利用CB[6,8]和CB[5,7]在水中溶解度的差别可以实现两者的分离。所得的CB[6,8]混合物可以用4mol/L HCl水溶液很好地分离,提取出来的CB[6]重结晶后纯度较好;而CB[5,7]的分离在参考文献[4]的基础上经过反复实验,最后选定使用以下方法:先用适量的3mol/L HCl水溶液洗涤CB[5,7],在洗涤液浓缩并沉淀后,再用50%的甲醇水溶液反复洗涤沉淀。合成分离纯化示意图如图2所示。实验证明,该方法可以得到较纯的CB[7]。
4.3 葫芦[7]脲与甲基橙的超分子行为研究
4.3.1 实验方法

4.3.2 包结物的可见光谱
以水作参比液,用紫外分光光度计在300~600nm的波长范围内测定葫芦[7]脲与甲基橙形成的包结物的吸光度,其结果如图3所示。
从图3可以看出,在300~600nm的波长范围内,吸光度的强度发生了明显变化,在波长400nm处有最低吸光度,波长在515nm处显示最大吸光度;包结物的形成可改变甲基橙吸光度的最低和最高位置,且包结物的吸收光谱与酸性或中性甲基橙的光谱的峰形也发生了改变,这说明有新物质生成;此外葫芦[7]脲与甲基橙形成配合物时,甲基橙的结构发生了明显改变。
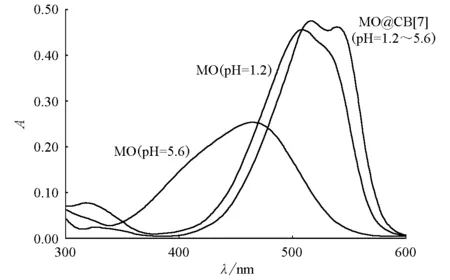
图3 不同pH下甲基橙(MO)和包结物(MO@CB[7])的紫外光谱
4.3.3 CB[7]与甲基橙形成的超分子的包结比和稳定常数

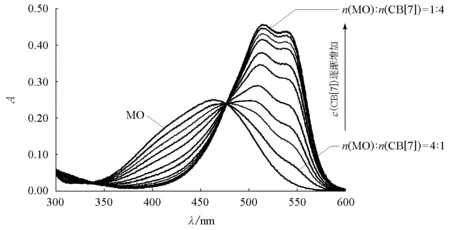
图4 不同浓度的甲基橙和CB[7]的吸光度-吸收波长图固定甲基橙浓度为1×10-5mol/L,CB[7]的浓度从2×10-6mol/L逐渐增至8×10-5mol/L

图5 CB[7]与甲基橙作用体系的Job滴定曲线
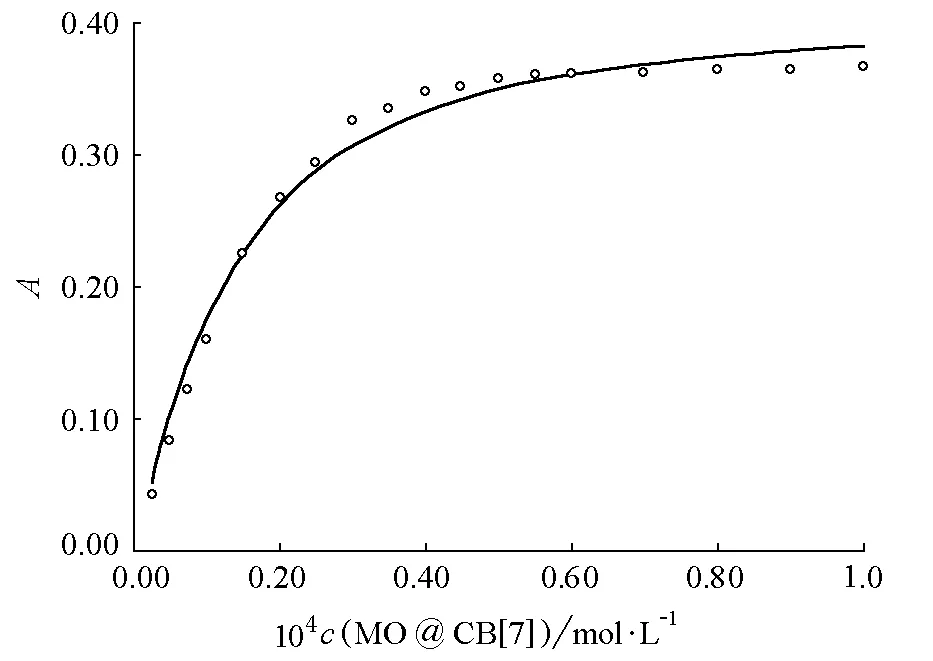
图6 CB[7]与甲基橙形成的超分子的包结常数拟合曲线
5 思考和讨论
(1) 何为葫芦脲?葫芦脲的同系物有哪些?它们的超分子行为有什么不同之处?
(2) 分离葫芦脲同系物的原理是什么?
(3) 怎样用紫外法确定葫芦脲[7]和甲基橙的包结常数?
本实验综合了基础化学和有机化学等实验的原理和基本操作,可以培养学生初步掌握大环主体分子的合成、分离和纯化的手段,并熟悉超分子化学的基本研究方法。
由于本实验内容较为丰富,所用原料简单易得,价格低廉,绿色环保,符合实验教学发展的趋势,适合不同类别学校和专业开设。在开设过程中,各校各专业可根据各自教学内容与实验时数自行取舍。该综合实验反映了科学研究的新成果,可操作性强,有利于激发学生的创新能力,有利于培养学生的学习能力和实践能力。实践表明,这是一个值得推荐的综合实验项目。
参 考 文 献
[1] Day A I,Arnold A P,Blanch R J,etal.JOrgChem,2001,66:8094
[2] 张桂玲,徐周庆,薛赛凤,等.无机化学,2003(6):655
[3] Lagona J,Mukhopadhyay P,Chakrabarti S,etal.AngewChemIntEd,2005,44:4844
[4] 罗绪强,薛赛凤,祝黔江,等.贵州大学学报(自然科学版),2003,20:184

