电化学教学中的两个问题
史济斌 刘国杰
(华东理工大学化学系 上海 200237)
在原电池热力学计算中,有两个看似简单的问题,但仔细追究起来,其实并不简单,只是在电化学教学中没有引起大家的关注,致使第一个问题不知其所以然,第二个问题则错在大多数物理化学教材中的表示。
1 问题一:公式是怎样导得的?
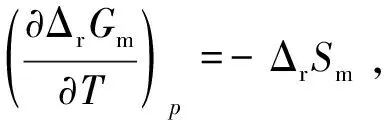
(1)
关于这个问题,并不是大家都知道其所以然。在《大学化学》杂志2011年第3期上,杨喜平等[1]提出了这个问题,我们觉得是很有意义的。但是,我们并不完全同意他们的观点,认为文中有些看法是值得商榷的。下面,谈谈我们对这个问题的理解,以供大家进一步讨论。
推导①:若有一发生化学变化的封闭系统,由K个组分和π个相构成,则系统的热力学能微变可由如下热力学基本方程描述[2]:
(2)

在恒温、恒压条件下,将热力学第一定律
dU=δQ-pdV+δW′
(3)
代入式(2),可得:
(4)
或:
(5)
式中W′代表非体积功,等号代表可逆,不等号代表不可逆。式(5)也可表示成:
(6)
假如将化学变化设计成原电池,并使它可逆地放电做电功,则由式(6)可得:
(7)

(8)

(9)
由于原电池可逆做电功时,有:
(10)
式中z为反应电荷数,F为Faraday常量,E为原电池的电动势。故代入式(9),可得:
(11)
由于在恒温、恒压下,系统所做的可逆电功即为Gibbs自由能减小,所以,式(10)也可以表示为:
dG=-zFEdξ
(12)
故摩尔反应Gibbs自由能为:
(13)
于是,根据热力学关系,有:
(14)
式中下标xini和xfin分别代表初态和终态中各相组分的物质的量分数保持不变,SB为组分B的偏摩尔熵。将式(13)对温度求偏导,并代入式(14),便得:
此式即为式(1)。
推导②:一个更为简单的推导方法是从下列电化学系统的热力学基本方程[3]出发:
(15)

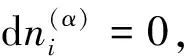
(16)
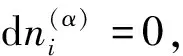
(17)
式中下标2代表终态。因此有:
(18)
若电池反应是从ξ=0的初态进行到ξ=1mol的终态,则式(18)可表示为:
此式即为式(1)。
2 问题二:原电池可逆做电功时吸收的热QR应该怎样表示?
由于ΔrGm=-zFE,将它代入式(1),可得:
(19)
因此,在一般物理化学教材中几乎无例外地有以下表示:
(20)
但是,这个公式是不恰当的,这可从式(20)中QR的单位看出。因为按照这个公式,QR的单位应为C·mol-1·V,即J·mol-1。而SI制规定,热量的单位只能是焦耳(J)[4]。尽管式(20)的意义是反应进度ξ=1mol时,原电池可逆做电功时吸收的热量,但是将热量的单位与摩尔热力学能一样表示为J·mol-1,这将使系统与环境传递的热量与物质的热力学能混为一谈,从而促使人们联想起早已被推翻的“热质论”,这样的表示显然是不可接受的。
我们认为,正确的表示是将式(19)改写成:
因此,
(21)
积分后得:
(22)
式中S0为积分常数。
已知,ξ=0时S=S0,所以有:
(23)
故原电池可逆做电功时吸收的热量当为:
(24)
由于ξ的单位为mol,这样QR的单位就不再是J·mol-1,而是J,符合SI制的规定。因此,式(24)才是QR的正确表示式。
参 考 文 献
[1] 杨喜平,刘建平,杨新丽,等.大学化学,2011,26(3):38
[2] Reid C E.Chemical Thermodynamics.New York:McGraw-Hill,1990
[3] 胡英,吕瑞东,刘国杰,等.物理化学.第5版.北京:高等教育出版社,2007
[4] 理科化学教材编审委员会物理化学编审组.物理化学教学文集.北京:高等教育出版社,1986

