辛伐他汀对压力超负荷大鼠心肌NADPH氧化酶基因表达的影响
李绍彩,史富华,黄宇玲,张晋霞
心肌重构可导致心脏肥厚和心室壁僵硬度增加,最终心功能恶化引起心力衰竭。NADPH氧化酶在心血管疾病的发生和进展中具有重要作用,如内皮功能障碍、动脉粥样硬化、糖尿病血管病变、肾素-血管紧张素-醛固酮系统(RAAS)相关的高血压和缺血性血管重塑[1]。血管NADPH氧化酶激活产生的活性氧增多形成的氧化应激在心肌肥大发展过程中的重要作用也越来越受到重视。NADPH氧化酶的催化亚基Nox家族在心血管细胞中包含多个亚型,它们在不同病理刺激因素作用下介导不同的病理过程。他汀类药物为羟甲基戊二酰辅酶A还原酶(HMG-CoA)抑制剂,是新一代调脂药物。目前应用于临床的主要有辛伐他汀(simvastatin,SIM)、洛伐他汀(lovastatin)、普伐他汀(pravastatin)和阿托伐他汀(atorvastatin)等。他汀类除具有调脂作用外还具有其他多种作用,如改善内皮功能、改善血液流变学、抑制炎症反应、稳定斑块、抑制平滑肌细胞增殖等作用,他汀类可以通过调节细胞因子的表达改善左室重塑。本研究通过腹主动脉结扎的方法复制心肌肥大模型,观察压力超负荷所致心肌肥大的过程中NADPH氧化酶不同Nox亚型的表达变化,以及辛伐他汀对压力超负荷大鼠心肌NADPH氧化酶基因表达的作用,探索他汀类药物抑制心肌肥大的可能机制。
1 材料与方法
1.1 动物 雄性SD大鼠220g~250g。由华北煤炭医学院实验动物中心提供。辛伐他汀为德国Merck Sharp&Dohme公司生产原粉。DMEM培养基购自美国Gibco公司。二甲基亚砜(DMSO)、牛胰蛋白酶为美国Sigma公司产品,胎牛血清(FBS)为美国Gibco公司产品。RNA逆转录试剂盒及PCR试剂盒为美国Fermentas产品:TrizolReagent购自美国Invitrogen公司。
1.2 方法 腹主动脉缩窄模型(AC)建立。戊巴比妥钠麻醉后固定,在分离的腹主动脉下方穿线,与-10号针头结扎在一起,使腹主动脉形成环形缩窄。检查结扎处,若搏动正常且腹后壁无出血,即可逐层缝合腹壁。肌注青霉素5×104U/只,以预防感染。假手术组除不结扎分离的腹主动脉外,其余操作均同手术组。术后常规饲养,正常饮水。
1.3 实验分组 将动物随机分为3组,每组10只。腹主动脉缩窄组(Model);假手术组(Sham);辛伐他汀组(SIM):腹主动脉缩窄术后1h给予辛伐他汀,每日清晨灌胃10mg/(kg·d)。在术后6周测量各组动物体重及血压,并进行相应指标的测定。
1.4 测定指标
1.4.1 心脏超声心动图 戊巴比妥钠腹腔内注射麻醉,用Hp Sonos2500型多功能超声检查仪及7.5MHz相控阵探头(美国惠普公司)检测左室收缩末内径(LVEDD)、舒张末内径(LVESD)等,计算左室射血分数(LVEF)、短轴缩短率(LVFS)。1.4.2 血流动力学检测 记录左室收缩末压(LVESP)、左室舒张末压(LVEDP)及左室内压最大上升、下降速率(±dP/dtmax)。
1.4.3 心肌肥大指数 各组动物摘取心脏。测量全心重、左心室重,计算心室重与体重比值(V/Bwt,Hermann Wilson’s公式)作为心肌肥大指数。
1.4.4 实时定量PCR法测定 Nox2、Nox4和p47phox的mRNA转录变化 。Trizol法提取心肌组织中的总RNA,测定总RNA纯度,参照反转录试剂盒(德国Fermentas公司)说明书,取2μg总RNA样本在10μL体系中进行逆转录反应。在20μL体系中扩增。Western印迹法检测 Nox2、Nox4和p47phox的蛋白表达的变化。
1.5 统计学处理 采用SPSS13.0统计软件,计量数据以均数±标准差(±s)表示,组间比较用单因素方差分析,两两比较用SNK法。
2 结 果
2.1 各组终点血压测定 各组大鼠实验终点进行血压测定,Sham 组为107.16mmHg±7.03mmHg,Model组为171.47 mmHg±18.93mmHg,SIM 组为121.82mmHg±12.56mmHg。其中,Model组血压较Sham组明显升高(P<0.01);V/Bwt的测定中,Model组(3.87±0.34)较Sham组(2.11±0.12)明显升高(P<0.01),SIM 组 V/Bwt(2.23±0.76)较 Model组下降,造模成功。
2.2 超声心动图指标 与Sham组相比,Model组的LVEF、LVFS明显降低(P<0.01),而LVEDD、LVESD明显增大(P<0.01);与 Model组相比,SIM 组的LVEF、LVFS明显升高(P<0.01),LVEDD、LVESD明显下降(P<0.01)。详见表1。
表1 各组大鼠超声心动图指标(±s)

表1 各组大鼠超声心动图指标(±s)
与Sham组比较,1)P<0.01;与 Madel组比较,2)P<0.01
组别 n LVESD(mm) LVEDD(mm) LVEF(%) LVFS(%)Sham组 12 3.78±0.32 6.97±0.11 89.97±7.62 62.19±5.34 Model组 12 8.13±0.591) 9.82±0.391) 52.15±3.241) 27.29±7.661)SIM 组 12 5.48±0.622) 7.24±0.942) 78.93±6.772) 49.33±5.612)
2.3 血流动力学指标 与Sham组相比,Model组的±dp/dtmax、LVESP明显降低 (P<0.01),LVEDP明显升高(P<0.01);与Model组相比,SIM 组±dp/dtmax、LVESP明显升高(P<0.01),LVEDP明显降低(P<0.01)。详见表2。
表2 各组大鼠血流动力学指标(±s)

表2 各组大鼠血流动力学指标(±s)
与Sham组比较,1)P<0.01;与 Model组比较,P<0.01
组别 n LVESP(mmHg) LVEDP(mmHg) +dp/dtmax(mmHg/s) -dp/dtmax(mmHg/s)Sham组 12 120.17±10.01 5.12±0.99 5 021.07±221.17 4 198.23±143.21 Model组 12 84.32±6.941) 12.43±1.541) 3 301.27±190.111) 2 435.23±333.211)SIM 组 12 98.72±5.432) 7.33±1.082) 4 651.67±298.172) 3 298.12±201.112)
2.3 各组Nox2、Nox4和p47phox表达的变化 与Sham组相比,Model组的大鼠心肌中Nox2、Nox4和p47phoxmRNA及蛋白表达升高(P<0.01);SIM组较 Model组心肌中Nox2、Nox4和p47phoxmRNA及蛋白表达明显下降(P<0.01)。详见图1、图2。
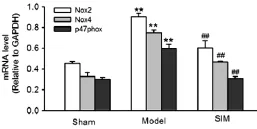
图1 Rail time-PCR法检测心肌组织中Nox2、Nox4和p47phox表达
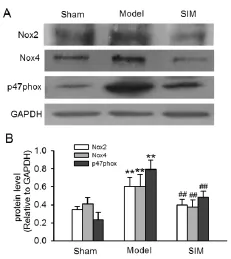
图2 Western blot法检测心肌组织中Nox2、Nox4和p47phox表达
3 讨 论
心肌肥厚是心脏对机械负荷及神经体液因子改变的代偿性反应,是发生心肌缺血、心律失常的独立危险因子[2],氧化应激在心脏病变中起重要作用[3-7]。氧化应激是由于机体细胞产生活性氧(ROS)增多,超过了体内抗氧化系统的消除能力所导致的氧化还原状态的失平衡[8]。高血压、动脉粥样硬化、糖尿病血管病变、心衰等心血管疾病病理发展过程中ROS主要来源于血管NADPH氧化酶,其与巨噬细胞NADPH氧化酶在结构上很相似,但表达和调节上又有很多区别[9,10]。NADPH氧化酶是体内唯一被发现的主要功能是产生ROS的酶,它对许多氧化还原敏感的信号通路有非常重要的作用。NADPH氧化酶产生的ROS可以使一氧化氮合酶(NOS)失偶联,还能激活黄嘌呤氧化酶,产生更多的ROS,使氧化应激放大[11]。心血管NADPH氧化酶的催化亚基是不同的Nox同系物和p22phox,它们组成膜复合体细胞色素b558,位于胞浆颗粒和浆膜上;调节亚基包括p47phox、p67phox、p40phox和Rac,它们可组成另一个蛋白复合体,存在于胞浆。NADPH氧化酶可被多种病理生理刺激因子通过不同的Nox亚基特异性激活,产生不同的下游效应[8,9,12]。心血管系统中主要有 Noxl、Nox2、Nox4,Nox2在内皮细胞(ECs)、成纤维细胞、心肌细胞中丰富表达;Noxl在血管平滑肌细胞(VSMCs)中高表达,但在ECs和心肌细胞中未发现;Nox4表达广泛,在ECs和心肌细胞中均高表达。不同的心血管疾病病理因子,如血管紧张素Ⅱ(AngⅡ)、细胞因子、机械张力等,刺激不同的Nox亚型激活,不同的Nox亚型激活后启动病理变化也可能不同。Nox2型NADPH氧化酶在AngⅡ依赖性的心肌细胞肥大、心内膜纤维化,以及压力超负荷型左心肥厚(LVH)诱发的心脏收缩失常等发展过程中起重要的介导作用。而压力超负荷所致的心肌细胞肥大却可能与Nox4有关[13,14]。
阿托伐他汀可以抑制同型半胱氨酸(Hcy)诱导的NADPH氧化酶活性,通过抑制重要的NADPH氧化酶Noxl亚基mRNA的表达、抑制内皮Nox4过表达和形成有活性的p22phox复合体而发挥细胞的抗氧化作用[15]。黎健等[16]研究显示高浓度(0.8g/L)LDL刺激 HUVEC时,Nox4表达上凋,细胞内 ROS生成增加。用辛伐他汀预处理再加高浓度LDL刺激时,Nox4表达下降,ROS生成量减少。提示辛伐他汀可下调HUVEC中Nox4的表达,降低ROS水平,进一步在体内证明辛伐他汀的抗氧化作用。
本研究结果表明,压力超负荷性所致心肌肥大过程中NADPH氧化酶亚型Nox2、Nox4和调节亚基p47phox基因及蛋白水平均增高,而辛伐他汀的干预可逆转这种增高,进而抑制ROS产生信号系统,导致NADPH氧化酶活性降低,改善肥大心肌的功能。他汀类药物具有独立于降脂作用以外保护肥大心肌细胞的作用。
[1] Care A,Brewer AC,Narayanapanicker A,et al.NADPH oxidases in cardiovascular health and disease[J].Antioxid Redox Signal,2005,8(5-6):691-728.
[2] Azzouzi H,Dewindt LJ.Heart spotting[J].Basic Res Cardiol,2008,103(3):228-231.
[3] McMurray J,Chopra M,Abdullah I,et al.Evidence of oxidative stress in chronic heart failure in humans[J].Eur Heart J,1993,14(11):1493-1498.
[4] Keith M,Geranmayegan A,Sole MJ,et al.Increased oxidative stress in patients with congestive heart failure[J].J Am Coll Cardiol,1998,31(6):1352-1356.
[5] Hare JM,Stamler JS.NO/redox disequilibrium in the failing heart and cardiovascular system[J].J Clin Invest,2005,115(3):509-517.
[6] Murdoch CE,Zhang M,Cave AC,et al.NADPH oxidasedependent redox signalling in cardiac hypertrophy,remodelling and failure[J].Cardiovasc Res,2006,71(2):208-215.
[7] Takimoto E,Kass DA.Role of oxidative stress in cardiac hypertrophy and remodeling[J].Hypertension,2007,49(2):241-248.
[8] Molavi B,Mehta JL.Oxidative stress in cardiovascular disease:Molecular basis of its deleterious effects,its detection,and therapeutic considerations[J].Curt Opin Cardiol,2004,19(5):488-493.
[9] Madamanchi N,Vendrov A,Runge MS.Oxidative stress and vascular disease[J].Arterioscler Thromb Vase Biol,2005,25(1):29-38.
[10] Morawietz H,Bornstein SR.Leptin,endothelin,NADPH oxidase,and heart failure[J].Hypertension,2006,47(5):e20.
[11] Landmesser U,Dikalov S,Price SR,et al.Oxidation of tetrahydrobiopterin leads to uncoupling of endothelial cell nitric oxide synthase in hypertension[J].J Clin Invest,2003,111:1201-1209.
[12] Cai H,Griendling KK,Harrison DG.The vascular NAD(P)H oxidases as therapeutic targets in cardiovascular[J].Sciences,2003,24:471-478.
[13] Bendall JK,Cave AC,Heymes C,et al.Pivotal role of a gp91phoxeontaining NADPH oxidase in angiotensin Ⅱ -induced cardiac hypertrophy in mice[J].Circulation,2002,105:293-296.
[14] Johar S,Cave AC,Narayanapanicker A,et al.Aldosterone mediates angiotensinⅡ-induced interstitial cardiac fibrosis via a Nox2-containing NADPH oxidase[J].Faseb J,2006,20(9):1546-1548.
[15] Bao XM,Wu CF,Lu GP.Atorvestatin attenuates homoeysteine induced apoptesis in human umbilical vein endothelial cells via inhibiting NADPH oxidase-related oxidative stress-triggered p38MAPK signaling[J].Acta Pharmacol Sin,2009,30(10):1392-1398.
[16] 黎健,高丹.NADPH氧化酶源性活性氧在糖尿病及其血管并发症发生中的作用机制[J].中国动脉硬化杂志,2009,17(7):562-564.

