氟苯尼考在大鼠肠内吸收特征试验
张建平,胡海英,张正全
(郑州大学药学院,河南 郑州450001)
氟苯尼考(Florfenicol)是20世纪80年代由先灵-葆雅公司研制的一种新型兽医专用氯霉素类广谱抗菌药,具有抗菌谱广、体内分布广泛,特别是无潜在的致再生障碍性贫血的不良反应等特点,对敏感菌所致的畜禽细菌性疾病治疗效果显著。2000年该药在我国批准为国家二类新兽药,但在目前的氟苯尼考使用中存在不同剂型,及同一剂型的不同生产厂家产品在疗效上存在巨大差异,因此有必要对氟苯尼考的溶解度行为、生物吸收行为进行研究,以期找到临床疗效差异的原因及为高效快速吸收的制剂提供参考。饱和溶解度是药物重要的物理化学参数之一,药物溶解度的大小及在吸收部位溶解的状态直接影响了药物的吸收。大鼠在肠内循环模型研究药物吸收的方法,能避免胃内容物和消化道固有生理活动对结果的影响,可较客观的反映药物在肠道内的实际吸收情况[1]。作者采用该模型考察了氟苯尼考的大鼠肠内的吸收情况,为该药设计适当的给药剂型提供一定参考。
1 材料
1.1 材料及仪器 氟苯尼考原料药(湖北龙翔药业有限公司,批号:101152);0.9%生理盐水(自制)、酚红(分析纯)、甲醇(色谱纯)及其他试剂均为分析纯;Angilent-1200高效液相色谱仪(美国安捷伦公司);AKasil C18色谱柱(Ajela博纳艾杰尔科技有限公司);UV-2102型紫外分光光度计(尤尼柯上海仪器有限公司);DV15cd分析天平(梅特勒-托利多仪器公司,上海)。
1.2 试验动物 清洁级健康大鼠,体重200g±10 g,购自河南省实验动物中心,合格证号:410118。
2 方法
2.1 溶液的配制 Krebs-Ringer(K-R)磷酸缓冲液[2]:配制 pH 值7.4的 Krebs-Ringer磷酸盐缓冲液;肠循环液:在K-R缓冲液中加入适量的酚红和氟苯尼考,使酚红浓度20μg/mL,氟苯尼考浓度分别为 50μg/mL、100μg/mL、200μg/mL,取 100 mL作为肠循环吸收液。
2.2 酚红测定方法的建立 酚红的最大吸收波长为558nm,用紫外可见分光光度计测定其浓度,图谱显示无其他杂质峰干扰,小肠对酚红基本无吸收,因此可以通过酚红的浓度校正循环液体积。
2.2.1 酚红标准曲线的绘制 用K-R缓冲液配制100μg/mL的酚红作为储备液,用K-R缓冲液稀释至不同浓度,得浓度分别为4.95、9.9、14.85、19.8、29.7μg/mL酚红标准溶液。分别吸取上述浓度标准液0.5mL,置试管中,加入0.2mol/L氢氧化钠溶液0.5mL,摇匀,微孔滤膜过滤,以0.2mol/L氢氧化钠溶液为空白,在558nm处测定其吸光度A。
2.2.2 回收率测定 分别配制4.95、14.85、29.7 mg/mL酚红标准液各3份,加入氟苯尼考原料药,使其浓度为200μg/mL,按“2.2.1”项下方法处理,测定吸光度A,计算3种浓度酚红的回收率。
2.3 氟苯尼考方法学建立 氟苯尼考最大吸收波长为224nm,其他成分在此波长处测定无干扰,用高效液相色谱法(HPLC)测定。色谱条件:Akasil-C18(4.6mm×250mm,5μm),流动相为甲醇-水(40∶60v/v),流速1mL/min,进样量20μL,柱温25℃。理论塔板数按氟苯尼考峰计算应不低于6×103,在该色谱条件下氟苯尼考峰与杂质峰的分离度应符合要求(如图1)。
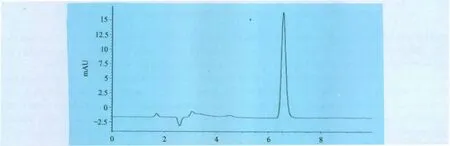
图1 氟苯尼考色谱图
2.3.1 标准曲线的绘制 氟苯尼考的标准曲线 精密称取氟苯尼考9.9mg,用甲醇溶解,配成100μg/mL储备液,分别吸取一定量的储备液用蒸馏水稀释至4.95、9.9、19.8、39.6、49.5μg/mL的氟苯尼考标准溶液,10 000r/min离心15min,取上清液按“2.2.2”项下条件进样检测。
2.3.2 精密度考察 取质量浓度分别为4.95、19.8、49.5μg/mL氟苯尼考标准溶液,加入酚红,使其浓度为20μg/mL,分别连续进样3次,连续进样3d,检测氟苯尼考的浓度,求得方法的日内、日间精密度。
2.4 氟苯尼考饱和溶解度的测定[3-4]分别精密量取蒸馏水、乙醇、丙酮各10mL,置25mL锥形瓶中,平行3份,分别于25℃逐渐加入氟苯尼考至溶液中出现不溶性粉末为止。25℃恒温振荡器中强力振荡(200r/min),48h后取出,取5mL,5 000r/min离心10min,精密量取上清液适量稀释,参照“2.2.2”项下色谱条件进样检测,得氟苯尼考的饱和溶解度;余下饱和溶解度样品继续强力振荡(200r/min),24h后取出,上述同法测定氟苯尼考的饱和溶解度,对比两次测定结果的一致性。
2.5 氟苯尼考在大鼠肠内吸收试验 取试验前禁食12h(自由饮水)的大鼠3只,乙醚麻醉后将其固定于固定台上,用取暖器保持37℃体温。沿腹部中线切开腹部(约3cm),在十二指肠上部和回肠下部各切一小口(尽可能避开血管),在十二指肠小口处插入直径约1cm的塑料管,用棉线扎紧。用蠕动泵将37℃的生理盐水缓缓注入肠管,洗去肠管内容物。洗净后在回肠下部的小口处插入相同的塑料管,并用棉线扎紧。将肠管两端的塑料管与蠕动泵相连,形成回路,将肠内残留的生理盐水尽量流尽后通入循环液,开始肠循环。回流开始后10min,从循环液中取样2份样品,一份1.0mL,另一份0.5 mL,分别作为药物和酚红的零点时间样品。其后每隔10min取相同2份,每次取样后立即补充1.5 mL酚红溶液(20μg/mL),取样至120min后停止回流,取出回流段小肠,测量其面积。
将1mL循环液样品10 000r/min离心15min后取上层液进样检测,根据标准曲线计算各个时间点循环液中药物浓度。另一份0.5mL循环液样品加入5mL 0.2mol/L氢氧化钠溶液,混匀,10 000 r/min离心15min,取上层液在558nm波长处紫外检测,计算循环液中酚红浓度。通过酚红浓度校正循环液体积,计算药物的剩余量。
3 结果
3.1 酚红方法考察结果
3.1.1 酚红标准液在558nm处测定其吸光度A
以吸光度A对分红浓度C进行线性回归,得回归方程:A=0.016 5C+0.001 0(R2=0.999 3),线性范围为4.95~29.7μg/mL。
3.1.2 由“2.2.2”项下方法测定酚红回收率 各个浓度的RSD均小于15%,说明酚红回收率良好,可以满足测定的要求。
3.2 氟苯尼考方法考察结果
3.2.1 由“2.3”项下色谱条件测定氟苯尼考标准溶液的峰面积。以峰面积Y对浓度C进行线性回归,得标准曲线,回归方程:Y=44.159C+23.375(R2=0.999 6),线性范围为4.95~49.5μg/mL。
3.2.2 由“2.3”项下色谱条件测定氟苯尼考的精密度。氟苯尼考的日内、日间精密度分别为5.79%、5.44%,均小于15%,可以满足测定要求。
3.3 氟苯尼考溶解度 由“2.3”项下色谱条件测定氟苯尼考溶解度,氟苯尼考在蒸馏水、乙醇、丙酮中的饱和溶解度分别为1.224、26.88、78.91mg/mL,在水中的溶解度较低,有机溶剂中溶解度增加。
3.4 氟苯尼考在体肠循环结果 循环结束后测得小肠的面积,并根据剩余量(S)=St-Wt;Wt=Ct-1·Vt-1-Ct·Vt;Vt=[(Vt-1-1.5)·Pt-1+1.5P]/Pt。
吸收率R=(初始药量-120min剩余药量)/初始药量×100%;
St-t时间药物的剩余量;Wt-t时间小肠吸收的药量;
Ct-t时间循环液中药物的浓度,可通过液相色谱法测得;Vt-t时间循环液体积;
Pt-t时间循环液中酚红的浓度,可通过紫外分光光度法测得。
计算结果见表1~3。
以剩余量(S)的对数对时间t作图得到1条直线(如图4),以直线斜率b求出吸收速率常数:ka=-2.303×60b,根据t1/2=-0.693/ka求出半衰期,根据吸收率公式求出吸收率,并且根据小肠面积计算出单位时间单位面积(h·100cm2)的吸收率,结果如表4所示。
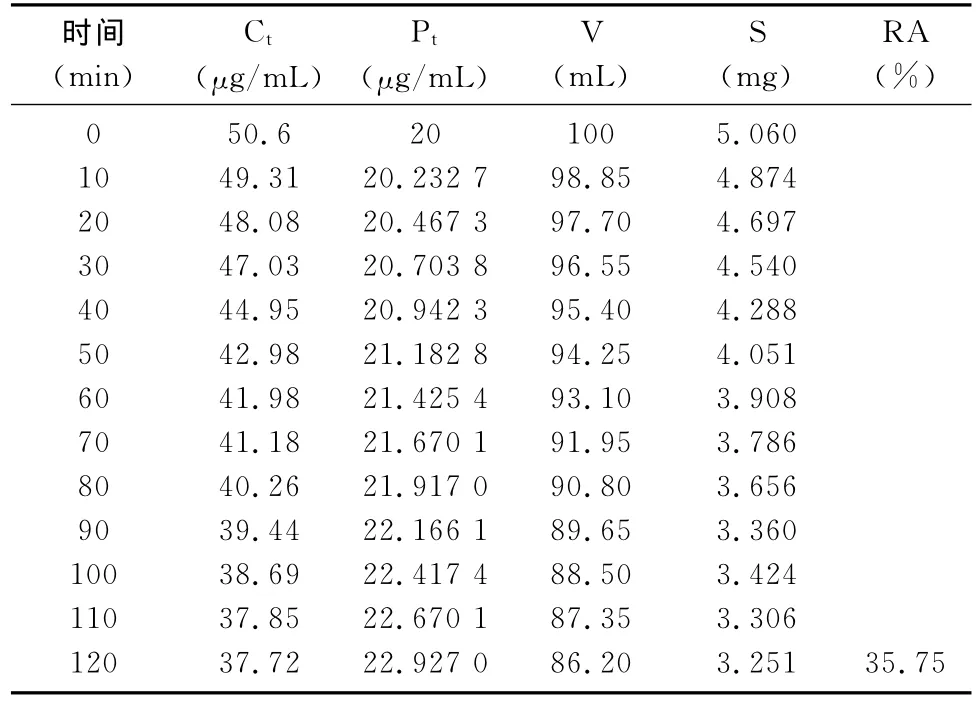
表1 低浓度氟苯尼考大鼠肠循环

表2 中浓度氟苯尼考大鼠肠循环
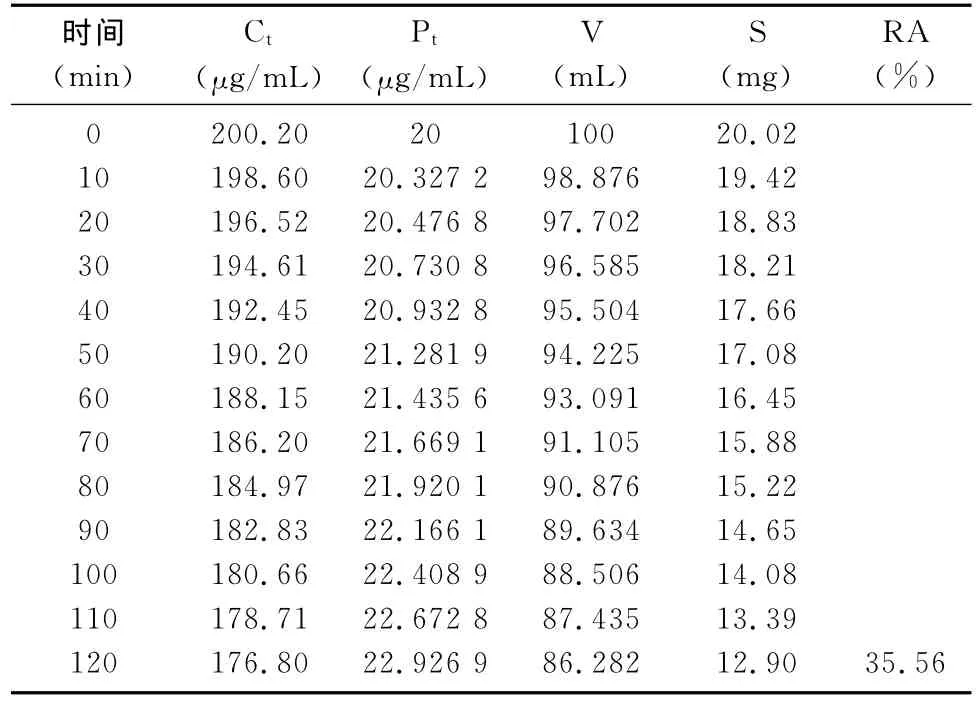
表3 高浓度氟苯尼考大鼠肠循环
由表1~3得氟苯尼考在大鼠肠内吸收结果,见表4。
由表4可知,低、中、高浓度大鼠肠吸收的吸收速率常数分别为0.221h-1、0.221h-1、0.235h-1,半衰期分别为3.135 7h、3.135 7h、2.961 5h,2h吸收率分别为为35.75%、36%、35.56% ,循环液中药物浓度下降与循环时间呈线性,说明氟苯尼考的吸收为一级动力学吸收过程,以被动扩散为主。

图2 lg(剩余量)与时间t的关系图

表4 氟苯尼考肠吸收
4 讨论
在肠内循环模型广泛应用于药物处方前的研究工作,该模型保证了胃肠道神经及内分泌输入的完好无损,且血液及淋巴液供应不变,大鼠胃肠道的生理状况与人相似,因此该模型较好地模拟预测体内吸收情况。由于试验中肠道能吸收或排泄水分,循环液体积会发生改变,因此本试验采用酚红来标定循环液体积(酚红为大分子络合物,小肠对其基本无吸收)。
本试验通过对氟苯尼考在不同溶剂中的溶解度测定,可知氟苯尼考水溶性低于脂溶性,推测氟苯尼考溶解度低,生物渗透性差,原料药的生物利用度可能较低。试验中建立的大鼠在肠内循环模型对氟苯尼考的吸收作了考察,原料药吸收率较低,进一步证明氟苯尼考生物利用度低,该药可能是生物药剂学中的第三类药物,即溶解度低,生物渗透性低,可考虑将其制成速释或长效制剂,有文献报道将氟苯尼考制成固体分散体[5]、纳米粒乳[6]、微球[7]等新型给药系统,对该药物的溶解性能和吸收有一定贡献。本试验通过对氟苯尼考溶解度及在肠内吸收的考察,达到了一定的预期目标,为今后氟苯尼考进一步研究及深层次的推广做出了一定贡献。
[1] Sally-Ann Cryan,Caitriona M.O'Driscoll.Mechanistic Studies on Nonviral Gene Delivery to the Intestine Using in Vitro Differentiated Cell Culture Models and an in Vivo Rat Intestinal Loop[J].Pharmaceutical Research,2003,20(4):569-575.
[2] G.Briseid,K.Briseid,K.Kirkevold.Increased intestinal absorption in the rat caused by sodium lauryl sulphate,and its possible relation to the cAMP system[J].Naunyn-Schmiedeberg's Archives of Pharmacology,1976,292(2):137-144.
[3] Fleming Martínez,Alfredo Gómez.Thermodynamic Study of the Solubility of Some Sulfonamides in Octanol,Water,and the Mutually Saturated Solvents[J].Journal of Solution Chemistry,2001,30(10):909-923.
[4] Chernorukov N G,Nipruk O V,Knyazev A V,etal.State of difficultly soluble uranosilicates MIHSiUO6·nH2O (M+=Li+,Na+,K+,Rb+,Cs+,NH+4)in saturated aqueous solutions[J].Radiochemistry,2004,46(5):452-456.
[5] 刘洋,赵修华,祖元刚,等.氟苯尼考PEG 6000固体分散体的无溶剂熔融法制备与分析[J].中国兽药杂志,2012,46(4):40-43.
[6] 刘安刚,李引乾,孙娇.氟苯尼考纳米乳的制备及品质评价[J].西北农业学报,2011,20(6):44-49.
[7] 李仲谨,田晓静,杨威.氟苯尼考淀粉微球的制备及缓释性能的研究[J].食品工业科技,2011,2(32):205-210.

