噻环乙胺对大鼠不同脑区内源性硫化氢浓度的影响
唐雨顺,李 林,邹 晶,李大鹏,蔺东启,姜 胜,范宏刚
(1.锦州医学院畜牧兽医学院,辽宁 锦州121001;2.沈阳农业大学畜牧兽医学院,辽宁 沈阳110866;3.东北农业大学动物医学学院,黑龙江 哈尔滨150030)
硫化氢(H2S)作为一种新型气体信号分子在自发性高血压、慢性阻塞性肺气肿、脓毒血症或出血性休克、阿尔茨海默病、肝硬化等多种疾病过程中及在组织器官缺血再灌注损伤中发挥着重要的病理、生理效应。神经系统内源性的H2S被认为是一种神经调质,其可以提高神经元NMDA受体调节的反应,易化海马长时程增强(LTP)的产生,从而调节学习和记忆;诱发星形细胞产生钙波,从而介导神经元及星形胶质细胞间的信号传递;增加抗氧化剂谷胱甘肽水平、抑制和清除神经系统内的多种氧化性物质等,对中枢神经系统功能有着重要的调节和保护作用[1]。
噻环乙胺(盐酸乙胺噻酚环己酮,Tiletaminehydrochloride),又名替来他明,为苯环己哌啶类静脉全麻药。将其与唑拉西泮1∶1复合制成(Telazol合剂),是国外应用于宠物、野生动物及试验用小动物最为广泛的复方麻醉合剂。目前对其中枢作用机制已进行了系列研究。本试验通过研究噻环乙胺麻醉下大鼠不同脑区内源性硫化氢浓度的变化,以探讨H2S与麻醉的关系。
1 材料与方法
1.1 试验材料 盐酸噻环乙胺,购自法国维克制药公司(纯度99.83%);DR2800可见光分光光度计(美国哈希公司)、VersaMax连续波长酶标仪(美国VersaMax公 司)、AvantiTM30Centrifuge高速冷冻离心机(Japanese Beckman Company)、202-1A 型恒温干燥箱(天津市泰斯特仪器有限公司)、微量移液器(芬兰勃雷公司);FeCl3·6H2O、3CdSO4·8H2O、对氨基二甲基苯胺等均为分析纯。
1.2 试验方法
1.2.1 试验动物及分组 84只180~200日龄Sprague Dawley(SD)大鼠,雌雄各半,体重228±35 g,由黑龙江中医药大学实验动物中心提供。先随机取12只大鼠为对照组,其余随机均分为高、低二个剂量组,分别腹腔注射噻环乙胺60、30mg/kg体重,每个剂量组又随机均分为麻醉组、恢复Ⅰ组和恢复Ⅱ组3个亚组。对照组腹腔注射生理盐水10 mL/kg体重,5min后断头取材,其他组均腹腔注射噻环乙胺(用前稀释成10mL/kg体重,以与对照组等容)。麻醉组在大鼠翻正反射消失后立即断头取材,恢复Ⅰ组在大鼠翻正反射恢复后断头取材,恢复Ⅱ组在大鼠直线爬行后断头取材。
1.2.2 内源性硫化氢测定 断头后迅速在生理盐水冰面上取脑,用4℃生理盐水将脑上的血迹冲洗干净,分离双侧大脑皮层、海马、小脑、中脑、丘脑,立即液氮冷冻保存,待测。检测时将分离出来的脑组织按体重/体积为1/10加入PBS,置于匀浆器中,充分研磨组织使其匀浆化,置于EP管中,3 000r/min(4℃)离心10min,取上清液600μL,加2mmol/L磷酸钾400μL,使总体积为1mL,放入25mL锥形瓶中进行反应,加入0.5mL 1%醋酸锌,用氮气将锥形瓶充盈30s后石蜡膜封口,反应体系从冰盒转移至37℃水浴摇床开始反应,90min后向其中加入50%三氯乙酸500μL终止反应,继续37℃水浴60 min后将锥形瓶内内容物转移至含3.5mL蒸馏水的试管中,加20mmol/L对苯二胺盐酸盐500μL,和30mmol/L三氯化铁400μL,室温孵育20min后转移至96孔板中,用酶标仪于670nm处测定吸光度。制作H2S标准曲线,根据标准曲线测出溶液中H2S含量[2]。
1.2.3 统计分析 数据以均数±标准差表示。用SPSS 13.0统计分析软件,对数据进行LSD多重分析比较,P<0.05为差异显著,P<0.01为差异极显著。
2 结果与分析
2.1 行为学变化 低剂量组注药后大鼠表现较为安静,逐渐表现为行动迟缓、共济失调、趴卧不动,最后翻正反射消失。少数大鼠有上体晃动现象。在麻醉期间部分大鼠有流涎、流泪现象。翻正反射恢复时,大鼠呼吸增快,给予一定刺激大鼠可出现体动,少数可斜线爬行或转圈运动。到大鼠可直线爬行时,行动比较缓慢,极少数大鼠有复睡现象。高剂量噻环乙胺组,翻正反射平均消失时间、翻正反射平均恢复时间及出现直线苏醒时间,较低剂量组极显著增加(P<0.01)。具体结果见表1。
表1 大鼠噻环乙胺麻醉行为学变化情况(min,±SD,n=36)

表1 大鼠噻环乙胺麻醉行为学变化情况(min,±SD,n=36)
**:高剂量组与低剂量组比较P<0.01;*:P<0.01或P<0.05
翻正消失时间 翻正恢复时间 出现直线爬行的时间低剂量噻环乙胺2.12±0.19 91.32±14.93 128.43±19.52高剂量噻环乙胺 1.37±0.24**247.90±33.06** 361.83±35.40**
2.2 噻环乙胺对大鼠不同脑区内源性H2S浓度的影响 大鼠腹腔注射噻环乙胺30mg/kg体重后,在麻醉组大脑皮层、中脑、海马的内源性H2S浓度明显降低,分别较对照组降低了43.01%(P<0.01)、17.11%(P<0.05)、23.99%(P<0.01)。在恢复I组上述脑区检测指标明显恢复,与对照组相比差异不显著((P>0.05))。到恢复Ⅱ组三脑区内源性H2S浓度基本上恢复至麻前水平。大鼠腹腔注射噻环乙胺60mg/kg体重后,在麻醉组大脑皮层、中脑、海马的内源性H2S浓度明显降低,分别较对照组降低了58.71%(P<0.01)、30.80%(P<0.01)、35.88%(P<0.01)。而在恢复Ⅰ组和恢复Ⅱ组三脑区的检测指标逐渐恢复,到监测结束除大脑皮层仍低于对照组(P<0.01),中脑和海马H2S浓度基本上恢复至麻前水平。高低两剂量组相同脑区间的H2S浓度进行比较发现,在大脑皮层、中脑、海马三脑区检测指标变化趋势相同,且呈现剂量依赖性关系。在不同剂量噻环乙胺麻醉全过程中小脑和丘脑两脑区内源性H2S浓度无明显变化。结果见表2。
从试验结果(表2)可看出,不论是高剂量组还是低剂量组,大脑皮层、中脑、海马的H2S浓度变化趋势与大鼠行为学变化呈现一定的规律,即麻醉时降低,在苏醒时逐渐恢复,当大鼠可以正常运动时,基本上恢复至麻前水平。而小脑和丘脑的H2S浓度变化趋势与大鼠行为学变化相比较,没有规律。
3 讨论
H2S最初被认为是一种具有臭鸡蛋气味的、无色有毒气体。但近些年的研究发现,H2S存在于大鼠等正常动物体内,而且在脑脊液内能够检测到较高的浓度的H2S[3]。进一步的研究报道表明,H2S能够通过一氧化氮(NO)介导的或非NO介导的机制舒张血管平滑肌、通过NMDA受体提高神经元兴奋性和抑制血管平滑肌细胞增殖、减轻血管重构等多种生物学效应。基于上述研究,H2S被认为是继NO、CO后新发现的第3种气体信号分子[4-5]。
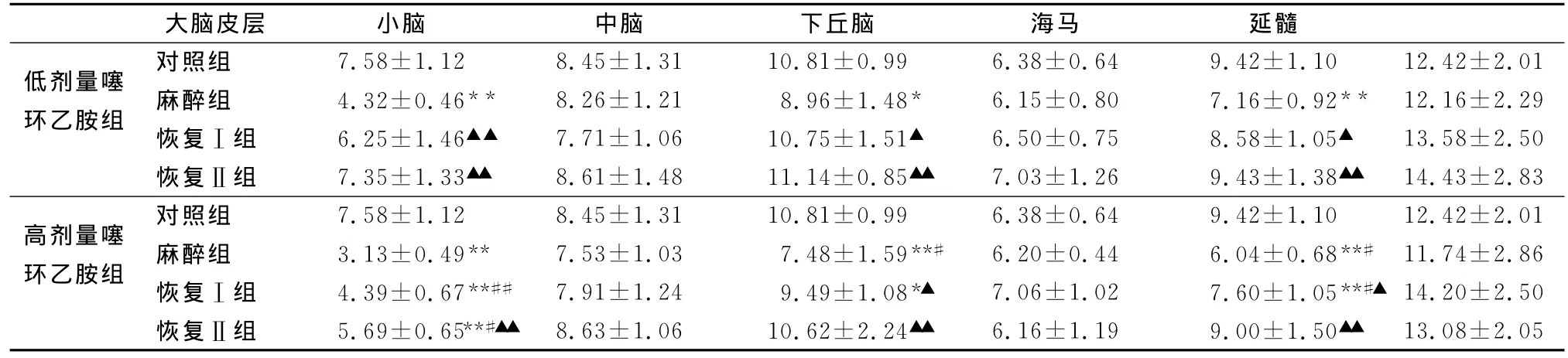
表2 噻环乙胺对不同脑区内源性H2S浓度的影响 (nmol·g-1,n=12)
目前国内外兽医学领域尚未发现有关麻醉药物对不同脑区内源性H2S浓度影响的文献报道。噻环乙胺主要作用于中枢神经系统非特异性NMDA受体,阻断兴奋性神经传导的NMDA受体是其产生麻醉作用的主要机制。以往的研究发现,H2S提高由NMDA受体介导的海马切片神经元对谷氨酸盐的反应,但不会引起神经元细胞内钙离子浓度的显著变化;然而,最近,Nagai等应用绿色钙-1(Calcium Green-1)作为钙离子敏感的荧光染色Ca2+成像(calcium imaging)观察,发现单独的 H2S可以诱发星形胶质细胞内钙波的产生。胶质细胞是通过提高细胞内Ca2+浓度及传递自发产生或因不同刺激产生的钙波这样的信号与周围细胞进行信息交换。局部应用H2S能增加神经胶质原纤维酸性蛋白(GFAP)阳性的星形胶质细胞内Ca2+的浓度,增加内流的Ca2+,同时减少细胞内贮存Ca2+的释放,诱发钙波。由此可见,H2S通过提高神经元对谷氨酸盐的反应并诱发星形胶质细胞产生钙波,从而介导神经元细胞和星形胶质细胞之间的信号传递,调节突触活动[6-7]。由此推测内源性 H2S降低,可能抑制细胞间信息传导。但其在噻环乙胺全麻过程中具体作用机理还有待进一步研究。
4 结论
内源性H2S可能参与噻环乙胺麻醉过程,在大脑皮层、中脑、海马表现出剂量依赖性、且与大鼠行为性变化具有一定的相关性。
[1] Enokido Y,Suzuki E,Iwasawa K,etal.Cystathionine betasynthase,a key enzyme for homocysteine metabolism,is preferentially expressed in the radial glia/astrocyte lineage of developing mouse CNS[J].Faseb J,2005,19:1854-1866.
[2] Eiichi Taniguchi,Maho Matsunami,Takeshi Kimurab.Rhodanese but not cystathionine-lyase is associated with dextran sulfate sodium-evoked colitis in mice:A sign of impaired colonic sul?de detoxification[J].Toxicology,2009(264):96-103.
[3] Lowicka E,Beltowski J.Hydrogen sulfide(H2S)-the third gas of interest for pharmacologists[J].Pharmacol Rep,2007,59(1):4-24.
[4] Tang C,Li X,Du J.Hydrogen sulfide as a new endogenous gaseous transmitter in the cardiovascular system[J].Curr Vasc Pharmacol,2006,4(1):17-22.
[5] 耿彬,杜军保,唐朝枢.内源性H2S-一种新的气体信号分子[J].生理科学进展,2002(3):255-258.
[6] Lin F,Xin Y J,Wang L,Ma,etal.Puerarin facilitates Ca(2+)-induced Ca(2+ )release triggered by KCl-depolarization in primary cultured rat hippocampal neurons[J].Pharmacol,2007,570:43-52.
[7] Kimura H.Hydrogen sulfide induces cyclic AMP and modulates the NMDA receptor[J].Biochem Biophys Res Commun,2006,267:129-133.

