奶牛乳房炎无乳链球菌的分离鉴定
史秋梅,张艳英,高桂生,高光平,邵新华,梁银聚,刘会然
(1.河北省预防兽医学重点实验室 河北科技师范学院动物科技学院,河北 昌黎066600;2.河北新华科级兽药有限公司,河北 栾城051430)
奶牛乳房炎是世界乳牛业的主要危害因素之一,无乳链球菌是牛群中乳腺炎的重要传染性病原菌,对规模饲养的奶牛,其危害是相当严重的。试验证明[1],犊牛时期饲喂含有无乳链球菌的乳汁,并在同栏饲养到产犊时,无乳链球菌性乳腺炎的发病率很高。据报道[2],无乳链球菌可引起新生儿败血症、脑膜炎、呼吸道和妇女生殖感染等。目前无乳链球菌对奶牛业和人的健康带来的危害已经引起了国内外学者广泛的关注。随着分子生物学技术的发展,PCR技术在检测致病菌方面得以广泛应用,并且展现出其快速、特异的优势和前景。国内外对无乳链球菌的检测方法已有一定的相关研究基础。吴润等[3]利用已知无乳链球菌16SrRNA序列设计特异性引物,通过PCR方法鉴定无乳链球菌。曹随忠等[4]根据Gen-Bank中收录的序列,参考无乳链球菌和停乳链球菌在16SrRNA与23SrRNA之间的间隔区设计引物,建立了特异性诊断方法。近年来,国内或国外都较普遍采用易操作、快速的PCR无乳链球菌检测方法[5],国内贾玉萍[6]等建立的巢式PCR方法,检测无乳链球菌16SrRNA,可检测到1CFU/mL的链球菌。这对于链球菌性乳房炎的早期预防及监测具有重要意义。因此,本试验将传统的细菌学鉴定方法和PCR快速检测方法相结合对无乳链球菌进行鉴定,旨在为奶牛乳房炎的防治奠定基础。
1 材料与方法
1.1 菌株 来自河北秦皇岛周边地区的某奶牛养殖场,患乳房炎病牛的牛乳,菌株编号同奶牛编号。菌株数编号为:1、2、3、4、5、6、7、8、9、10;奶牛编号依次为:2647、56、2、3089、0808、68303、0014、16635、52129、0547。无乳链球菌标准株(C55934)、猪链球菌标准株(C55914),购自中国兽医药品监察所。
1.2 主要试剂 普通营养琼脂(批号:20090808),6%兔鲜血营养琼脂常规制备,营养肉汤(批号:2090120)LB营养肉汤(批号:010709),细菌生化鉴定试剂盒,均购自北京陆桥生物技术有限责任公司。溶菌酶、蛋白酶K为Solarbio公司产品;Taqplus DNA Polymerase、dNTPs、Marker DL-600为 TaKaRa 公司产品;链球菌乳胶凝集标准诊断试剂盒(Streptococcus Gruping kit),批号:786536601,为法国梅里埃(BioMerieux sa)公司产品。
1.3 主要仪器 TGL-16G台式高速离心机,上海安亭科学仪器厂;恒温培养振荡器(ZHWY-103B),上海智城分析仪器制造有限公司;PCR扩增仪,东胜创新生物科技有限公司。
1.4 奶样采集 从河北秦皇岛周边地区某奶牛养殖场,选取10头牛的奶样作为试验样本。样本牛选择的标准:奶产量与以往比较有所下降;乳房和乳头都无明显临床型乳房炎表现;未患传染病(如结核病、布鲁菌病等)。每头样本奶牛采集奶样10mL。采样前,用温水对乳房进行清洗,然后用0.2%新洁尔灭擦洗,最后用75%酒精消毒乳头。挤奶样时,去掉头2~3把奶以避免污染一些杂菌。将奶样分别装入灭菌的小瓶中,加盖封紧,标明牛号、乳室和日期,储放冰盒送实验室,立即进行检测。
1.5 形态学检查 将每份乳样分别离心集菌,沉淀进行涂片,革兰染色后置于显微镜下观察细菌的形状、染色特性,初步判断样本中有无链球菌。
1.6 细菌的分离培养 将奶样离心集菌,在无菌条件下取离心沉淀乳样划线接种于5%兔鲜血琼脂中37℃培养24h后观察菌落形态。在兔鲜血琼脂平板中挑取疑似菌落经革兰染色后镜检,同时挑取疑似菌落接种兔鲜血琼脂培养基上纯培养。
1.7 生化鉴定 无菌挑取上述纯培养物,进行以下项目的生化鉴定:过氧化氢酶试验、乳糖、七叶苷、甘露醇、水杨素、棉子糖、山梨糖、单糖、木糖、纤维二糖发酵试验等。
1.8 兰氏分群 将上述待检菌株接种于鲜血培养基,经过37℃培养24h,然后分离菌株选取2~3个菌落在含有0.4mL酶消化液的EP管内,振荡混匀,37℃恒温孵育10min。将试剂盒内的A、B、C、D、F、G型乳胶混匀后,分别取一滴滴在反应卡片的相应位置,再取消化好的菌液滴一滴于乳胶滴旁,用混匀棒将两滴液体充分混匀,轻微晃动2min后判定结果,如果出现明显的凝集颗粒为阳性,如果出现凝集的均匀混悬液为阴性。并设生理盐水空白对照、A~G群混合阳性抗原对照和标准无乳链球菌C55934、猪链球菌C55914株对照。
1.9 巢式PCR检测
1.9.1 基因组DNA的提取 分别制备无乳链球菌标准菌株DNA、临床分离菌株DNA模板。方法如下:挑取上述细菌纯培养物的单个菌落接种于LB液体培养基中,37℃振荡培养过夜,收集菌液并分装于1.5mL离心管13 000r/min(4℃)离心30s,将菌体悬于400μL 50mmol/L乙二胺四乙酸(EDTA)液,后加入50μL溶菌酶(1 000mg/mL)混匀放于37℃温育30~60min,期间缓慢摇动。然后加入250μL STEP溶液,50℃缓慢摇动至少2h,分两管做。0.7 mL溶液中加入1mL纯化树脂颠倒混匀5~6次,室温下温育3min其间颠倒混匀1次,5 000r/min离心3s,收集沉淀。用1mL GN结合液将纯化树脂颠混匀5 000r/min离心3s,收集沉淀。用0.5mL漂洗液漂洗纯化树脂两次颠倒混匀5 000r/min离心,收集沉淀。用0.8mL乙醇悬浮纯化树脂装入离心柱13 000r/min离心1min。然后倒掉收集管中的乙醇放入离心柱内,转速为13 000r/min离心1min,尽量除尽乙醇然后将纯化柱套入干净的1.5mL离心管中,开盖放置2~3min,加入100mLTE缓冲液与纯化树脂上(不能粘在管壁上),室温放置3min。13 000r/min离心2min,最后取2μL(1%琼脂糖电泳)检测,-20℃保存备用。
1.9.2 扩增 从GenBank中查得链球菌属16S rRNA的序列,用DNAStar软件进行比较分析,在保守区设计链球菌属的通用引物L1和L2;在保守区之间,无乳链球菌的可变区设计特异引物A1和A2。引物由上海生工生物工程技术服务有限公司合成。引物序列:L1:5′-GCGTGCCTAATACATGCAA-3′;L2:5′-TACAAC-GCAGGTCCATCT-3′。A1:5′-TTTGGTGTTTACTAGACTG-3′;A2:5′-TGTGTTAATTACTCTTATGCG-3′。外侧扩增25μL体系用引物L1和L2对提取的DNA进行PCR扩增。PCR混合液组成:10×PCR Buffer 2.5μL,4×dNTP 2μL(2.5 mmoL/μL),1μL(25mmoL/μL)MgCl2,引物 L1和L2各2μL(10pmoL/μL),rTaqDNA酶1.5U,模板2μL,加双蒸水补足25μL。同时设定阴性对照和阳性对照。扩增反应条件:94℃变性4min,94℃45s,52℃45s,72℃45s,共25个循环。最后72℃延伸5 min。PCR产物5μL用1.0%琼脂糖凝胶进行电泳。90V电泳30min,紫外灯下观察结果。以DL-2 000作为分子质量标准。内侧扩增25μL体系用A1和A2引物进行PCR扩增。取外侧扩增产物2μL作为模板,反应体系其他组成及条件同外侧扩增。
2 结果
2.1 形态学检查 菌落较小,呈β型溶血。经革兰染色后镜检可见菌体呈圆形或卵圆形,排列成短链状,革兰染色阳性。
2.2 生化鉴定 各项生化反应结果见表1。
无乳链球菌易溶解过氧化氢酶,能发酵乳糖呈阳性,在6.5%NaCl中不生长,七叶苷、甘露醇、山梨醇、棉子糖、水杨素呈阴性。碳源与氮源利用方面:根据该试验判断出6株菌为B群链球菌,符合无乳链球菌的特征。因此2547、2、68303、3089、56、0808编号的细菌为无乳链球菌。
2.3 兰氏分群 各菌株分群结果见表2。

表1 无乳链球菌生化鉴定
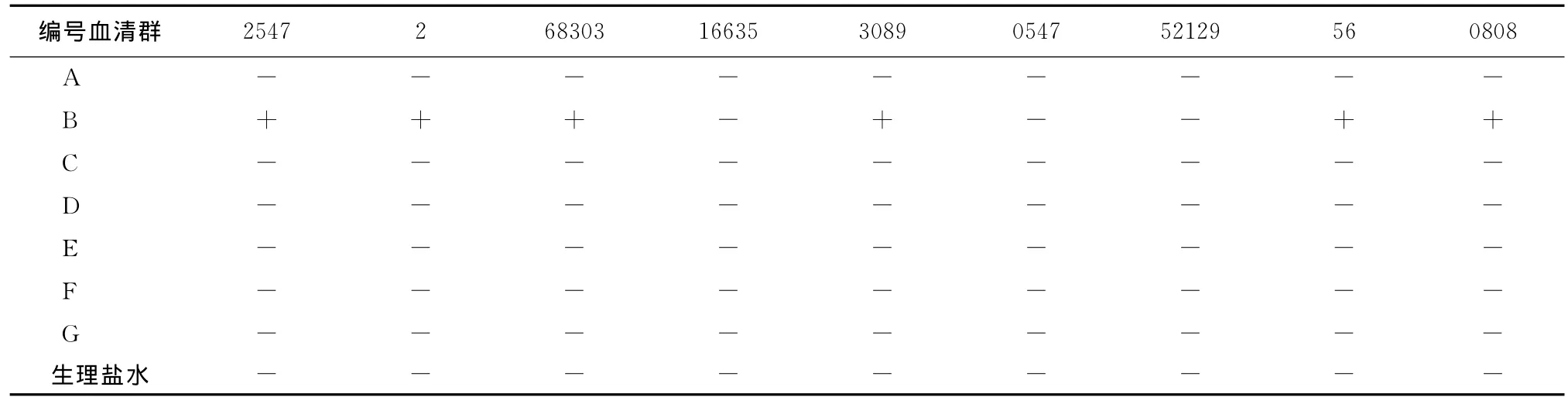
表2 各菌株分群
通过兰氏分群试验证明其细菌是B群的有2547、56、2、3089、0808、68303。上述编号均为无乳链球菌。其中68303为微弱凝集的B群。标准菌株无乳链球菌C.55934为兰氏B群,猪链球菌C55914为兰氏D群。
2.4 基因组DNA的提取 通过电泳观察得出提取的菌株基因组DNA带整齐、大小一致。通过采用巢式PCR检测,用引物L1和L2外侧扩增的产物,分离株2547、2、68303、3089、56、0808在207bp处有带,无乳链球菌C55934扩增阳性,猪链球菌C55914扩增阳性,见图1。用引物A1和A2内侧扩增的PCR产物标准菌株无乳链球菌C55934和分离株2547、2、68303、3089、56、0808有121bp的目的条带,阴性对照株猪链球菌C55914则没有,见图2。
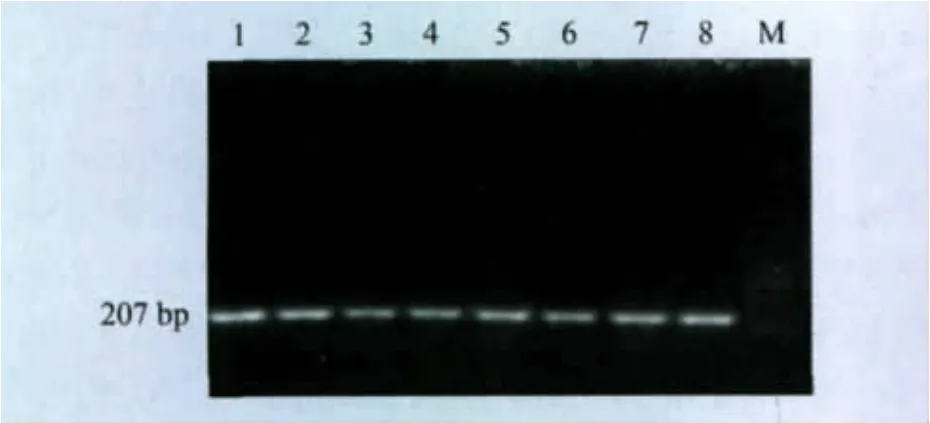
图1 巢式PCR无乳链球菌外侧扩增产物
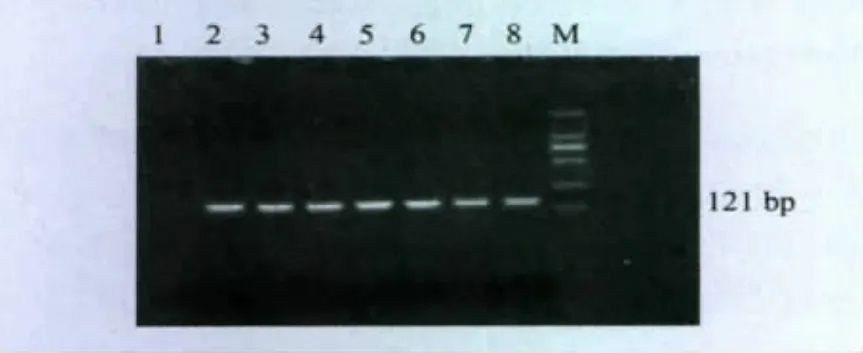
图2 外侧扩增产物无乳链球菌内侧扩增产物
3 讨论
本试验采用巢式PCR检测方法对无乳链球菌进行了检测,结果均得到预期相符的207bp的目的片段,通过PCR检测方法检测结果与生化鉴定结果的符合率达100%。
奶牛乳腺炎诊断是奶牛乳腺炎防治的第一重要步骤。传统的检测无乳链球菌的方法有理化检测法和体细胞间接检测法,但检测的对象只是牛奶中体细胞及炎性细胞碎片。其原理是患有乳腺炎的奶牛因乳腺炎症反应,受损的乳腺细胞和炎性细胞崩解成碎片。炎症严重者,则细胞碎片越多,根据诊断液与碎片反应强弱的程度,可判断炎症的等级。该法虽非常实用,但不具有特异性,且通过目测判定等级,准确度不很高。本试验结果表明,我们采用取奶样作细菌分离培养,再结合生化特征鉴定及血清学鉴定,将初步鉴定为无乳链球菌的菌株;过夜培养后巢式PCR检测方法检测结果与生化鉴定结果的符合率达100%。国内许多地方都分离到了无乳链球菌,李宏胜等[7]采集了成都、兰州、郑州、济南、哈尔滨、南昌6个城市各种类型乳房炎奶样280头份(340个乳室),经细菌分离鉴定共分得12种316株菌,无乳链球菌总的分离率为15.56%。双金等[8]共检测内蒙古泌乳牛283头次1 078个乳区,隐性乳房炎的头阳性率为61.84%,无乳链球菌的分离率为20.83%。刘佩红等[9]对通过上海32个规模化奶牛场433份奶样的分离鉴定,共分离出254株细菌,其中无乳链球菌的分离率9.8%。
本试验利用链球菌属(Streptococcus)16S rRNA基因的保守区设计通用引物作为链球菌属的阳性控制,在保守区内的可变区设计无乳链球菌特异的引物。试验结果表明,通过奶样中无乳链球菌的增菌培养,简便、快速提取DNA和特异性PCR反应,可以检测到奶样中的无乳链球菌,可以用作牛群中无乳链球菌感染的早期流行病学调查。
[1] 聂建超.谈谈奶牛乳房炎的病因及防治[J].吉林畜牧兽医,2002,9:22-24.
[2] 马保臣,杜平,蒋世峰,等.奶牛乳腺炎的研究进展[J].动物科学与动物医学,2002,19(9):21-24.
[3] 吴润,郝保青.奶牛隐性乳房炎的主要病原菌的PCR鉴定[J].中国牛业科学,2006,36(8):1202-1208.
[4] 曹随忠,杜立新,赵兴绪,等.16S-23SrRNA间隔区在奶牛乳房炎诊断中的应用[J].中国畜牧兽医,2005,32(2):26-27.
[5] 焦振泉,刘秀梅.细菌分类与鉴定的新热点:16S~23SrDNA间区[J].微生物学通报,2001,28(1):85-89.
[6] 贾玉萍,周东顺.巢式PCR检测无乳链球菌16SrRNA方法的建立及应用[J].农业生物技术学报,2005,5:668-671.
[7] 李宏胜,郁杰,罗金印,等.我国部分地区个体奶牛场乳房炎细菌学调查[J].中兽医医药杂志,2002,6:14-17.
[8] 双金,嘎尔迪,包鹏云,等.奶牛隐性乳房炎的发生规律及其致病菌的分离鉴别与药物敏感性试验[J].内蒙古农业大学学报,2001,22(1):18-23.
[9] 刘佩红,黄忠,王健,等.奶牛乳腺炎的分离鉴定及耐药性分析[J].中国奶牛,2004,1:43-45.

