1株鸿雁源新城疫强毒的分离鉴定
陈雪龙,吴海燕,王忠伟,郭 丽,齐艳萍,2
(1.黑龙江八一农垦大学动物科技学院,黑龙江 大庆163319;
2.农业部农产品加工质量监督检验测试中心(大庆),黑龙江 大庆163319)
新城疫病毒(NDV)是一种严重危害养禽业的重要传染病病原,曾经对全球养禽业造成严重经济损失。过去一般认为水禽对NDV的易感性较差,多呈隐性感染[1]。然而自20世纪90年代以来,国内外愈来愈多的报道显示NDV对水禽的致病力逐渐增强,鹅、鸭等水禽已成为易感禽类[2]。
2012年5月,黑龙江大庆某大雁养殖场的大雁(后鉴定为鸿雁)中发生了以轻微呼吸道症状和稀便、腿麻痹、站立不稳等为主要症状的疾病,使用多种抗生素治疗无效。为了查明发病原因,采集了发病大雁病料,进行了病原分离鉴定工作。
1 材料与方法
1.1 主要试剂及试验动物 TRIzol试剂、M-MLV反转录酶、RNasin、dNTP,购自Invitrogen公司;ExTaqDNA 聚合酶、DNA Marker(DL-2 000),购自宝生物工程(大连)有限公司。NDV标准阳性血清、H5、H9亚型禽流感病毒(AIV)标准阳性血清、减蛋综合征病毒(EDSV)标准阳性血清,购自中国农业科学院哈尔滨兽医研究所;阴性血清,购自瑞普生物药业有限公司。PBS、1%鸡红细胞、双抗(浓度为4 000IU(μg)/mL的青霉素与链霉素)按常规方法本实验室自制。
实验用1日龄及6周龄SPF雏鸡和10日龄的SPF鸡胚,均由中国农业科学院哈尔滨兽医研究所实验动物中心提供。
1.2 病料处理 现场采集大庆某大雁养殖场发病鸿雁(Ansercygnoides)的脑、脾、肺、肠等组织。其后于实验室内将病料剪碎研磨,用灭菌PBS按照体积比1∶4制备悬液,反复冻融3次后,8 000r/min离心10min,取上清加入双抗,37℃作用1.5h,-20℃保存备用。
1.3 病毒分离与血清学鉴定 将病理处理后的上清液接种鸡胚,每胚接种200μL,共接种4个10日龄SPF鸡胚,每天照蛋3次,弃去24h内死亡的鸡胚,收获36~96h死亡鸡胚的尿囊液进行血液凝集试验(HA),若有血凝性再与NDV阳性血清、AIV阳性血清(H5/H9)和EDSV阳性血清进行血凝抑制(HI)试验,操作方法按文献[3]方法进行。
1.4 分离株F基因RT-PCR鉴定
1.4.1 引物设计 参照GenBank中发表的鸭NDVF基因序列设计一对通用引物,用于扩增F基因,序列如下:上游引物 P1:5′-GAGGTTACCTCYACYAAGCTRGAGA-3′,下游引物P2:5′-TCATTAACAAAYTGCTGCATCTTCCCWAC-3′,预计目的扩增片段为535bp。
1.4.2 RT-PCR反应 取尿囊液,按照 TRIzol试剂说明提取病毒RNA,加入适量的DEPC处理水溶解。在 PCR 管中加入 RNA 10.5μL,10μmol/L dNTP 2μL,20μmol/L 上游引物2μL,5×RT Buffer 4μL,40U/μL RNasin 0.5μL;200U/μL M-MLV 1μL,反应总体积20μL,混匀在42℃水浴中作用1.5h。PCR反应体系采用25μL体系,模板cDNA 3μL,10×Buffer 3μL,F1、F2 引物各1 μL,dNTP 3μL,Ex-TaqDNA聚合酶1μL,DEPC水13μL。PCR反应条件为95℃3min,94℃40s,54℃30s,72℃1min,进行30个循环后,72℃延伸10min,最后取PCR产物5μL,在10g/L琼脂糖凝胶上电泳观察结果。
1.5 NDV致病指数测定 参照文献[4]方法进行致死鸡胚平均死亡时间(MDT)、1日龄雏鸡脑内接种致病指数(ICPI)和6周龄雏鸡静脉接种致病指数(IVPI)等NDV致病指数的测定。
1.5.1 MDT的测定 将尿囊液用灭菌PBS作10倍稀释成10-6~10-10,每个稀释度经尿囊腔接种6个10日龄SPF鸡胚,0.1mL/个,置37℃培养,弃去24h内死亡鸡胚,每日照蛋3~4次,连续观察7d,记录使所有鸡胚死亡的最高稀释度致死鸡胚的平均时间(MDT)。
1.5.2 ICPI的测定 用灭菌PBS(1∶10)稀释病毒尿囊液,接种10只1日龄的非免疫雏鸡,每只脑内接种0.05mL。每天在与接种相应的时间观察鸡群的健康状况,并对试验鸡进行评定:正常记0分,发病记1分,死亡记2分。连续观察8d,最后计算ICPI。
1.5.3 IVPI的测定 将分离株尿囊液以PBS稀释10倍,翅静脉接种6周龄SPF鸡10只,0.1 mL/只,每天在与接种相应的时间检查鸡群的健康状况,连续观察10d。记录正常、发病、麻痹与死亡鸡的每日累计数,最后计算IVPI。
2 结果
2.1 鸿雁临床症状及剖检变化 现场观察病雁表现一定程度的精神不振,食欲和饮水减少;鼻孔流出少量清亮水样液体,张口伸颈呼吸;腹泻,排白色、黄色或黄白色稀便;翅膀下垂,双腿轻微麻痹无力,站立不稳或者不愿行走。
经剖检观察:腹段食管黏膜有白色坏死点;肠黏膜严重坏死脱落并伴有较为严重的出血;脾脏色暗红并肿大,可见不规则的灰白色坏死点;肺脏表面有纤维素性渗出物形成纤维性假膜;肝脏边缘散在有针尖大出血点和黄白色坏死点,胆囊壁增厚并扩张;腺胃乳头有出血点,与肌胃交界处出血或有溃疡灶;心外膜和心内膜均有出血点,并有白色坏死灶;脑轻微水肿、充血;其他组织或器官无肉眼可见病变。
2.2 病毒的分离与初步鉴定结果 鸡胚接种后,大多数在接种后45~70h死亡,胚体有出血现象,尤其胚体的头、颈和爪出血严重。收集死亡鸡胚的尿囊液,HI试验测得死亡鸡胚的尿囊液均具有血凝价(6~9lb)。分离株的这种血凝性可被NDV标准阳性血清所抑制,而不能被流感 H5、H9亚型AIV和EDSV阳性血清所抑制,说明分离毒为NDV,命名为DQBT01。
2.3 分离株F基因RT-PCR扩增鉴定结果 对病毒尿囊液进行F基因的RT-PCR扩增后,将扩增产物经琼脂糖凝胶电泳后,检测结果如图1所示:

图1 NDV F基因RT-PCR扩增结果
如图1所示,对照DNA相对分子质量标准,NDV特异性检测引物的扩增片段长度为535bp,扩增结果与预计片段大小相同,因此可以进一步判断此分离毒为NDV。
2.4 NDV的致病指数测定结果
2.4.1 MDT的测定结果 分离毒株尿囊液接种10日龄SPF鸡胚后的死亡情况见表1,从表中可见,引起全部鸡胚致死的最高稀释度为10-8,经计算,MDT为55h。
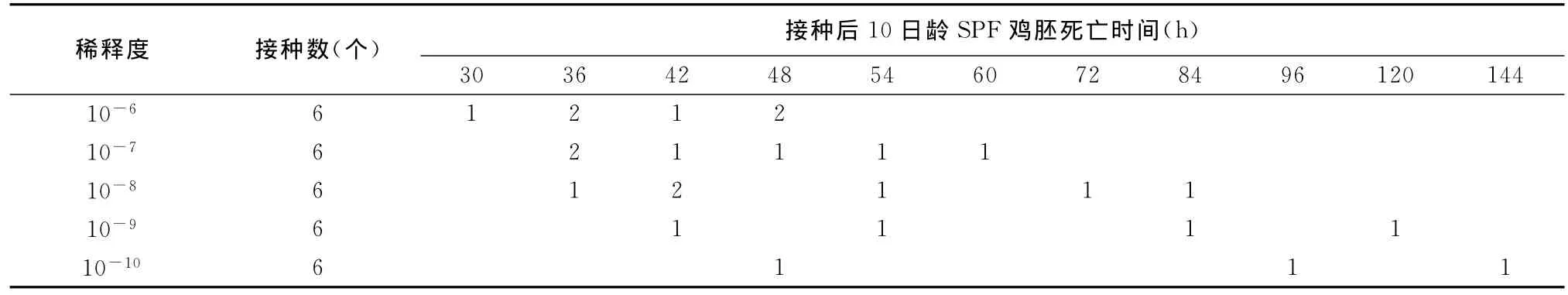
表1 DQBT01分离株MDT测定
2.4.2 ICPI测定结果 1日龄雏鸡脑内接种分离病毒发病及死亡情况见表2,雏鸡接种后2~4d后出现典型症状进而死亡。雏鸡剖检见腺胃黏膜充血,十二指肠充血、出血。经计算ICPI为1.68。

表2 DQBT01分离株ICPI测定
2.4.3 IVPI测定结果 6周龄SPF鸡静脉接种分离病毒发病及死亡情况见表3,接种后第2天雏鸡开始出现症状并有2只死亡,在接种第四天SPF鸡全部死亡,剖检主要在腺胃和肌胃交界处有出血斑或出血带,腺胃黏膜肿胀充血。按公式计算:IVPI为2.54。
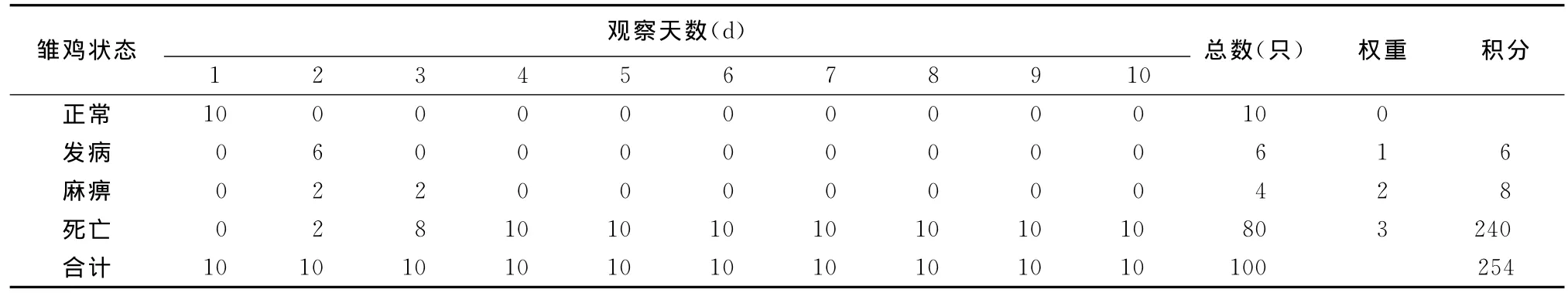
表3 DQBT01分离株IVPI测定
3 讨论
本试验从发病死亡的鸿雁体内分离得到1株病毒,该病毒可使SPF鸡胚出现全身出血性变化,死亡鸡胚的尿囊液经过血清学试验以及NDVF基因RT-PCR扩增证明该病毒株为 NDV,命名为DQBT01。该病毒MDT、ICPI和IVPI致病指数分别为55h、1.68、2.54,按照 OLE标准属于 NDV强毒株。
NDV对鸟类感染宿主范围比较广,目前经过报道的野禽已达200多种[5-7],一般情况下,野禽在自由生活状态下对NDV的有较强的抵抗力,因此所分离的NDV大部分为弱毒株。而在人工饲养条件下,多种野禽可以感染NDV并发病,其涉及的公共卫生问题也受到了高度关注。目前在我国越来越多的野禽感染NDV并且发病的报道越来越多[8],涉及的物种也开始增多,大雁感染NDV并且发病的报道也有少量报道[9],而前人认为水禽对于NDV可以携带而不发病,因此认为水禽对NDV有较强的抵抗力。然而,随着鹅、鸭、大雁等水禽感染NDV并且发病的报道逐渐增多,说明在我国NDV的致病性有增强的趋势[10]。同时NDV在野禽和家禽间存在相互感染并传播的现象,并且在相互传递的过程随着宿主免疫系统的选择压力不同,NDV存在着一定程度的变异,这种变异可能导致毒力变强,而这种变异趋势已引起研究者的高度关注,如有研究报道,野禽中自然存在的无毒力毒株,但当其在鸡群中传播时,则具有变成高致病性病毒的能力[11],这对于我国的养禽业是严重的威胁。
本次从鸿雁体内分离出NDV强毒株,为野生水禽在人工饲养条件下感染NDV并发病提供了相关依据,提示禽类养殖业,特别是水禽养殖业,对于NDV的防疫要引起足够的重视,这对于我国控制ND的传播和流行,降低养殖户的损失具有重要意义。
[1] Vickers M L,Hanson R P.Newcastle Disease Virus in waterfowl in Wisconsin[J].JWildDis,1982,18(2):149-158.
[2] Liu X F,Wan H Q,Ni X X,etal.Pathotypical andgenotypical characterization of strains of Newcastle disease viruses isolated from outbreaks in chicken and goose flocks in some regions of China during 1985-2001[J].ArchivesofVirology,2003,148(7):1387-1403.
[3] 中国兽药典委员会.中华人民共和国兽药典[M].第三部.北京:中国农业出版社,2005.
[4] OLE.哺乳动物、禽类和蜜蜂A类和B类疾病诊断试验和疫苗标准手册[M].农业部畜牧兽医局译.北京:中国农业科技出版社,1996:140-146.
[5] Seal B S,Wise M G,Pedersen J C,etal.Genomic sequences of low-virulence avian paramyxovirus-1(Newcastle disease virus)isolates obtained from live-bird markets in North America not related to commonly utilized commercial vaccine strains[J].VetMicrobiol,2005,106(1-2):7-16.
[6] Nolen R S.Exotic Newcastle disease strikes game birds in California[J].J Am Vet Med Assoc,2002,221(10):1369-1370.
[7] 胡北侠,王艳,杨少华,等.产蛋下降鸭群强毒新城疫病毒的分离鉴定与分子特征[J].中国兽医杂志,2012,48(4):10-12.
[8] 杜景娇,薛强,邹明强,等.新城疫检测技术的研究新进展[J].中国畜牧兽医,2012,39(2):187-191.
[9] 张爽,李丹,李志萍,等.大雁新城疫病毒的分离鉴定[J].吉林畜牧兽医,2011,32(5):7-9.
[10]刘文斌,崔尚金,刘立奎,等.东北地区不同宿主NDV分离株的系统发育进化分析[J].中国兽医杂志,2005,41(7):3-6.
[11]于圣青,丁铲,Noriko Kishida,等.新城疫病毒某水禽分离株经鸡体传代后由非致病型转变为速发型的研究[J].中国预防兽医学报,2003,25(1):59-64.

