1株貉源犬瘟热病毒的分离鉴定
吕九云,张彦龙
(东北林业大学野生动物资源学院,黑龙江 哈尔滨150040)
犬瘟热病毒(CDV)属于副黏病毒科麻疹病毒属,是一种具有囊膜的单股负链RNA病毒,它能导致犬科、鼬科、浣熊科、大型猫科和淡水海豹等发病,以高度致死性且不具有免疫保护为感染性特点[1-2]。对于毛皮动物养殖业来说,犬瘟热一直没有得到很好的控制,它常导致60%~100%的死亡率,对发病地区毛皮动物产业造成了近乎毁灭性的打击,特别是近几年,呈现了已免疫的毛皮动物种群仍然大规模发病的新流行特点[3]。乌苏里貉在毛皮动物中对犬瘟热最为敏感,很多用于预防犬、狐狸等动物的犬瘟热疫苗不适合乌苏里貉犬瘟热的预防,研究适合
乌苏里貉犬瘟热防治的疫苗摆在我们面前。因此,具有较高免疫原性的貉源犬瘟热弱毒对于貉子犬瘟热的防治具有重要意义,本试验另辟途径,从未发病的貉子中分离毒株进而为貉源犬瘟热疫苗的研制奠定基础。
1 材料与方法
1.1 菌株、毒株及实验动物 非洲绿猴肾细胞(Vero)本室保存;E.coliDH5α宿主菌,购自TaKaRa宝生物工程(大连)有限公司;试验用乌苏里貉,黑龙江省哈尔滨市周边养殖场。
1.2 主要试剂和仪器 胶回收试剂盒,TaqDNA聚合酶,dNTP,购自北京全式金生物技术有限公司;随机六聚体引物 (Random Primer)、RNA提取试剂盒、反转录酶、DNA Marker DL-2 000、pMD18-T Vector,购自TaKaRa宝生物工程(大连)有限公司;DMEM 培养基(GIBICOCat.No.12100-038),购自Invitrogen公司;胎牛血清(FBS)Gibco.Cat.No.10099-141;0.25%胰蛋白酶为本实验室保存;0.22μm 微孔滤膜;TI-SM 倒置显微镜(Nikon E-clipse TS100);MCO-18AIC (UV)CO2培 养 箱(SANYO Electric CO.Led made in JAPAN);2700型PCR仪(美国 ABI公司)等仪器;CO2(99.99%),哈尔滨黎明气体有限公司;ULTROSPEC 1100pro型紫分光光度计(GE Healthcare,美国)。
1.3 病毒的分离培养
1.3.1 分离病毒 自2006年至2009年,每年的11~12月份,将大量打皮期的乌苏里貉的肺脏小心取出,剪去上部气管,插入无菌注射器,灌注PBS,轻轻按摩肺脏,自气管倒出收集,反复3次,离心收集细胞,加入适量DMEM后,肺脏巨噬细胞反复冻融3次,过滤除菌备用。
1.3.2 应用ELISA筛选阳性样本 巨噬细胞冻存液100μL,过夜包被在ELISA板上;次日3%牛血清白蛋白封闭1h,PBST洗涤3次,5min/次;加自制的狐血清的犬瘟热多克隆抗体,室温孵育1h,洗涤3~4次,5min/次;然后加鼠抗狐IgG单克隆抗体,室温孵育1h,洗涤3~4次,5min/次;最后加兔抗鼠酶标抗体,室温孵育1h,洗涤5次,5min/次;加联苯二胺显色5min,加3NHCl终止反应,目测阳性样本。
1.3.3 病毒培养 在37℃下培养Vero细胞,当细胞长3~4d后传代培养,一般按1传3或4传代,同步接种样本毒,在37℃培养,每天观察细胞变化,并与正常作对照观察。盲传5代没有病变的阴性丢弃,阳性样本应用RT-PCR鉴定。
1.3.4 蚀斑克隆分离单个毒株 在Vero细胞中同步接种分离的病毒,接毒10h后,加入血清含量为2%无酚红DMEM营养琼脂,第5天后,加入含中性红的DMEM营养琼脂染色,第6天,便形成蚀斑,挑取大小不同的蚀斑,克隆3次后选择中等蚀斑克隆大小(0.5~0.8mm)的毒株。经蚀斑克隆分离后,再继代培养病毒,直到稳定的细胞病变产生为止。
1.4 分离病毒RT-PCR鉴定
1.4.1 引物设计与合成 由犬瘟热病毒F基因保守区设计1对引物进行病毒鉴定,预期扩增的基因片段长度为324bp。F1:5′-ACTTGCAGGTGTAGCTTTAGG-3′;F2:5′-AATACGATCACGTAAACTCGG-3′。根据 CDV Onderstepoort株 F基因序列,设计1对特异性引物,预期扩增的基因片段长度为1 053bp。F3:5′-GGG TACCTCCAACCTCAATGCTCAAG-3′;F4:5′-CGGATC CAGAGCGCCTAACCGTCTC-3′[5]。引物由上海生工生物工程技术服务有限公司合成。
1.4.2 RNA的提取与反转录 参照RNA提取试剂盒的说明提取总的RNA。总RNA 5μL,随机六聚体引物1μL,70℃保温10min后迅速在冰上急冷2min以上。上述模板6μL,5×M-MLV Buffer 2μL,dNTP Mixture(10mmol/L)0.5μL,RTase M-MLV(RNase H-)0.8μL,加 DEPC水至10μL。反转录条件42℃保温1h,70℃保温15min后冰上冷却,得到cDNA溶液。
1.4.3 病毒cDNA的PCR扩增 总反应体系25 μL:Taq(5U/μL)0.5μL,10×PCR Buffer 2.5 μL,上下游引物各1μL,dNTP Mixture(2.5mmol/L)2.5μL,模板3μL,ddH2O 14.5μL。反应条件:94℃预变性2min,94℃热变性30s,50℃退火30s,72℃延伸30s,共35个循环,最后72℃延伸10 min。
1.4.4 PCR扩增产物的鉴定 将PCR产物进行1%的琼脂糖凝胶电泳鉴定,在投射紫外灯下观察并照相[6]。同时进行胶回收,将PCR扩增片段克隆进pMD18-T中,构建的重组质粒经PCR鉴定后送去上海英骏生物技术有限公司进行测序。
1.5 病毒感染力(TCID50)测定 测定5、10、15代毒的TCID50,在1.5mL离心管中将病毒作连续10倍的稀释,从10-1~10-10。将稀释好的病毒接种到96孔细胞培养板中,每一稀释度接种一纵排共8孔,每孔接种100μL。在每孔加入细胞悬液100 μL,使细胞量达到2~3×105个/mL。设正常细胞对照,正常细胞对照作两纵排(100μL生长液+100 μL细胞悬液)。逐日观察并记录结果,一般需要观察3~5d。
1.6 血清中和试验 取该毒株细胞培养物5mL,加入CDV阳性血清1.2mL,混匀.置37℃感作1 h,取感作后的细胞培养物接种Vero细胞单层两瓶,接种量为细胞培养液的10%,于37℃中培养,设未中和的细胞培养物对照两瓶,同时设正常细胞对照两瓶,逐日观察CPE情况。
2 结果
2.1 病毒的分离 在接毒细胞的前3代没有出现明显病变,但盲传至第4~5代时,出现规律性细胞融合。如图1所示在细胞培养的不同时间出现的细胞病变。
2.2 蚀斑克隆结果 克隆3次,直径0.3~0.5,0.5~0.8及0.7~0.9mm 的克隆株各1个,经TCID50鉴定 ,0.1mL TCID50均在104.5以上。
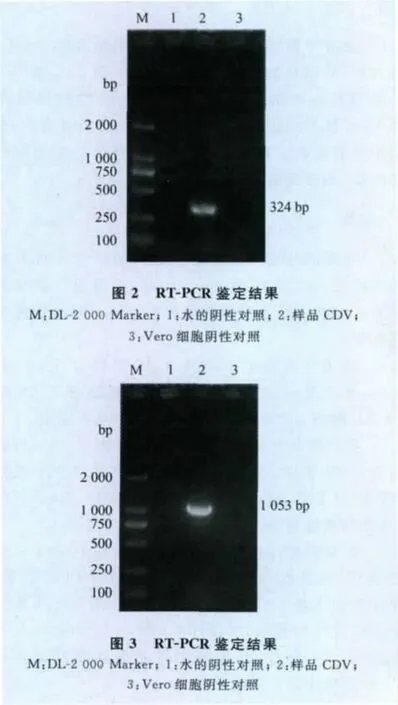
2.3 RT-PCR扩增试验结果 用引物F1、F2对病毒株CDV/R-20/12的细胞培养物提取RNA进行RT-PCR扩增,PCR产物的电泳条带约324bp(图2),表明此毒株为犬瘟热病毒。
2.4 F基因测序结果 用犬瘟热引物F3、F4对病毒株CDV/R-20/12的细胞培养物进行PCR扩增,结果扩出1条1 053bp的电泳条带(图3),PCR产物经过克隆后测序,所得序列(图4)与GenBank的CDV序列进行比对,证明所得的毒株序列确实是CDV病毒序列。
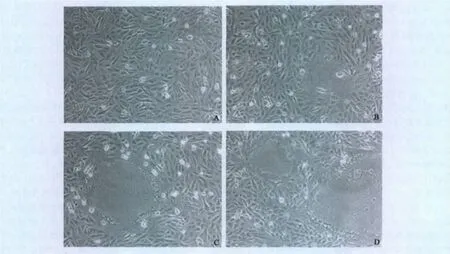
图1 细胞培养病变情况
2.5 病毒感染力测定结果 按Reed-Muench的计算方法,计算前10代病毒的TCID50,计算结果如下表(表1)。
2.6 血清中和试验结果 用CDV参考阳性血清与该毒株的细胞培养物进行中和试验,结果该分离株可被完全中和,未中和的培养物对照两瓶均病变,正常细胞均未病变,表明该分离毒株为CDV。
3 讨论
本试验在貉取皮期,在未发病的乌苏里貉养殖场中,从肺脏和腹水中收集巨噬细胞,应用ELISA筛选犬瘟热阳性样本,通过Vero细胞分离培养,能看出典型CPE,经蚀斑克隆纯化,RT-PCR鉴定以及血清学试验,证明获得1株犬瘟热毒株。病毒经20代传代培养,可以在Vero细胞稳定生长,TCID50维持在104.5~5.5/0.1mL之间。
目前对CDV感染的动物还没有特异的治疗方法,目前对家犬犬瘟热的治疗多采用对症治疗、抗犬瘟热血清和单克隆抗体法进行治疗。但是,对于毛皮动物养殖业,这种治疗方法不够经济,不能够普及利用[1]。因此,研制有效的疫苗显得尤为重要,本试验中分离的毒株并未导致貉子发病,需要更进一步的试验研究,从而确定该毒株是否为弱毒株,进而为貉源犬瘟热疫苗的研制奠定基础。

图4 CDV分离毒株F蛋白基因部分序列

表1 Vero细胞病毒液1~10代的TCID50
[1] 谭婷婷,张立恒,刘志平,等.狐源性犬瘟热病毒抗血清的制备及其初步应用[J].中国兽医杂志,2009,45(7):73-74.
[2] Dal Pozzo Fabiana,Galligioni Viola,Vaccari Francesca,etal.Antiviral efficacy of EICAR against canine distemper virus(CDV)in vitro[J].Research in Veterinary Science,2010,88:339-344.
[3] 刘澜澜,华育平,曾祥伟,等.狐貉源犬瘟热病毒核蛋白基因的克隆及序列比较分析[J].东北林业大学学报,2007,35(9):61-63.
[4] Lan N T,Yamaguchi R,Kawabata A,etal.Stability of canine distemper virus (CDV)after 20passages in Vero-DST cells expressing the receptor protein for CDV [J].Veterinary Microbiology,2006,118:177-188.
[5] 苏凤艳,魏吉祥,王卓聪,等.犬瘟热病毒水貂株的分离与鉴定[J].东北林业大学学报,2010,38(2):79-82.
[6] 苏凤艳,宗春苗,王卓聪,等.水貂源犬瘟热病毒的分离鉴定[J].吉林农业大学学报,2006,34(6):674-677.
[7] 叶俊华,夏咸柱,徐玉生,等..几种犬瘟热弱毒疫苗免疫效果比较研究[J].江西畜牧兽医杂志,2003,2:37-38.
——乌苏里白鲑

