超高效液相色谱—串联质谱法检测鸡组织中黏杆菌素残留
林 巍,李继昌,李 健
(1.齐齐哈尔大学食品与生物工程学院,黑龙江 齐齐哈尔161006;2.东北农业大学动物医学院,黑龙江 哈尔滨150030;3.澳大利亚蒙纳什大学药学院FADDI实验室,墨尔本 维多利亚3052)
黏杆菌素(Colistin)是由多黏芽孢杆菌培养液中获得的碱性多肽类抗生素,主要成分为黏杆菌素A(ColistinA)和黏杆菌素B(ColistinB),对革兰阴性杆菌有强烈的抑菌作用,临床常用其硫酸盐。兽医临床中硫酸黏杆菌素常用于畜禽大肠杆菌性下痢和其他肠道细菌感染的治疗。黏杆菌素还作为饲料添加剂,广泛用于畜禽养殖生产中[1]。由于其神经毒性和肾毒性,我国规定黏杆菌素在牛、羊、猪、鸡、兔的肌肉、肝的最高残留限量为150μg/kg,在肾的残留量为200μg/kg。国外报道黏杆菌素的检测方法主要有微生物法、薄层色谱法、免疫学法毛细管电泳法和高效液相色谱法以及液相串联质谱法[2-6]。国内报道的主要是微生物检测方法和液相色谱法[7],其中微生物检测方法灵敏度低,而高效液相色谱荧光检测法通常衍生过程复杂,黏杆菌素保留时间也较长,不适合大批样本操作,液相串联质谱法报道较少。本试验旨在建立一种灵敏、可靠的检查鸡组织中黏杆菌素药物残留的超高效液相色谱-串联质谱分析方法,保障动物源性食品的安全和维护人们的健康,为今后对黏杆菌素在鸡组织中的残留监控提供技术手段。
1 材料和方法
1.1 仪器和设备 XevoTMTQ-S串联四极杆质谱仪:美国 Waters公司;Waters Masslynx质谱工作站软件;T25digital组织匀浆机:IKA公司;RV10 digital旋转蒸发仪:IKA公司;CL-043低温冷冻离心机、N-EVAP氮吹仪:Thermo Fisher公司;美国Organomation;XP205电子天平:Mettler Toledo公司;固相萃取装置:Supelco公司;C18小柱(规格500 mg/3cc):Waters公司。
1.2 药品与试剂 硫酸黏杆菌素标准品:Sigma公司;乙腈、色谱纯:Thermo Fisher公司;甲醇、甲酸、正己烷、盐酸、分析纯:国药集团化学试剂有限公司;Milli2Qsynthesis系统制备的高纯水。
标准储备溶液:准确称取硫酸黏杆菌素标准品1.2mg倒入10mL的容量瓶中,用超纯水溶解稀释到100μg/mL的黏杆菌素标准储备液,4℃冷藏保存。使用时,逐级稀释成系列标准浓度;提取液:V(乙腈)∶V(1moL/L盐酸水溶液)=1∶1;洗脱液:V(甲酸)∶V(甲醇)=3∶7。
1.3 样品的处理
1.3.1 样品提取 称取2.0g鸡组织(肝脏、肾脏、脑和肌肉)样品于50mL离心管中,加入10mL提取液,高速匀浆后4 000r/min(4℃)离心10min。将上清液转移到梨形瓶中,在离心管中加入10mL提取液重复提取1次,合并上清液。
1.3.2 样品净化 将梨形瓶中的上清液旋转蒸发去除乙腈。加入正己烷10mL混匀后4 000r/min(4℃)离心10min。将下层水相转移到离心管中。C18小柱依次用甲醇、水各5mL活化,取离心管中全部样品过柱,依次用20mL/L乙腈水溶液、水2 mL淋洗柱子,抽干,用3mL洗脱液洗脱于试管内,充分涡旋混匀;氮吹后定容到1mL,经0.22μm滤膜后进行测定。
1.4 测定
1.4.1 色谱条件 色谱柱:Acquity UPLC BEH C18(50mm×2.1mm),粒径1.7μm(Waters公司);流动相A:1mL/L甲酸乙腈溶液;流动相B:2 mL/L甲酸水溶液;梯度洗脱程序见表1;流速0.3 mL/min;柱温30℃;进样量5μL。

表1 梯度洗脱程序
1.4.2 串联质谱条件电离模式 电喷雾离子源,正离子电离(ESI+);监控模式:多反映监测(MRM);毛细管电压3.0kV;离子源温度150℃;脱溶剂气流量700L/h;锥气孔流量50L/h;去溶剂温度450℃;碰撞气流量0.24L/min;碰撞室压力3.32e-5mbar;经过优化的质谱参数见表2。
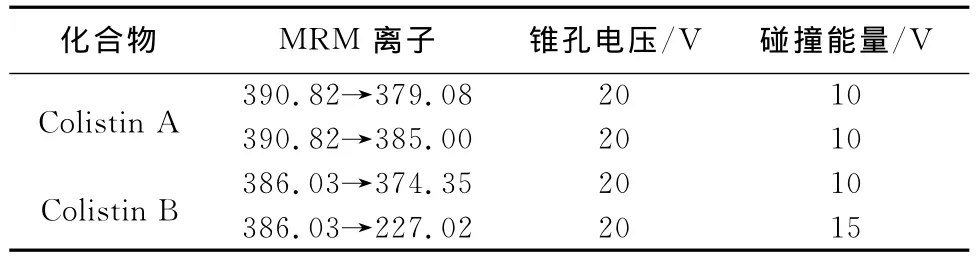
表2 黏杆菌素的母离子、子离子及质谱参数
1.5 标准工作曲线的绘制 准确称取2.0g鸡组织(肝脏、肾脏、脑和肌肉)空白样品于离心管中,依次加入20μL不同浓度的黏杆菌素标准溶液,漩涡混匀,使样品中黏杆菌素的质量浓度分别为1.00 μg/g、0.50μg/g、0.20μg/g、0.10μg/g、0.05μg/g、0.02μg/g、0.01μg/g。以加入20μL水的样品作对照品。按前述方法进行处理和测定。将黏杆菌素A和黏杆菌素B的定量离子峰面积和对浓度作线性回归,求得标准曲线方程和相关系数,每个样品测定3次。
1.6 检测限和定量限的确定 取空白组织样品,分别制得0.01μg/g、0.02μg/g和0.05μg/g 3个空白组织添加浓度,每个浓度设5个平行。按上述样品前处理方法操作,测得噪音信号的平均值,按信噪比≥3为检测限,信噪比≥10为定量限。
1.7 添加回收率和精密度 准确称取鸡组织(肝脏、肾脏、脑和肌肉)空白样品2.0g于离心管中,加入一定体积的黏杆菌素标准溶液至样品中,使黏杆菌素在组织中的浓度为0.02μg/g、0.10μg/g、1.00 μg/g。按照本方法确定的条件进行加标回收重复性试验,每批做6个重复,共做4个批次,计算回收率及日内和日间变异系数。
2 结果与讨论
2.1 色谱-质谱条件的选择与优化 本试验采用的流动相参考了Eric等[8]的报道,为了完善色谱峰型在其基础上做了改变,调整了甲酸水溶液中甲酸的含量,将甲酸由1mL/L增加到2mL/L,同时乙腈中添加少量甲酸增加了离子化效率,流动相A和B最终分别为1mL/L甲酸乙腈和2mL/L甲酸水溶液。同时探讨了流动相A的比例为90%、80%、60%和50%时的分离情况和峰形,发现当A相为80%时药物色谱峰形最佳,且需要的分析时间最短。串联质谱条件的选择,分别采用正离子扫描模式和负离子扫描模式对黏杆菌素进行检测,结果发现黏杆菌素在负离子扫描模式下质谱响应弱,而在正离子扫描模式下则得到了明显的分子离子峰。在正离子扫描模式下确定了药物的最佳碰撞能(如表2),黏杆菌素A和黏杆菌素B的定量离子分别为390.82→379.08和386.03→374.35。由于药物两种主要成分的分子量相近,保留时间基本一致,均在1.52 min处出现了色谱峰,定量分析时取其峰面积之和。
2.2 样品前处理条件的确定 根据文献报道,黏杆菌素在酸性条件下稳定,首先选用了常用的三氯乙酸作为提取试剂,同时为了去除血浆中的蛋白加入了乙腈[6],设定了几个不同浓度的配比,但是都没有得到满意的回收率。通过尝试在乙腈中加入1moL/L盐酸[2]进行提取,获得不错的回收添加率,比较了1 moL/L盐酸比例为0%、10%、30%、50%、70%和100%时的提取效果,结果表明,在V(乙腈)∶V(1 moL/L盐酸)体积比1∶1的情况下获得较好的回收率。样品净化[3]中,洗脱液我们尝试了酸性洗脱、碱性洗脱和中性洗脱,最后选择体积比V(甲酸)∶V(甲醇)为3∶7的甲醇酸性溶液,结果表明,在回收率和净化效果方面均能获理想的效果。
2.3 方法性能评价
2.3.1 标准工作曲线及线性范围 在选定的色谱条件下进行 UPLC/MS/MS测定,在0.01μg/g~1.00μg/g范围内,黏杆菌素峰面积和与浓度呈线性相关,相关系数r>0.997,结果见表3。
2.3.2 回收率与精密度 浓度为0.02μg/g、0.1 μg/g、1.0μg/g的黏杆菌素在鸡组织(肾脏、肝脏、肌肉和脑)中添加回收率在83.43%~98.15%之间,日内和日间变异系数(RSD)均小于10%,见表4。结果表明,采用本方法测定动物组织中的黏杆菌素具有较好的精密度和重复性。空白组织添加标准品及空白组织样品的色谱图见图1。

表3 方法的线性范围及标准曲线回归方程

表4 鸡组织中黏杆菌素不同浓度的回收率和变异系数
2.3.3 检测限与定量限 采用本试验中样品处理方法,在所建立的色谱条件下,能将黏杆菌素与组织中其他组分较好的分离,黏杆菌素在鸡组织中的定量限为20μg/g,最低检测限为10μg/g。
3 结论
本方法灵敏度高,样品提取简单,在2min内即可完成检测过程,体现了定量准确、操作简便易行、分析时间短的优点。鉴于国内鸡组织中黏杆菌素残留限量规定为150μg/g,本试验建立的黏杆菌素残留检测UPLC-MS/MS方法能够满足鸡组织中黏杆菌素残留检测的要求。
[1] Decolin D,L Eroy P,Nicolas A,etal.Hyphenated liquid chromatographic method for the determination of colistin residues in bovine tissues[J].J Chromatogr Sci,1997,35(12):557-564.
[2] Li J,Milne R W,Nation R L,etal.A simple method for the assay of colistin in human plasma,using pre-column derivatization with 9-fluorenylmethyl chloroformate in solid-phase extraction cartridges and reversed-phase high-performance liquid chromatography[J].J Chromatogr B:Biomed Sci Appl,2001,761(2):167-175.
[3] Li J,Milne R W,Nation R L,etal.Simple method for assaying colistin methanesulfonate in plasma and urine using highperformance liquid chromatography,Antimicrob Agents Chemother[J].Antimicrob Agents Chemother,2002,46:3304-3307.
[4] Li J,Milne R W,Nation R L,etal.Use of high-performance liquid chromatography to study the pharmacokinetics of colistin sulfate in rats following intravenous administration,Antimicrobial Agents Chemotherapy[J]. Antimicrobial Agents Chemotherapy,2003,47:1766-1770.
[5] Britt J,Matti K,Otto C,etal.Quantitative analysis of colistinA and colistinB in plasma and culture medium using a simple precipitation step followed by LC/MS/MS[J].Pharm Biomed Anal,2009,49:760-767.
[6] Wan E C H,Ho C,Della W S,etal.Detection of residual bacitracin A,colistin A,and colistin B in milk and animal tissues by liquid chromatography tandem mass spectrometry[J].Anal Bioanal Chem,2006,385:181-188.
[7] 丁焕中,吴洁珊,曾振灵,等.动物组织黏菌素残留柱前衍生化高效液相色谱-荧光检测方法的建立[J].中国兽医科学,2009,39(5):461-464.
[8] Eric C W,Clare H,Della W S,etal.Detection of residual bacitracin A,colistin A,and colistin B in milk and animal tissues by liquid chromatography tandem mass spectrometry[J].Anal Bioanal Chem,2006,385:181-188.
[9] Ma Z,Wang J P,Gerber J P,etal.Determination of colistin in human plasma,urine and other biological samples using LCMS/ MS[J].J Chromatogr B:A nal Technol Biomed Life Sci,2008,862:205-212.
[10]Cao G Y,Ali F E A,Chiu F,etal.Development and validation of a reversed-phase high-performance liquid chromatography assay for polymyxin B in human plasma[J].Antimicrobial Chemotherapy,2008,343(9):343-349.
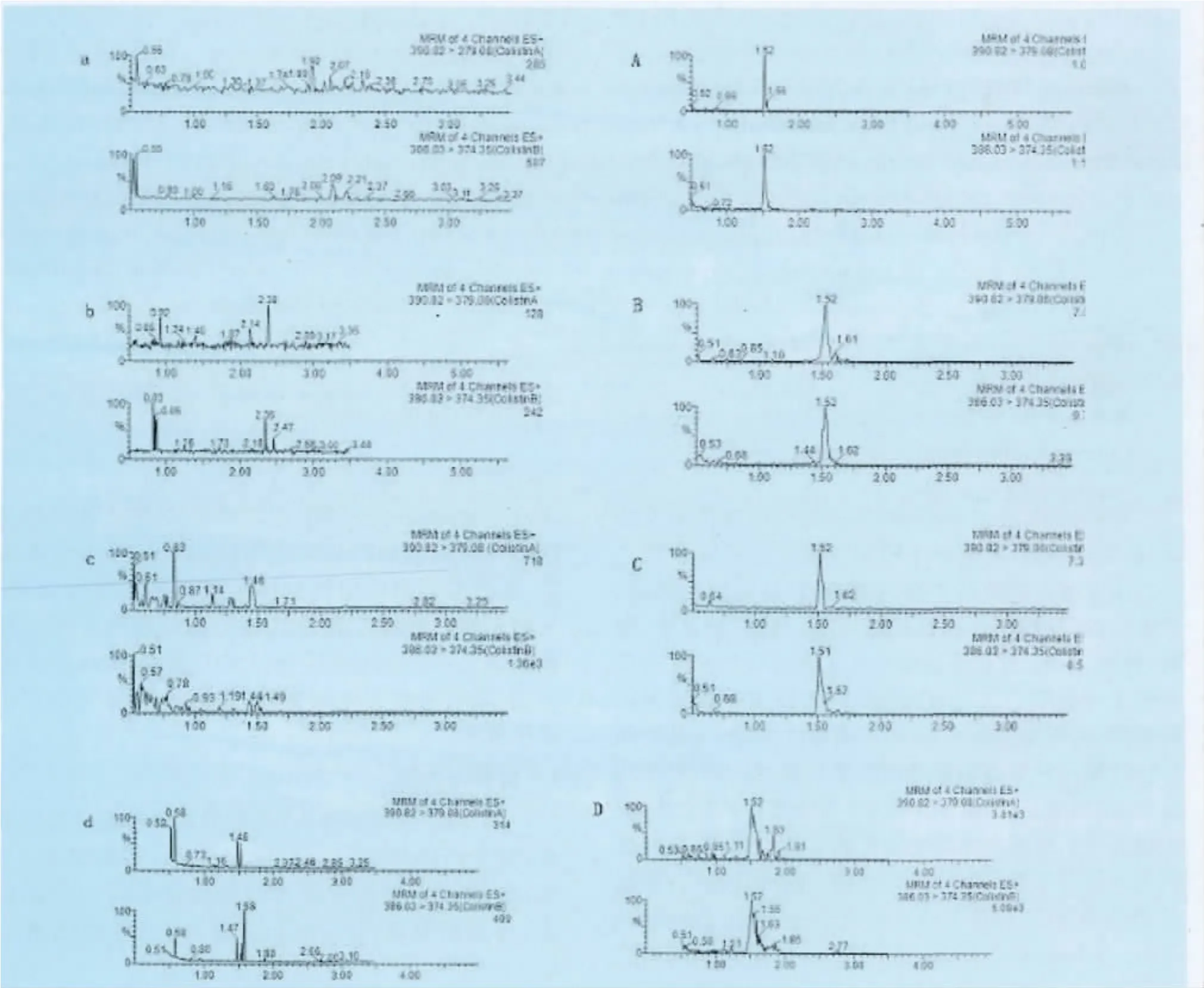
图1 空白样品肝脏(a)、脑(b)、肾脏(c)、肌肉(d)的色谱图和肝脏(A)、脑(B)、肾脏(C)和肌肉(D)的黏杆菌素添加回收的色谱图(0.02μg/g)

