贝类派琴虫二温式PCR检测方法的建立及初步应用
谢丽基,谢芝勋,刘加波,庞耀珊,邓显文,谢志勤,范 晴
(广西壮族自治区兽医研究所 广西畜禽疫苗新技术重点实验室,广西 南宁530001)
随着海水养殖规模的日益扩大及密度的持续增高,贝类的病害也频繁出现,其中奥尔森派琴虫(Perkinsus olseni)感染的危害较大,在我国[1]、韩国[2]和日本[3]均有过报道。奥尔森派琴虫感染是海水养殖贝类最为常见的病害之一,可引起贝壳不能闭合,套膜收缩,性腺发育抑制,生长缓慢,偶尔也会出现脓肿,死亡率可高达95%[4]。
目前派琴虫的检测有雷氏液体巯基醋酸盐培养基(RFTM)法和ELISA 方法等[1,5]。但这些方法均存在一定的局限性。RFTM方法缺乏专一性,检测用时需7d以上,且只能检测到派琴虫的休眠孢子,而ELISA检测方法的敏感性较差。病原检测、筛选建立无特定病原体的健康群,仍然是目前预防与控制派琴虫的最有效办法。PCR方法具有操作简便、敏感性高、特异性强、重复性好等优点,已成为检测派琴虫的重要方法[6]。
二温式聚合酶链反应,即二温式PCR,又称双温PCR、或二温度点法PCR和二温度梯度PCR,是根据经典PCR技术原理,对标准PCR进行改进,将退火和延伸合并为一个温度,比标准PCR的退火温度高,提高了反应的特异性,缩短了检测时间[7-8]。近年来该方法应用比较广泛,主要用于水产品、哺乳动物、禽类及植物中病原菌的快速检测。目前国内还未见有建立派琴虫二温式PCR检测方法的报道,本研究设计了一对特异性引物,建立了派琴虫的二温式PCR快速检测方法。
1 材料与方法
1.1 主要仪器与试剂 PCR试剂盒及pMD18-T试剂盒,购自宝生物工程(大连)有限公司;DNA片段回收试剂盒和海洋动物组织基因组DNA提取试剂盒,购自广州东盛生物科技有限公司。PCR仪为美国Perkin Elmer Cetus公司生产的PE9600仪。
1.2 病原体和质粒DNA 派琴虫、单孢子虫、折光马尔太虫、副溶血弧菌、溶藻弧菌和河弧菌等由本室保存;pMD-Perkinsus质粒由本实验室构建保存[9]。
1.3 引物设计与合成 根据GenBank中派琴虫的保守序列,通过Blast验证,设计了1对特异性引物P276-1和 p276-2,扩增大小为276bp。引物由TaKaRa公司合成,序列如下:
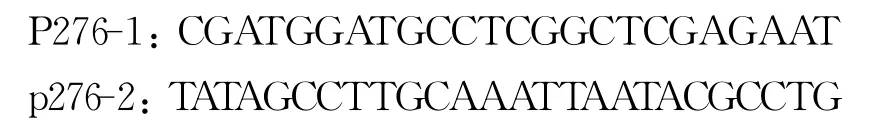
1.4 核酸抽提 取待检贝类的鳃组织约100mg,匀浆后根据海洋动物组织基因组DNA提取试剂盒的说明书提取DNA。对病原体DNA的抽提按同样方法进行。
1.5 二温式PCR扩增介质及各反应条件的优化在50μL的反应体系中含:25mmol/L MgCl22.5 μL,10×PCR Buffer 5μL,10mmol/L dNTP 1 μL,Taq聚合酶5单位0.25μL,适当浓度的上游引物和下游引物,模板1μL。以抽提的派琴虫DNA为模板,对二温式PCR各循环参数和各引物浓度等进行优化,以确定最佳的二温式PCR模式。
1.6 二温式PCR特异性试验 对已提取的派琴虫、单孢子虫、折光马尔太虫、副溶血弧菌、溶藻弧菌和河弧菌的DNA进行扩增,检验所建立的二温式PCR的特异性。
1.7 二温式PCR的敏感性 测定pMD-Perkinsus质粒的含量后,按10倍递增稀释成10ng、1ng、100 pg、10pg、1pg、100fg、10fg、1fg、0.1fg、0.01fg、0.001fg,分别加入到最佳的二温式PCR反应体系中进行扩增,检测模板的最低检测量。
1.8 临床样品的检测 应用本研究所建立的二温式PCR方法,对2012年采自广西225份牡蛎、41份贻贝、40份文蛤,连云港的48份菲律宾蛤仔,温州的102份溢蛏和58份血蛤进行检测。
1.9 二温式PCR产物的电泳分析及克隆测序 对1.8中检测为阳性的牡蛎、菲律宾蛤仔和溢蛏,取50 μL二温式PCR产物进行凝胶电泳,在紫外灯下用刀片切割所需的片段,然后用凝胶回收试剂盒纯化回收。取适量纯化回收的二温式PCR产物,与pMD18-T于16℃连接过夜,转化DH5α大肠埃希菌。挑取阳性克隆菌送宝生物工程(大连)有限公司进行测序,测序结果进行Blast比对分析。
2 结果
2.1 二温式PCR条件优化 通过对二温式PCR的引物浓度、各反应温度、时间及循环次数等进行优化,最后确定二温式PCR中P276-1和p276-2引物的最佳工作终浓度为0.3μmol/L,二温式PCR的最佳反应模式为94℃变性5min,然后进入94℃变性30s,65℃退火30s,共进行32个循环,最后再经65℃延伸10min后,于4℃结束反应。
2.2 二温式PCR特异性扩增结果 应用最佳反应体系,对派琴虫、单孢子虫、折光马尔太虫、副溶血弧菌、溶藻弧菌和河弧菌的核酸进行PCR扩增,结果仅有派琴虫能扩增出与试验设计大小相符的DNA扩增带;而其他对照病原体DNA在相同位置却无任何DNA扩增带(图1)。

图1 二温式PCR的特异性试验
2.3 二温式PCR的敏感性扩增结果 经过敏感性测定,该二温式PCR最低能检出1fg的pMD-Perkinsus质粒模板(图2)。
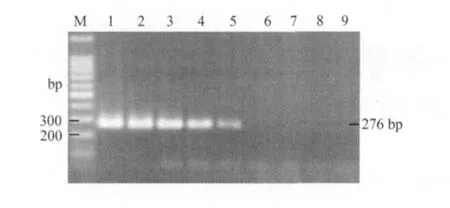
图2 敏感性试验
2.4 临床样品的检测 应用建立的二温式PCR方法,对2012年采自广西225份牡蛎、41份贻贝、40份文蛤,连云港的48份菲律宾蛤仔,温州的102份溢蛏和58份血蛤进行检测,结果广西的牡蛎检出派琴虫27份,连云港的菲律宾蛤仔检出派琴虫12份,温州的溢蛏中检出6份(部分检测结果见图3),而其他未检出。
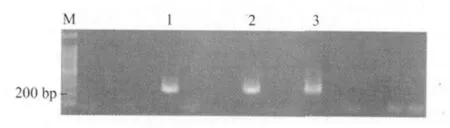
图3 部分临床样品检测的结果
2.5 测序结果与序列分析 经测序结果分析及Blast比对分析,证明了牡蛎、菲律宾蛤仔和溢蛏的派琴虫PCR扩增产物,大小为276bp,与设计大小相符。PCR产物的核酸序列与引物设计模板的基因对应片段的同源性一致。说明本研究建立的二温式PCR方法,适用于贝类派琴虫的检测。
3 讨论
一般PCR仪的升温速度为4℃/s,68℃到80℃升温时间约为3s;Taq DNA聚合酶活性最佳温度为72℃,此温度下的延伸速度为150bp/s~300bp/s,对于相对较短的DNA片段,可将退火、延伸温度合并为一个温度,在较短时间内引物与模板退火结合已经充分延伸形成产物片段,因此采用二温式PCR能产生与三步PCR同样多的产物。因此,本试验在设计引物时,有意识的提高了引物的Tm值,使引物与模板能准确结合而且稳定性好,以减少非特异扩增。
本试验所建立的派琴虫二温式PCR方法,具有操作简便、检测快速、敏感性高和特异性强等优点,目前还未见有建立派琴虫二温式PCR检测方法的报道。本试验建立了派琴虫的二温式PCR检测方法,全程(包括核酸提取、二温式PCR扩增和电泳)仅需约5h,比常规PCR[10]检测时间缩短1h。该二温式PCR对派琴虫扩增出与设计大小相符的276 bp条带,而对其他5种病原体则均不能扩增出任何条带,具有很好的特异性;同时该二温式PCR检测方法的敏感性最低可检测到1fg的pMD-Perkinsus模板,说明该二温式PCR检测方法具有很高的敏感性,这对于在贝类派琴虫的发病早期提供准确的诊断结果,切断其传播途径有重要意义,同时也是选育建立无派琴虫病的健康贝类养殖群所必要的。
应用建立的二温式PCR方法,对2012年采自广西225份牡蛎、41份贻贝、40份文蛤,连云港的48份菲律宾蛤仔,温州的102份溢蛏和58份血蛤进行检测,结果广西的牡蛎检出派琴虫27份,连云港的菲律宾蛤仔检出派琴虫12份,温州的溢蛏中检出6份,检测结果表明,在广西牡蛎、连云港的菲律宾蛤仔和温州的溢蛏中存在派琴虫的感染,在国内首次检出溢蛏中存在派琴虫的感染,提示我们在贝类的养殖中应特别注意防治派琴虫的感染。
[1]Hine P M and Thorne T,Haplosporidium S P.(Alveolata:Haplosporidia)associated with mortalities among rock oysters Saccostrea cuccullata in north Western Australia[J].Dis Aquat Organ,2002,51(2):123-33.
[2]Spencer Russell,Salvatore Frasca J,Inke Sunila,et al.Application of a multiplex PCR for the detection of protozoan pathogens of the eastern oyster Crassostrea virginica in field samples[J].Dis Aquat Org,2004,59:85-91.
[3]Haskin H H,Stauber L A,Mackin J A.Minchinia nelsoni n sp(Haplosporidia Haplosporidiidae):causative agent of the Delaware Bay oyster epizootic[J].Science,1966,153:1414-1416.
[4]Barber B J,Langan R,Howell T L.Haplosporidium nelsoni(MSX)epizootic in the Piscataqua River Estuary(Maine/New Hampshire,USA)[J].J Parasitol ,1997,83:148-150.
[5]Sunila I,Karolus J,Volk J.A new epizootic of Haplosporidia(MSX),a haplosporidian oyster parasite,in Long Island Sound[J].J Shellfish Res,1999,18:169-174.
[6]谢丽基,谢芝勋,庞耀珊,等.贝类单孢子虫PCR检测方法的建立[J].中国畜牧兽医,2010(1):54-56.
[7]王振宝,刘启生,哈森,等.牛环形泰勒虫病二温式PCR诊断方法的建立及初步应用[J].动物医学进展,2012,33(5):59-63.
[8]庞耀珊,谢芝勋,谢志勤,等.二温式PCR检测对虾白斑综合征病毒[J].中国兽医杂志,2003,39(4):43-45.
[9]谢芝勋,谢丽基,刘加波,等.贝类奥尔森派琴虫实时荧光定量PCR检测方法的建立及初步应用[J].中国病原生物学杂志,2009,4(7):517-519.

