复方痢菌净搽剂的制备及初步安全性稳定性考察
陈红伟,林永乐,吴俊伟,刘 娟,魏述永,张志强
(西南大学荣昌校区动物医学系,重庆 荣昌402460)
痢菌净,又称乙酰甲喹,是近年来经筛选确认有临床实用价值的兽用抗菌剂,对多数细菌有较强的抑制作用,对革兰阴性菌作用更强,对仔猪黄、白痢有效[1]。盐酸左旋咪唑为广谱、低毒驱线虫药,并有一定的免疫增强作用,临床上应用较为广泛[2]。本试验首次将非特异性免疫调节剂、驱虫药-左旋咪唑与当前防治仔猪肠型大肠杆菌病安全有效的药物-
痢菌净联合应用制备成透皮吸收制剂,临床用于防治仔猪大肠杆菌病并兼具驱虫作用,现将其制备工艺和初步安全性、稳定性考察报告如下。
1 材料与方法
1.1 材料
1.1.1 仪器 紫外检测仪(北京普析通用仪器有限责任公司);ZTY智能透皮扩散试验仪TP2A(巩义市英峪予华仪器厂);WZZ-2A2B自动旋光仪(河南兄弟仪器设备有限公司);JD100-3型电子天平(沈阳龙腾电子有限公司)等。
1.1.2 试药 痢菌净精制原料(含量:99.6%)、盐酸左旋咪唑精制原料(含量:99.7%)(均由重庆布尔动物药业有限公司惠赠);氮酮(分析纯,福建寿宁美菲思生物化学品厂);苯甲醇(分析纯,成都科龙化工试剂厂);1,2-丙二醇(分析纯,重庆东方试剂总厂)等。
1.1.3 试验动物 昆明系小鼠,体重18~22g,新西兰白兔,2.2±0.2kg体重,由西南大学荣昌校区实验动物中心提供。
1.2 方法
1.2.1 体外透皮试验方法[3]采用Franz扩散装置(ZTY智能透皮扩散试验仪),将经预处理的小鼠的皮肤固定在渗透扩散装置的扩散池与接受池之间,皮肤内层面向接受池,然后将复方痢菌净搽剂样品充满整个扩散池。在接受池中充满接受液并密闭封存,接受液温度维持在32℃±0.5℃。每次取样后均补加相同体积的新鲜接收液并排除接受室中的气泡,样液分别采用紫外分光光度法测定痢菌净浓度,用旋光法测定盐酸左旋咪唑浓度,并按如下公式分别计算其累积渗透量(Q)。

注:式中Q为单位面积累积透过量,A为透皮扩散面积,V为Franz扩散池接受室体积,Cn为第n次取样时接受液的浓度,Ci为第i次取样时接受液的浓度,Vi为取样量。
以单位面积累积渗透量Q对时间t进行线性回归所得方程即为Higuchi方程,所得斜率K即为透皮速率常数[单位为(μg/cm2·h)]。
1.2.2 药物含量检测方法
1.2.2.1 标准曲线的制备 精密称取痢菌净,用二甲基甲酰胺、盐酸溶解制得浓度为1、4、8、12、16、20 μg/mL的系列标准溶液,采用紫外检测仪测定其吸光度A(检测波长为381nm)[4]。以吸光度 A值(Y)对相应的痢菌净浓度(X)进行线性回归,得回归方程为:Y=0.0559X-0.0104,R2=0.9999(n=5)。说明,痢菌净在1~20μg/mL范围内呈良好的线性关系。
另精密称取盐酸左旋咪唑,用接收液制成1、5、10、15、20、25、30mg/mL的系列标准溶液,测定其旋光度[5](采用钠光谱D线,波长为589.3nm,管长度2dm,在20±0.5℃测定)。以旋光度值(Y′)对相应的盐酸左旋咪唑浓度(X′)进行线性回归,得回归方程为:Y′=-0.1128X′-0.0097,R2=0.999 9(n=5)。说明,盐酸左旋咪唑在1~30mg/mL范围内呈良好的线性关系。
1.2.2.2 回收率、变异系数、专属性检查[6]以4、12、20μg/mL 3个添加浓度(n=3)测定痢菌净的回收率分别为97.85%、101.22%、98.97%,日内变异系数分别为2.21%、1.74%和1.81%,日间变异系数分别为3.44%、2.13%和 2.34%;以 5、15、25 mg/mL 3个添加浓度(n=3)测定盐酸左旋咪唑的回收率分别为99.45%、102.32%、101.47%,日内变异系数分别为2.13%、1.65%和1.14%,日间变异系数分别为1.94%、2.06%和1.32%。另外,进行了两种药物之间以及与辅料间的专属检查,均符合要求,表明所建立的测定方法准确度、精密度、专属性均良好,满足试验要求。
1.2.3 正交试验设计 结合预试验,以4%痢菌净、7.5%盐酸左旋咪唑以及适量助溶剂为处方基础,选择氮酮(A)、苯甲醇(B)、丙二醇(C)、乙醇(D)4种辅料为可变因素,各取3个水平,采用L9(34)正交试验筛选透皮剂处方。按1.2.1中要求进行体外透皮试验,于1、2、4、6、8、10h取样,用紫外分析仪检测痢菌净含量,用旋光仪检测盐酸左旋咪唑含量,计算单位面积累积渗透量(Q),透皮速率(J),并以J为指标进行处方筛选。
1.2.4 工艺验证 将优化筛选出的处方制备3批样品,进行体外透皮试验,测定其透皮速率常数(J),最后确定该透皮剂最佳配方。
1.2.5 初步稳定性试验[7]温度加速试验:取3批样品,置于温度40℃±2℃、相对湿度为75%±5%密闭避光的容器中6个月,分别于0、1、3、6月末抽样检测1次,对性状、含量、澄明度等进行检测并记录。
光照加速试验:将3批样品置于光照箱中照射,定时翻动样品,在25℃±2℃,照度4500LX±500LX的条件下,放置10d,于第5天和第10天分别取出部分样品,对性状、含量、澄明度等进行检测并记录。
低温冷藏试验:取3批样品,置于4℃冰箱中冷藏6个月,每月末抽样检测1次,对性状、含量、澄明度等进行检测并记录,重点观察有无结晶析出。
1.2.6 初步安全性考察
1.2.6.1 皮肤刺激性试验[8]选健康无伤的白色家兔6只,试验采用同体的左右侧自身对比的方法,分为两组。完整皮肤组按照1mL/只的剂量在左侧去毛区涂搽试药,右侧去毛区涂生理盐水。破损皮肤组将去毛皮肤消毒并用针划井字形,以渗血为度,按照1mL/只的剂量在左侧渗血区涂搽试药,右侧去毛区生理盐水作对照。用医用纱布,胶带加以固定。每只兔子分笼饲养,给药24h后,用温水洗去残留的试药,每隔24h观察1次去毛处皮肤有无红斑和水肿情况。连续观察7d并记录。参考文献[8]进行评分并判断结果。
1.2.6.2 皮肤过敏试验[8]另选健康无伤的白色家兔6只,分为两组。第1组给复方痢菌净搽剂0.2mL只,第2组阳性对照(1%2.4-二硝基氯代苯)0.2mL/只。将受试药物(或阳性对照物)涂于家兔左侧去毛区域,用无刺激性的纱布和胶带覆盖、固定。每只家兔分笼饲养,持续6h,隔日致敏1次,共计3次。在末次致敏14d后,再进行激发接触,在背部右侧去毛区皮肤上,同上操作,6h后去除供试品。立刻观察,并于24、48、72h后观察有无过敏反应。参考文献记录各时间过敏反应值,计算过敏率并评价药物的致敏性[8]。
1.2.6.3 急性皮肤毒性试验[9]另选健康无伤的白色家兔9只,分为3组。高剂量组按3mL/只试液均匀涂于去毛区,低剂量组按1mL/只试液均匀涂于去毛区。对照组按2mL/只涂生理盐水。用医用纱布覆盖,并用无刺激的胶带加以固定,兔子分笼饲养。24h后用温水洗去残留受试药物。每隔24 h观察1次家兔的皮肤及四肢的活动状况,并记录心率,呼吸频率,饮食,饮水状况,连续观察7d。
2 结果与分析
2.1 正交试验结果 见表1。
经方差分析P>0.05,差异不显著,由直观级差分析可知:以痢菌净透皮速率常数J级差R为评价指标,各种因素的影响大小为B>A>D>C;以盐酸左旋咪唑透皮速率常数J级差R′为评价指标,各种因素的影响大小为A>B>C>D;综合级差R+R′,各种因素的影响大小为B>A>D>C。两项指标均表明A1B3C2D3为最佳工艺,即2.5%氮酮、14%苯甲醇、10%丙二醇、40%乙醇。
2.2 工艺验证 按照优化选定的处方制备3批样品,进行体外透皮试验,痢菌净透皮速率常数(J)平均值为8.10mg/cm2·h,盐酸左旋咪唑透皮速率常数(J′)平均值为17.65mg/cm2·h,均显著优于样品。2.3 初步稳定性试验 温度加速试验:3批样品第6月末痢菌净含量分别平均下降了2.69%(n=3),盐酸左旋咪唑平均下降了1.69%(n=3),各样品均为浅黄色澄明液体。
光照加速试验:3批样品包装组光照10d痢菌净含量平均下降了1.70%(n=3),盐酸左旋咪唑平均下降了0.71%(n=3);裸露组痢菌净含量平均下降了5.84%(n=3),盐酸左旋咪唑平均下降了1.02%(n=3)。包装组为浅黄色澄明液体,裸露组为红棕色液体。
低温冷藏试验:3批样品第6个月末痢菌净含量平均下降了0.82%(n=3),盐酸左旋咪唑平均下降了0.58%(n=3),各样品均为浅黄色澄明液体,未见析出。
结果表明,该工艺条件下该制剂稳定性较好,光照加速试验结果提示需避光保存。
2.4 初步安全性试验 皮肤刺激性试验、皮肤过敏性试验、急性皮肤毒性试验的结果分别见表2~表4。

表1 正交试验

表2 复方痢菌净搽剂对家兔的刺激性试验
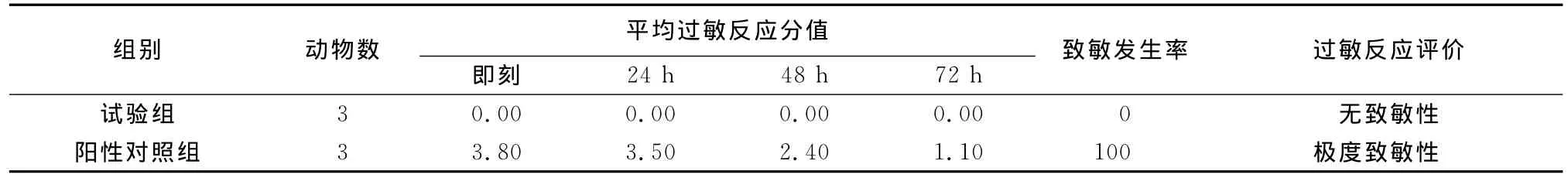
表3 复方痢菌净搽剂对家兔的致敏反映

表4 复方痢菌净搽剂对家兔的急性皮肤毒性试验
从表2~表4结果表明,该工艺制备的复方痢菌净搽剂无皮肤刺激性、无皮肤过敏性、无急性皮肤毒性。
3 讨论
大肠杆菌病是仔猪常见的消化道疾病,也是导致仔猪死亡的主要原因之一。目前对该类病的防治,主要包括菌苗免疫和药物防治。但由于因肠道微生物抗原和抗原决定簇复杂,免疫机制略有差异,免疫效果常不确切;另外,在应用药物防治过程中,临床上经常使用的药物由于长期应用往往疗效不佳,而一些常用剂型如粉散剂、注射剂等,或因采食量下降导致给药剂量不确实,或引起仔猪应激,导致本已降低的仔猪免疫力更为低下,因此均有其缺陷。搽剂亦称透皮剂,属于经皮给药系统。可绕过肝脏的首过效应,提高药物的生物利用度。同时,可避免内服药物对胃肠刺激及生理功能的干扰,使毒副反应减轻。另外,可减少应用传统剂型所引起的仔猪应激,提高仔猪抵抗力,节省人力物力[10]。
痢菌净和盐酸左旋咪唑的透皮制剂均有文献报道[1-2],但将二者联合制备成复方透皮制剂还未见报道,该制剂可用于防治仔猪大肠杆菌病并兼具驱虫作用。笔者曾将该制剂作为科研试验品在某猪场取得了不错疗效,但因稳定性较差,特此进一步进行处方优化和稳定性考察。处方中选取苯甲醇、丙二醇、乙醇为混合溶媒,以提高主要药物的溶解度。另外,透皮效率是透皮剂能否发挥疗效的关键环节,辅料中氮酮、丙二醇均为常见的透皮促进剂,本研究结合预试验以透皮速率常数为重要考察指标,兼顾累积透过量和稳定性,采用正交设计对处方进行了优化。最终确定复方痢菌净透皮剂的处方组成主要为:4%痢菌净、7.5%盐酸左旋咪唑、2.5%氮酮、14%苯甲醇、10%丙二醇、40%乙醇。根据优化处方制备的复方痢菌净搽剂稳定性好,无皮肤刺激性,含量测定方法简便,质量控制方法可靠。但为了最终研制出复方痢菌净透皮剂,还需结合临床试验对处方进行进一步优化。
[1] 李欣,操继跃.痢菌净透皮剂在猪体内的药物动力学及残留研究[D].武汉:华中农业大学,2007.
[2] 戴国华,王祥生,程远国,等.左旋咪唑擦剂的研制及其驱虫实验[J].中国兽药杂志,1997,31(3):25-26.
[3] 潘林梅,沈静,郭立玮.不同透皮促进剂对复方麻黄贴剂中麻黄碱透皮吸收的影响[J].中药新药与临床药理,2006,17(4):286-287.
[4] 康棣.痢菌净含量测定新方法[J].四川畜牧兽医,2001,28(125):19-21.
[5] 吴松华.旋光法测定法驱蛔净中盐酸左旋咪唑含量[J].中国医院药学杂志,1999,19(4):210-211.
[6] 曾经泽.生物药物分析[M].北京:北京医科大学中国协和医科大学联合出版社,1998:208-231.
[7] 农业部兽药评审中心.兽药研究技术指导原则汇编[M].北京:化学工业出版社,2011:47-51.
[8] 石照应,郭庆,王鲁,等.中药透皮剂安全性试验研究[J].中兽医医药杂志,2010,29(1):35-36.
[9] 张均田.现代药理实验方法学(下册)[M].北京:北京医科大学中国协和医科大学联合出版社,1998:1814-1820.
[10]符华林.兽用抗寄生虫药物新剂型及其新技术的研究进展[J].中国兽药杂志,2004,38(3):38-42.

